体外CM-DIL标记骨髓源性内皮祖细胞在胶原海绵上的研究
韩刘君,孙尧,于晓龙,谷玉
随着人口老龄化,与老龄化相关的疾病也在增加,其中,心血管疾病是导致老年人死亡的首要原因[1]。心血管疾病(CVDs)是一组包含高血压病、冠心病、脑血管病、外周血管病和心力衰竭等疾病的统称[2]。据预测,到2030年,每年约有2330万人死于心血管疾病[3],CVDs的致病原因主要是动脉粥样硬化,动脉粥样硬化的病理生理过程与血管内皮生长因子和血管生成素有关[4]。血管内皮细胞具有维持血管内稳态及调节细胞增殖的作用,而骨髓来源的内皮祖细胞可以再生内皮细胞[5]。内皮祖细胞(EPCs)来自外周血或骨髓,其作为内皮细胞(ECs)的前体细胞,通过修复内皮细胞单层受损的前动脉粥样硬化因子来阻止动脉粥样硬化的发生和发展[6]。EPCs可进入血液循环,直接募集到病变部位,在病变处,内皮祖细胞分化为成熟的内皮细胞,有助于缺血部位新生血管的形成,EPCs还可以分泌多种促血管生成因子,以促进损伤部位的内源性血运重建,EPCs具有很高的增殖、迁移和形成血管的潜力,这些能力在体外扩增过程中仍保持不变,因此,为干细胞移植和组织工程应用奠定了基础[7]。胶原海绵的结构是高度多孔的,具有相互连接的孔隙,因其特殊结构,便于细胞渗透和向细胞提供氧气和营养[8],因而成为组织工程学与再生医学移植方面应用较多的支架材料。
1 材料和方法
1.1 研究对象 实验教学用兔,雌雄不限,体重约在0.8 kg左右。
1.2 主要试剂与仪器
1.2.1 主要试剂 DMEM(Gibco公司,美国)、DMEM/F-12(Gibco公司,美国)、ECM培养基(Sciencell公司,美国)、胎牛血清(BI公司,以色列)、0.25%胰蛋白酶+0.02%EDTA(Gibco,美国)、Percoll分离液(Solarbio科技有限公司,北京)、CM-DIL(赛默飞世尔科技有限公司,中国)、CD31(博奥森,中国)、CD34(博奥森,中国)、胶原海绵(南昌沪士达医疗科技有限公司)、CCK-8试剂(弗元生物科技有限公司,上海)。
1.2.2 主要仪器 高速离心机(Thermo Forma,美国)、二氧化碳培养箱(Thermo公司,美国)、酶联免疫检测仪(Biotek公司,美国)、普通倒置光学显微镜(Olympus公司,日本)、倒置荧光显微镜(Olympus公司,日本)。
1.3 方法
1.3.1 BM-EPCs的分离及培养 实验教学用兔,10%水合氯醛溶液进行腹腔麻醉,75%酒精中浸泡消毒15 min;剥离双侧股骨和胫骨,尽量剔除股骨和胫骨表面的肌肉及筋膜,骨科咬骨钳去除股骨和胫骨两端,以能暴露骨髓腔尚可;用装有10 ml空白DMEM培养基的20 ml注射器对骨髓腔进行反复冲洗,直至骨髓腔变白为止;取一无菌50 ml离心管,将10 ml的Percoll分离液置于离心管底部,无菌胶头滴管将冲洗液缓慢加至Percoll分离液上,2000 r/min,15 min;吸取上述离心后液面层呈白色云雾状的液体(图1),于一无菌15 ml离心管中,PBS重悬,1000 r/min,5 min,重复2次;弃上清液,ECM完全培养基进行重悬,装于细胞培养瓶内,37.0℃、5%CO2细胞培养箱内培养;48 h后首次换液,每2 d更换培养基一次,待细胞融合度达80%~90%后可进行传代。
1.3.2 BM-EPCs的鉴定 取生长状态良好、细胞融合度达80%的EPCs进行消化、离心,并进行重悬;种植于细胞爬片上,48 h后,PBS冲洗3次(3 min/次);4%多聚甲醛固定15 min,PBS洗3次(3 min/次);室温条件下0.2%Triton X-100进行通透15 min,PBS洗3次(3 min/次);3%H2O2去离子水孵育10 min,PBS冲洗3次(2 min/次);山羊血清封闭30 min,不进行冲洗;滴加一抗,4℃冰箱过夜,PBS冲洗3次(2 min/次);避光条件下,滴加二抗,室温条件下孵育30 min;PBS冲洗3次×2 min;DAB显色2 min,自来水冲洗2次×2 min;风干后行中性树脂胶封片,显微镜下观察并拍照记录。
1.3.3 BM-EPCs的荧光标记 收集P2代BMEPCs,进行消化、离心,1 ml PBS进行重悬,加入CM-DIL标记液5 μl,吹打成细胞悬液,细胞培养箱内孵育5 min,转至4℃冰箱15 min,1000 r/min,离心5 min,弃上清液,PBS洗涤2次(2 min/次),加入ECM完全培养基继续培养。
1.3.4 监测标记后细胞的活力 CM-DIL标记后的BM-EPCs,进行消化、离心及重悬,细胞悬液与0.4%台盼蓝染液以9:1的比例进行染色,3 min后,倒置相差显微镜下计数活细胞(无色、透明状)和死细胞(蓝色),并计算细胞活力,活细胞率(%)=(细胞总数-死细胞数)/细胞总数×100%。
1.3.5 标记后BM-EPCs增殖能力检测 取标记后的EPCs,进行消化、离心,制成单细胞悬液;每孔3000个的细胞密度接种于96孔细胞培养板内,每组设置4个复孔,每孔内加入100 μl的细胞悬液和100 μl的DMEM/F-12完全培养基,设加单纯的完全培养基为空白孔,进行调零,于37.0℃、5%CO2细胞培养箱内继续培养;24 h后,移除旧完全培养基,加入100 μl的DMEM/F-12完全培养基及10 μl的CCK-8试剂(注意孔内不要产生气泡,否则会影响吸光度值的读数),细胞培养箱内孵育2 h,酶联免疫监测仪在450 nm处读取各孔的吸光度值(OD值),隔1天监测一次,连续监测9 d;时间为横坐标,吸光度值为纵坐标,以绘制标记后的BM-EPCs的生长曲线。
1.3.6 标记后的BM-EPCs与胶原海绵的复合培养 将胶原海绵剪成5×5×5 mm的大小;PBS浸泡1 h,10%的DMEM/F-12完全培养基进行浸泡1 h;收集P2代BM-EPCs,消化、离心,制成单细胞悬液;将处理的胶原海绵置于24孔细胞培养板内,滴加200 μl的细胞悬液,细胞培养箱内进行培养,30 min后,每孔内加入800 μl的DMEM/F-12完全培养基,继续培养,每隔2 h更换培养基。
1.3.7 苏木素-伊红染色观察BM-EPCs与胶原海绵的生长状况 取培养2周的BM-EPCs与胶原海绵复合物,经预温的PBS清洗2次,4%多聚甲醛常温下固定30 min,PBS清洗3次;经OCT包埋后,冰冻切片;HE染色,倒置相差显微镜下观察BMEPCs与胶原海绵的融合情况。
1.4 主要观察指标 ①BM-EPCs的形态学变化;②BM-EPCs的鉴定;③CM-DIL标记BM-EPCs;④标记后细胞活力和增殖能力的监测;⑤BM-EPCs与胶原海绵复合培养后的情况。
2 结果
2.1 BM-EPCs的形态学变化 经Percoll分离液分离后形成的白色云雾状层即为需要的细胞(图1);细胞瓶内培养48 h后,首次换液,于显微镜下观察EPCs的细胞形态(图2),细胞开始大量贴壁,细胞呈现圆形、梭形及多边形,没有明显的排列方向(图2a);3 d后,细胞体积增大,增殖迅速,细胞量增多,为长梭形,分布不均(图2b);第一次传代第1 d后,细胞形态较统一,可见“集落”形成(图2c);传至第2代,细胞形态变为较统一的短梭形,呈现为“铺路石”样的改变(图2d)。

图1 Percoll分离液分离的EPCs
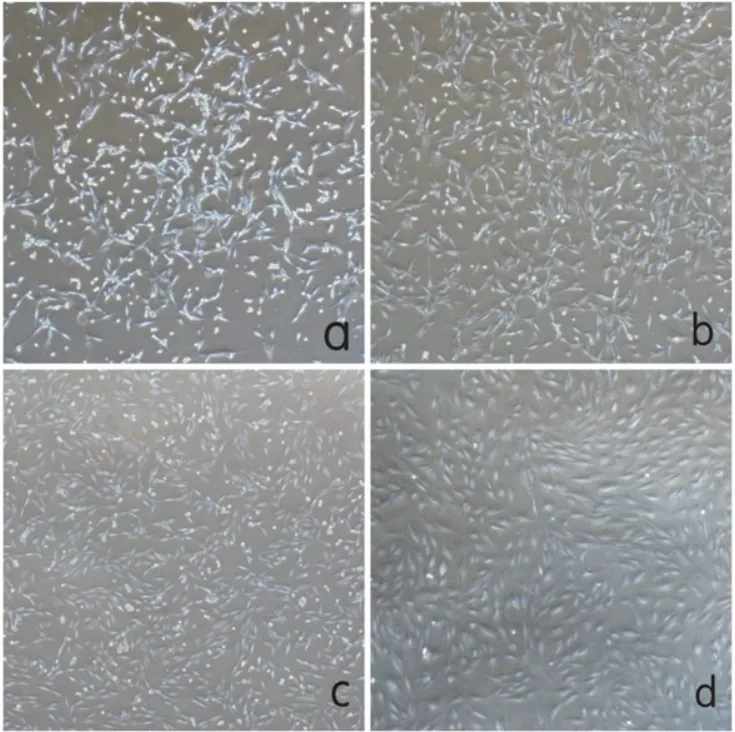
图2 EPCs的细胞形态(×40)
2.2 免疫细胞化学染色方法鉴定EPCs 将获得的EPCs,经ECM完全培养基培养后进行免疫细胞化学染色,结果显示,诱导后的细胞表达CD31、CD34(图3)。
2.3 CM-DIL骨髓源性内皮祖细胞的标记 于荧光显微镜下可观察到在绿色荧光激发下细胞膜及细胞质呈现红色荧光(图4)。
2.4 监测标记后细胞的活力及增殖能力并绘制生长曲线 标记后的细胞经0.4%台盼蓝染液染色,细胞存活率达90%,可进行后续实验。第2代EPCs的生长曲线基本呈现为“S”形,生长曲线表明EPCs具有较强的增殖能力。第1 d和第3 d可观察到细胞生长较缓慢,生长曲线基本呈现为平行线;第3 d至第5 d,细胞生长速度加快,为线性曲线生长状态,表明此阶段的细胞生长为对数生长期;第5 d开始细胞增殖明显减缓,说明细胞生长进入平台期(图5)。

图3 免疫细胞化学方法鉴定EPCs (×200)

图4 CM-DIL标记的EPCs的细胞膜及细胞质(×100)
2.5 骨髓源性内皮祖细胞与胶原海绵复合培养情况 EPCs与胶原海绵复合培养2周后,PBS冲洗3次,4%多聚甲醛常温下固定30 min,OCT胶包埋,冰冻切片,行HE染色可观察到胶原海绵的特殊多孔结构有利于EPCs的生长,部分EPCs沿裁剪的胶原海绵边缘生长,细胞形态不一致,大部分细胞形态为梭形及多边形结构(图6)。
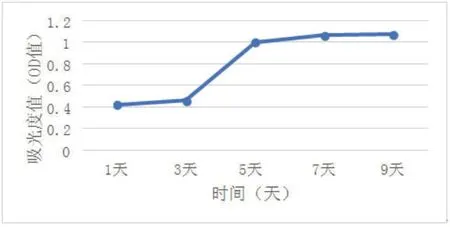
图5 CCK-8监测CM-DIL标记后EPCs的增殖能力
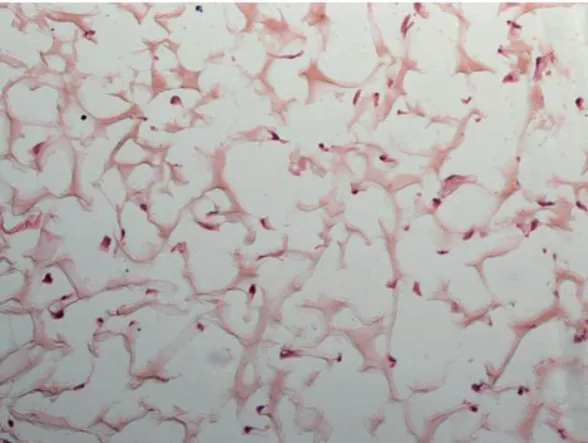
图6 EPCs-胶原海绵复合体冰冻切片 HE染色 (×100)
3 讨论
由于人口老龄化,与年龄相关性的疾病已成为医疗领域内的一个新的挑战,老年人血管功能的渐进性下降,加上长期暴露于危险因素的时间较长,为动脉粥样硬化及冠状动脉粥样硬化性心脏病发展创造了条件[9],因其高死亡率及高发病率而对人类健康构成严重的威胁[10],因此,针对受损的组织和器官的精准治疗变得尤为重要。组织工程技术的发展在再生医学领域中显示着相当大的潜力,其是基于在传统医疗方法上将细胞种植到具有生物可降解性的支架材料中,从而代替细胞外基质的作用,这种将细胞种植到支架材料上的方法已经被证明了可以移植到各种动物模型中用来恢复或增强原有组织的功能[11]。干细胞(Stem cells,SCs)是未完全分化的未成熟细胞,有自我更新和多向分化潜能的特点,因其具有广泛的临床应用前景,特别是一些难治性疾病的治疗上有潜在的应用价值,干细胞作为组织工程中的种子细胞,已经被广泛用于组织和器官的再生研究中[12]。根据细胞的发育潜力,干细胞可以分为三类:胚胎干细胞、诱导多能干细胞和成体干细胞[13]。胚胎干细胞(ESCs)来源于囊胚的内细胞团,可以提供早期胚胎的微环境[14],ESCs是一种多潜能干细胞,可以分化为体内任何类型的细胞,已经成为组织工程种子细胞的可靠来源[15]。然而,ESCs存在分化不完全,在移植后可能会有肿瘤疾病的发生以及涉及到伦理学问题[16,17],所以,在干细胞移植方面受到一定的限制。诱导多能干细胞(iPSCs)具有无限的自我更新和分化为特殊细胞的能力[18],具有与ESCs相似多能性的iPSCs的引入有助于避免伦理问题,因为iPSCs是通过多能转录因子重新编程成体细胞而得到的,但由于多潜能基因的引入,iPSCs也存在肿瘤形成的风险[19]。成体干细胞是一种非造血多能基质细胞,在生长过程中受到特定生长因子的调控,具有向脂肪细胞、骨细胞、软骨细胞和神经细胞等多种细胞分化的潜能[20]。神经干细胞[21]、造血干细胞[22]、骨髓间充质干细胞[23]、表皮干细胞[24]等都属于成体干细胞。其中最常用的为骨髓间充质干细胞,而BMSCs是间充质干细胞的一种,与ESCs和iPSCs相比,骨髓间充质干细胞(MSCs)发生肿瘤的风险极低,因此,在临床应用上较为安全[25]。
骨髓间充质干细胞具有分化为成骨细胞、脂肪细胞、成软骨细胞、肝细胞、心肌细胞、神经元和星形胶质细胞的潜能[26]。内皮细胞因具有促血管形成的特点,被广泛应用于组织工程与再生医学研究领域,但因在于体外获取的量极少,不足以满足临床或实验需求,研究者通过使用内皮细胞条件培养基将骨髓间充质干细胞诱导为内皮细胞,于体外进行大量增殖,为后续的实验研究提供足够的细胞数量。本研究采用的骨髓源性内皮祖细胞来源于兔的骨髓间充质干细胞,经过ECM培养基诱导后,于体外经过分离及增殖从而得到大量的内皮细胞,免疫细胞化学染色结果显示,经诱导培养基诱导后的细胞表达内皮细胞表面标记物CD31和CD34,证实了从兔骨髓获得的EPCs具有向血管内皮细胞分化的潜能。
在组织工程与再生医学研究领域,另一重要因素在于支架材料的选取,支架材料提供了三维的周围环境,为体内促进细胞的粘附、迁移和分化提供了机械支撑。这类支架材料必须满足以下最低标准才能够更好地足以应用:①生物相容性;②生物降解性;③机械强度,必须抵抗机械应力,以能够支持生长的组织;④基质性质,纤维和孔径可能会影响一些细胞的反应,包括迁移、增殖和分化[27]。本实验采用的胶原海绵,结构为软而多孔的海绵状膜片,经过剪裁、浸泡和DMEM培养基处理后,将内皮细胞接种到胶原海绵上,培养1周后,进行冰冻切片,结果显示细胞可在胶原海绵缝隙中或裁剪边缘处生长,而随着培养时间的延长,胶原海绵体积会逐渐缩小,结果证明胶原海绵具有良好的生物相容性,可支撑细胞的生长。因此,胶原海绵可作为支架材料而被广泛应用到组织工程与再生医学的研究中。
大量种子细胞的获取和支架材料的选择是组织工程学与再生医学研究中的热点,本研究充分证明了于体外经内皮细胞条件培养基可获得大量的内皮细胞,内皮细胞可以在胶原海绵上生长,为组织工程与再生医学的研究领域奠定了基础,并为其进一步在临床上的应用提供了可能性。

