间接法建立上海地区甲胎蛋白和癌胚抗原参考区间*
徐世骥,沈隽霏,吴文浩,王蓓丽,2,潘柏申,2,郭 玮,2△
(1.复旦大学附属中山医院检验科,上海 200032;2.复旦大学附属中山医院厦门医院检验科,福建厦门 361015)
生物参考区间是实验室检测的基石之一,能够协助临床医生对患者的健康状况做出诊断,不适当的参考区间反而可能对临床决策造成干扰[1]。美国临床与实验室标准化协会(CLSI)和国际临床化学联合会(IFCC)在2010年修订的相关指南提出通过建立排除标准,选取合适参考个体以获取参考区间的方法(直接法)仍然是金标准[2-3]。但是直接法所需的人员工作时间和检测成本使得临床实验室难以常规使用该方法。大部分临床实验室直接采用厂商所提供的参考区间,但这样往往无法解决由受试人群和检测系统带来的差异。因此,有学者提出通过应用实验室已储存的充足检测数据,以数学模型为基础建立参考区间,即间接法。本文通过间接法,利用门诊患者的检测数据建立了甲胎蛋白(AFP)和癌胚抗原(CEA)的生物参考区间,通过与直接法的行业标准比较,以期对间接法建立参考区间进行有效性和可靠性的验证。
1 资料与方法
1.1一般资料 选取复旦大学附属中山医院实验室信息系统中储存的2017年全年门诊患者的AFP和CEA检测数据,根据患者的就诊卡号、姓名和年龄等信息,筛除同一来源的数据仅保留最早时间的数据。
1.2仪器和试剂 使用罗氏公司的cobas 602全自动免疫分析仪和罗氏公司配套试剂及配套校准品。
1.3方法 采用复旦大学附属中山医院实验室先前已建立的间接法模式[4-7]建立AFP和CEA的参考区间。
1.3.1入组数据信息 2017年AFP和CEA室内质控年度累计变异系数(CV)结果见表1,所有结果均符合实验室质量目标。2017年门诊患者AFP和CEA的检测数据基础信息见表2。
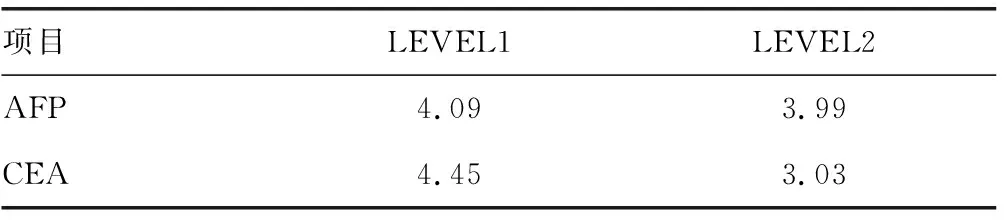
表1 2017年实验室AFP和CEA累计CV(%)

表2 2017年门诊患者AFP和CEA的检测数据基础信息
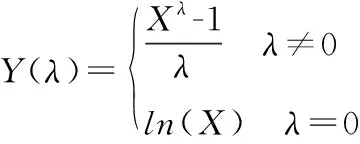
1.3.3离群值剔除 使用先前研究中被证明剔除效能更好的四分位间距(IQR)法,剔除P25-1.5倍IQR和P75+1.5倍 IQR之外的数值。其中AFP剔除2 269例,CEA剔除1 892例。见表4。

表3 AFP和CEA正态性检验和BOX-COX变换前后结果
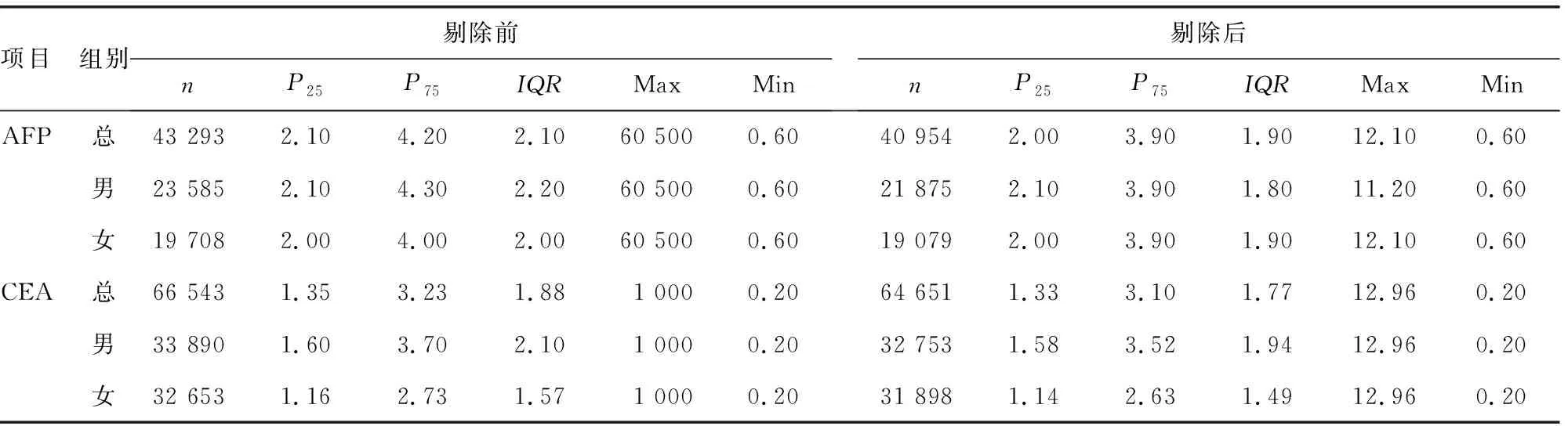
表4 IQR剔除离群值前后数据(ng/mL)
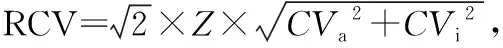
1.4统计学处理 使用Office Excel 2010办公软件录入各组数据,并进行排序,计算RCV和参考区间的差异百分比。使用Minitab 17统计软件进行数据的BOX-COX正态性变换(待定参数λ使用极大似然法得到)及Skewness-Kurtosis正态性检验,并完成IQR剔除离群值。
2 结 果
采用Hoffmann法获取生物参考区间,比较各项目参考区间上限值与直接法建立的参考区间的相对偏差,见表5。AFP的相对偏差小于RCV,则认为间接法建立的AFP参考区间上限值与直接法的行业标准参考区间上限值无显著差异。CEA的相对偏差大于RCV,间接法建立的CEA参考区间上限值与直接法的行业标准参考区间上限值存在一定差异。
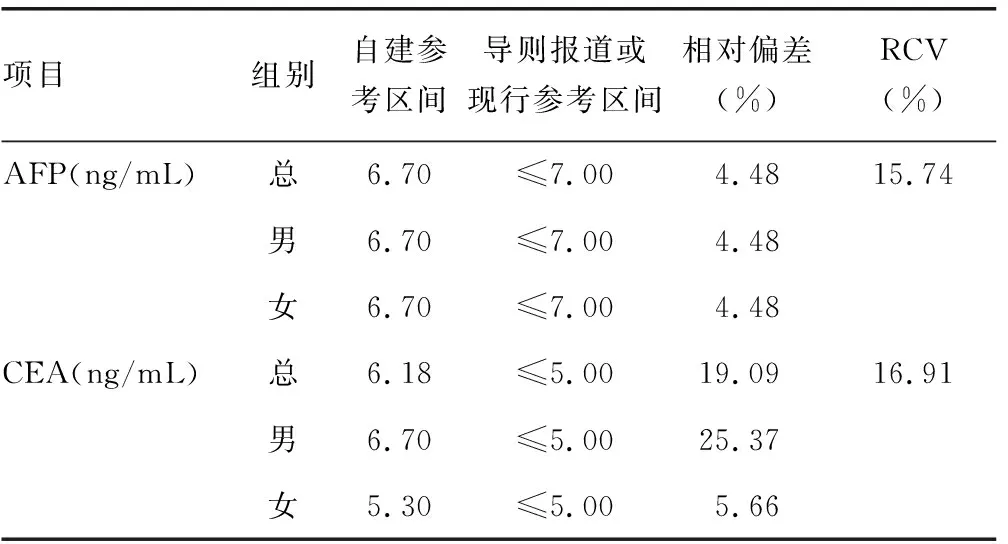
表5 IQR法剔除后Hoffmann法获取参考区间及偏差分析
选取20例健康人群,男女比例为1∶1,年龄为28~72岁。AFP检测结果最小值为0.60 ng/mL,最大值为4.50 ng/mL。CEA检测结果最小值为0.90 ng/mL,最大值为2.30 ng/mL。AFP和CEA在表面健康人群中符合自建参考区间,验证试验通过。
3 讨 论
临床检验项目的参考区间是临床诊断和治疗判断的重要依据。在临床检验中,不同的检测仪器、检测方法、受试人群等因素都会影响到最终的检测结果,从而导致一种参考区间可能并不适用于所有的实验室,因此,每个实验室最好可以建立一个真正适用于自己的参考区间。建立参考区间的最佳方法是直接法,是从一群充足且可靠的参考人群中抽取至少120例进行检测,另外对于非参数法还要对每种细分人群单独建立参考区间,如性别、年龄[3]。但是,对于大部分实验室而言,参考人群的选择和“健康”个体的定义是比较困难的,操作繁琐且耗资不菲。据CLSI调查团队的发现,现状是不仅少有实验室建立参考区间,甚至很少有厂商会进行建立参考区间的实验,而是倾向于应用数十年前既有的参考区间,但当时的检测方法和受试人群往往已经与现在不同[3]。
通过利用实验室储存的大量数据和数学统计为基础的参考区间建立方法,即间接法指出了另一条帮助实验室建立自己参考区间的道路。间接法建立参考区间方法简便、耗时短、成本低,且能有效地利用实验室所既有的大量检测数据。间接法建立参考区间利用存储在实验室数据库中的患者结果,提供了一种快速且廉价的替代方法。另外,因为可以使用大量患者数据,所以当需要多个分区时,该方法可以提供更详细的参考间隔信息,如不同的年龄组间[5-7]。
本文采用了复旦大学附属中山医院实验室在之前的研究中所总结出的较为简便和准确的统计模式[8-11]。该模式的核心步骤包括:(1)数据获取与筛选;(2)正态性验证及正态性变换;(3)离群值的剔除;(4)利用Hoffman方法获取参考区间;(5)参考区间的验证。
GROSSI等[12]认为在统计数据前,通过设定适当的筛选标准可以极大提高数据的可靠性, 如筛除过去3年中对同一项目进行过重复检测的患者数据、综合观察患者的相关性检验指标等。如从γ-谷氨酰转移酶(GGT)来看,已知GGT与结合胆红素、丙氨酸氨基转移酶和天门冬氨酸氨基转移酶存在一定相关性,则当这3个项目出现超出现有参考区间的异常值时,即不再选取相关的GGT数据,可以降低选中非健康个体的概率。然而,现有的研究并未提出筛选数据的具体标准,目前来说筛选数据的必要性仍不明确[2]。
AFP间接法得到的参考区间与行业标准相对偏差小于RCV,可以认为间接法与直接法得到的参考区间结果差异无统计学意义(P>0.05),证明间接法建立参考区间的可行性。
但CEA得到的参考区间的相对偏差大于RCV,与行业标准间存在一定差异。这可能是由于间接法作为一种后验方法,最大的缺点在于可能纳入处于疾病状态的患者的检测数据。本文中,由于选取的数据来源为门诊患者,包含大量非健康个体尤其是肿瘤患者,而对这类数据的筛选并不完善。尤其是CEA作为一种广谱的肿瘤标志物,可用于结肠癌、直肠癌、肺癌、乳腺癌、食道癌、胰腺癌、胃癌、转移性肝癌等常见肿瘤的辅助诊断[13-14]。由于CEA的非特异性,本文并未找到合理且完善的相关指标标准,用以筛查CEA数据,仅仅筛除了一年内进行多次检测的数据,后通过IQR剔除了离群值后,得到的CEA参考范围相对直接法的行业标准仍有一定差异。CEA参考范围表现出了男女之间的差异,这一点与其他报道相同[15-17]。
4 结 论
本文证明了间接法建立参考区间具有一定的可行性,可以为那些罕见人群及罕见标本的参考区间研究提供一种可靠的方法,同时也有利于实验室定期评审现有的参考区间,以提高临床工作中检验质量。但间接法仍然存在许多局限性,可能只能对参考区间作出粗略的估计,且过程中如何剔除数据中大量存在的错误值是重点同时也是操作的难点。完善间接法建立参考区间的方法步骤仍需进一步的研究。

