破膜剂对流式细胞术检测小肠中ILC3频率的影响*
曹 敏,张晓敏,王培昌,刘 静
(首都医科大学宣武医院检验科,北京 100053)
固有淋巴样细胞(ILCs)是最近发现的一种天然免疫细胞,ILCs是由造血干细胞(HSC)分化而来,HSC向ILCs分化的途径为:长期造血干细胞(LT-HSCs)→ 短期造血干细胞(ST-HSCs)→多能祖细胞(MPPs)→共同淋系祖细胞(CLP )→髓样淋巴祖细胞(CMP)→ILC前体细胞(ILCP)→各类ILCs[1]。ILCs主要分为3个亚群:ILC1亚群(ILC1s)、ILC2亚群(ILC2s)和ILC3亚群(ILC3s)[2]。目前研究认为,ILC1s存在于肠道和肝脏中,在病毒感染早期及肝脏损伤中发挥免疫作用[3-4];ILC2s主要存在与肠道、肺部和血液中,与哮喘、过敏性皮炎有关[5-6];ILC3s主要存在于淋巴结和肠道中,在炎症性肠病及清除胞内寄生菌感染中发挥免疫作用[7-8]。目前检测小肠组织中ILC3频率的方法主要依靠流式细胞术结合胞内染色,但是在染色过程中诸多因素会影响检测结果。由于小肠中ILC3含量较少且含有胞内抗原,需对其固定破膜后染色,固定破膜效果如何将成为影响小肠中ILC3检测水平的一项重要因素[9]。本研究中,课题组比较不同厂家的破膜试剂(BD公司破膜剂、eBioscience公司破膜剂、联科生物公司破膜剂)对小肠中ILC3检测效率的影响,目的在于提高小肠组织中ILC3检出频率,为后续实验奠定基础。
1 材料与方法
1.1材料
1.1.1动物实验小鼠 均为无特定病原体(SPF)级雌性小鼠(月龄3个月),体质量(20±5)g,购自北京华阜康生物科技股份有限公司。
1.1.2仪器 Gallios流式细胞仪(美国 Beckman公司),高速冷冻离心机(美国Thermo Scientific公司),1 mL注射器、1.5 mL、50 mL离心管(北京兰博利德商贸有限公司),200目尼龙纱网、流式细胞仪试管(美国BD公司)。
1.1.3试剂 eBioscience公司Transcription Factor Staining Buffer Set破膜剂(货号:00-5523-00),BD公司Cytofix/Cytoperm破膜剂(货号:554714),联科生物公司Fix&Perm Kit破膜剂(货号:70-GAS003)。抗小鼠Lin-405、抗小鼠CD45-FITC、抗小鼠CD127-PECy7、抗小鼠RORγt-APC购自eBioscience公司。3.5%水合氯醛、10×磷酸盐缓冲液(PBS)干粉、Hank′s平衡盐溶液(HBSS)、5 mmol/L乙二胺四乙酸(EDTA)、N-2-羟乙基哌嗪-N′-2-乙磺酸(HEPES)、胶原酶、Dnase I购自北京索莱宝科技有限公司,胎牛血清购自以色列Biological Industries公司。
1.2方法
1.2.1小肠组织单细胞悬液制备 取月龄3个月的实验小鼠,3.5%水合氯醛腹腔注射麻醉后断颈处死,剪开腹部皮肤,暴露腹腔脏器,用手术剪在胃与十二指肠连接处、回盲肠连接处剪断,分离全段小肠置于1%冷PBS中,剥除肠系膜并用1%冷PBS冲洗小肠,剪下小肠派尔集合淋巴结(PP结),将小肠置于5~10 mL solution Ⅰ(HBSS+5 mmol/L EDTA+10 mmol/L HEPES)中,37 ℃ 100 r/min摇床中消化15~20 min,重复4~5次,直至小肠组织呈无色透明状,弃上清液并收集小肠组织置于solution Ⅱ(HBSS+2%FBS+0.5 mg/mL胶原酶Ⅱ+0.5 mg/mL胶原酶Ⅲ+0.5 mg/mL DNase Ⅰ)中,再次消化,37 ℃ 100 r/min摇床中消化30 min,重复2~3次,将小肠组织消化液于200目尼龙纱网中过滤后,将上清液收集于50 mL离心管中[10]。
1.2.2细胞染色 将收集的小肠组织单细胞悬液根据使用的破膜剂分为3组:eBioscience组(EB组)、BD组、联科组(MS组)。每份标本中分别加入Lin-405、CD45-FITC、CD127-PECy7进行表面染色,冰上避光孵育1 h,3 000 r/min离心1 min,3组标本中分别加入不同公司的适量破膜剂,温度4 ℃,分10、20及60 min 3种不同处理时间,用配套的破膜洗液洗涤两遍后,在小肠组织单细胞悬液标本中分别加入RORγt-APC抗体冰上避光染色1 h,染色结束后分别加入适量配套的破膜洗液洗涤两遍,2 h内上机检测。
1.2.3样品检测与分析 开启Gallios流式细胞仪在前向角散射光(FSC)/侧向角散射光(SSC)散点图中显示细胞群,圈出淋巴细胞群,利用ISO管、单阳管调节电压、补偿等参数。在淋巴细胞群中,圈出Lin-CD45+CD127+RORγt+的ILC3[11],利用FlowJo (version 7.6)软件分析细胞群比例。
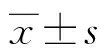
2 结 果
2.1小鼠小肠ILC3圈门策略 如图1所示,可见明显ILC3细胞群。相同破膜时间不同组别中小肠ILC3典型图如图2所示。将相同破膜时间不同破膜剂处理的ILC3检出频率进行比较,发现EB组[(19.66±0.33)%]和BD组[(20.73±0.49)%] Lin-CD45+CD127+RORγt+的ILC3检出率高于MS组[(10.79±0.25)%],差异有统计学意义(P<0.05),但BD组和EB组小肠组织中ILC3的检出频率差异无统计学意义(P>0.05),如图3所示。
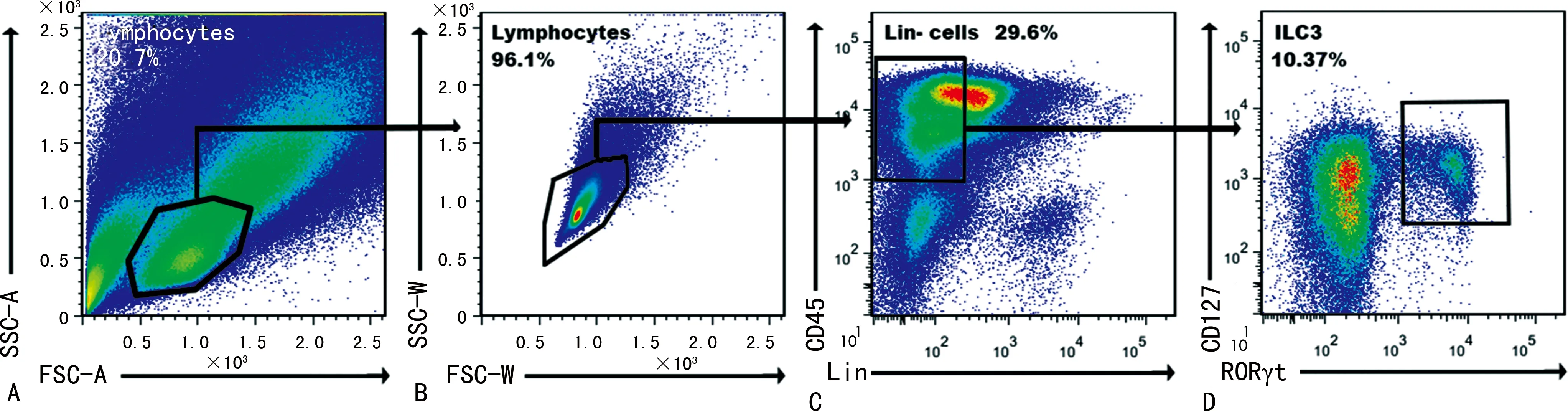
注:A为小肠中淋巴细胞群分布;B为淋巴细胞群;C为Lin-细胞群;D为CD127+RORγt+的ILC3。
2.2破膜时间对检测小肠中ILC3频率的影响 3种破膜剂分别对小肠ILC3处理不同时间,结果表明,对细胞处理10 min,破膜效果较差,然而破膜60 min,破膜过度,小肠ILC3检出频率低,细胞形态受破坏。当细胞处理20 min时,破膜效果最佳,小肠中ILC3检出频率最高。见表1。

注:A为MS组小肠ILC3频率;B为EB组小肠ILC3频率;C为BD组小肠ILC3频率。

注:与MS组比较,*P<0.05;“n.s.”表示差异无统计学意义(P>0.05)。
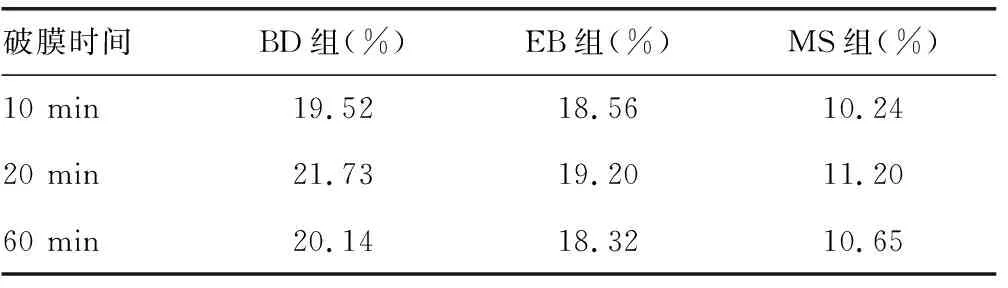
表1 破膜时间对3组破膜剂检测ILC3细胞频率的影响
2.3实验的可重复性 在相同实验条件下,同一份标本由不同操作者进行,结果差异无统计学意义(P>0.05),同一份标本由同一操作者重复2遍,CV值均小于5%。
3 讨 论
随着流式细胞技术的不断发展,流式细胞术广泛应用于各大实验室,特别是随着激光管的不断增加,荧光素的不断开发,多色流式细胞仪的应用能够更加快速准确灵敏地检测多个指标,例如在检测自然杀伤(NK)细胞和ILC1时,NK细胞与ILC1均属于第一类ILC细胞,且由于ILCs发现较晚,ILC1常与NK细胞相混淆,但由于多色流式细胞技术的发展,研究人员发现在CD3-NKp46+NK1.1+的基础上,CD49a+CD49b-的细胞是ILC1,而CD49a-CD49b+的细胞是NK细胞[12]。在原有基础上,增加两种荧光素,能够准确区分两种不同细胞,为后续实验奠定了基础。
利用流式细胞术检测细胞时,对于胞内抗原染色,细胞的固定与破膜是否恰当将严重影响染色效果,目前常用的破膜剂主要是BD Cytofix/Cytoperm试剂盒、Beckman Coulter试剂盒、eBioscience Fix & Perm试剂盒等,选择合适的破膜剂,能够更好地保持细胞的大小和完整性,增加细胞膜的通透性。本实验发现应用EB公司的破膜剂和BD公司破膜剂能够更好的检测出小肠中ILC3,在多次实验中发现,使用配套的破膜洗液洗涤细胞后,能够有效地减少非特异性结合,并提高染色效率。但延长破膜时间并没有提高破膜效率,反而由于破膜时间过长,细胞肿胀,可能会导致细胞死亡。对于低水平表达的抗原,在做配色时,应选择强荧光集团,并适当增加染色时间,以提高染色效率,同时当流式标本制作完成后,应尽快进行上机检测,减少细胞死亡,使实验结果更加准确。
本实验所研究的ILC3属于第三类ILCs,ILC3分为NKp46+的ILC3和NKp46-的淋巴样组织诱导细胞(LTi)[13],ILC3主要存在于肠道、皮肤黏膜中,受到TCF1、Notch和RUNX1等转录因子的调控[14]。ILC3主要存在于小肠固有层,产生IL-22和IL-17等细胞因子,对维持肠道免疫功能发挥重要作用[14]。在利用流式细胞仪检测小肠中ILC3时,由于RORγt属于胞内抗原,且抗原表达水平较低,本实验室选择了荧光素较强的APC做配色[15],同时选用合适的破膜剂,能够更好的检测小肠内ILC3。流式细胞术作为一项被广泛应用的实验技术,在开始正式实验前,应仔细考虑本实验的配色方案是否合理,并利用少量标本进行预实验,根据预实验结果,调整实验方法,最终获得理想的实验结果。
4 结 论
本研究通过比较不同公司破膜剂对检测小鼠小肠中ILC3频率的影响,发现EB公司破膜剂和BD公司破膜剂能提高流式细胞仪检测频率,同时验证了增加破膜时间并不能提高破膜效率。本研究比较了3种不同公司的破膜剂对检测小鼠小肠中ILC3的影响,为后续实验奠定了基础。

