不同TERT基因状态的肝细胞癌患者的临床特征及外泌体mRNA表达谱探索*
郭 琴,周 娟,李 晋,白 玲,宋佳佳,陆小军,应斌武△
(1.四川大学华西医院实验医学科,四川成都 610041;2.四川省资阳市第一人民医院检验科,四川资阳 641300)
端粒酶逆转录酶(TERT)是端粒酶的催化组分,其经典功能是以端粒酶RNA组分(TERC)为模板,合成端粒DNA,维持端粒稳定性,赋予细胞无限增殖的潜能。正常情况下,TERT被抑制,伴随着细胞复制周期,端粒逐渐缩短,即发生衰老[1-3];既往研究表明,肿瘤发生时,存在多种TERT再激活机制,如启动子突变、启动子甲基化、病毒整合、基因重排等[2]。在肝细胞癌(HCC)中,发生于TERT启动子区(TERTp)的突变和乙型肝炎病毒(HBV)DNA整合已经被反复检测到,两者均可诱导TERT的再激活,并增加TERT mRNA的表达。TERTp突变和HBV-TERTp整合被认为是HCC发展的驱动因素。然而两种基因改变方式对HCC致癌作用及临床特征的影响是否一致尚不明确。本文通过分析TERT基因状态与HCC患者临床特征、实验室检查及外泌体mRNA表达差异的关系,以期进一步了解不同TERT基因改变在HCC发生、发展中的作用。
1 资料与方法
1.1一般资料 随机纳入2019年6-12月于四川大学华西医院肝胆外科初次就诊且进行肝切除术的HCC患者36例,其中男31例,女5例,平均年龄(56.22±11.59)岁。采集患者术前外周血及手术肿瘤组织。纳入标准:初治原发性肝癌(简称肝癌),经病理证实为单纯HCC,且无其他部位肿瘤者。排除标准:合并自身免疫性疾病、免疫缺陷疾病者;已知异体器官移植史和异体造血干细胞移植史者;1个月内有输血史者;近期注射肝素等抗凝药物者;不能提供知情同意书或拒绝抽血者。本研究由四川大学华西医院临床试验和生物医学伦理委员会批准,所有研究对象均签署了知情同意书。
1.2肿瘤基因突变及HBV基因组测序 采用QIAamp DNA Mini Kit(德国凯杰)提取肿瘤新鲜组织DNA,采用QIAamp DNA Mini Blood Kit(德国凯杰)提取白细胞DNA,利用高通量测序技术,在Gene+2000平台(中国吉因加)上对肿瘤组织进行杂交捕获建库测序,纳入白细胞测序进行胚系变异过滤,同时对HBV基因组测序,分析肿瘤TERT基因突变及HBV基因整合情况。
1.3外泌体mRNA测序及差异分析 采用exoRNeasy Maxi Kit(德国凯杰)分离外泌体并提取RNA,使用NEB Next Ultra Ⅱ Directional RNA Library Prep Kit for MGI建库试剂盒建库,在Gene+2000测序仪上测序。采用edge R软件进行不同TERT状态组间差异分析,以差异的显著性(P-value)<0.05,差异倍数(Fold Change)>2作为差异显著性标准,使用DAVID在线网站对差异基因进行基因本体(GO)及京都基因与基因组百科全书(KEGG)富集分析。
1.4实验室指标测定 采用罗氏Cobas e601 电化学发光免疫分析仪及配套试剂检测甲胎蛋白(AFP)、癌胚抗原(CEA),采用富士G1200 全自动免疫分析仪及配套试剂检测维生素K缺乏或拮抗剂Ⅱ诱导的蛋白(PIVKA-Ⅱ),采用希森美康XN1000全自动血液分析仪及配套试剂计数血小板(PLT)、中性粒细胞、淋巴细胞,并计算中性粒细胞/淋巴细胞比值(NLR),采用希森美康CS5100凝血分析仪及配套试剂检测纤维蛋白原(Fib),采用罗氏Cobas8000 c702全自动生化分析仪及配套试剂检测乳酸脱氢酶(LDH)水平。
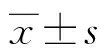
2 结 果
2.1TERT基因状态与临床特征及实验室指标的相关性分析 对36例肿瘤组织标本进行测序分析,根据TERT基因状态将36例患者分为HBV-TERTp整合组(9例)、TERTp突变组(13例)和无TERT基因整合及突变组(14例)。各组临床资料及实验室检查结果见表1。结果发现,在肿瘤最大径、有无微血管侵犯方面,HBV-TERTp整合组与另两组比较差异有统计学意义(P<0.05);年龄、性别构成、体质量指数、肝硬化背景,以及AFP、PIVKA-Ⅱ、CEA、NLR、PLT、Fib、LDH水平比较,HBV-TERTp整合组与无TERT基因整合及突变组差异无统计学意义(P>0.05),因此将HBV-TERTp整合组与无TERT基因整合及突变组合并为非TERTp突变组。分析发现:与非TERTp突变组比较,TERTp突变组平均年龄更大,AFP水平、AFP阳性率、NLR更低,差异均有统计学意义(P<0.05);而TERTp突变组肿瘤最大径更小,PIVKA-Ⅱ、PLT、Fib水平更低,但差异无统计学意义(P>0.05)。
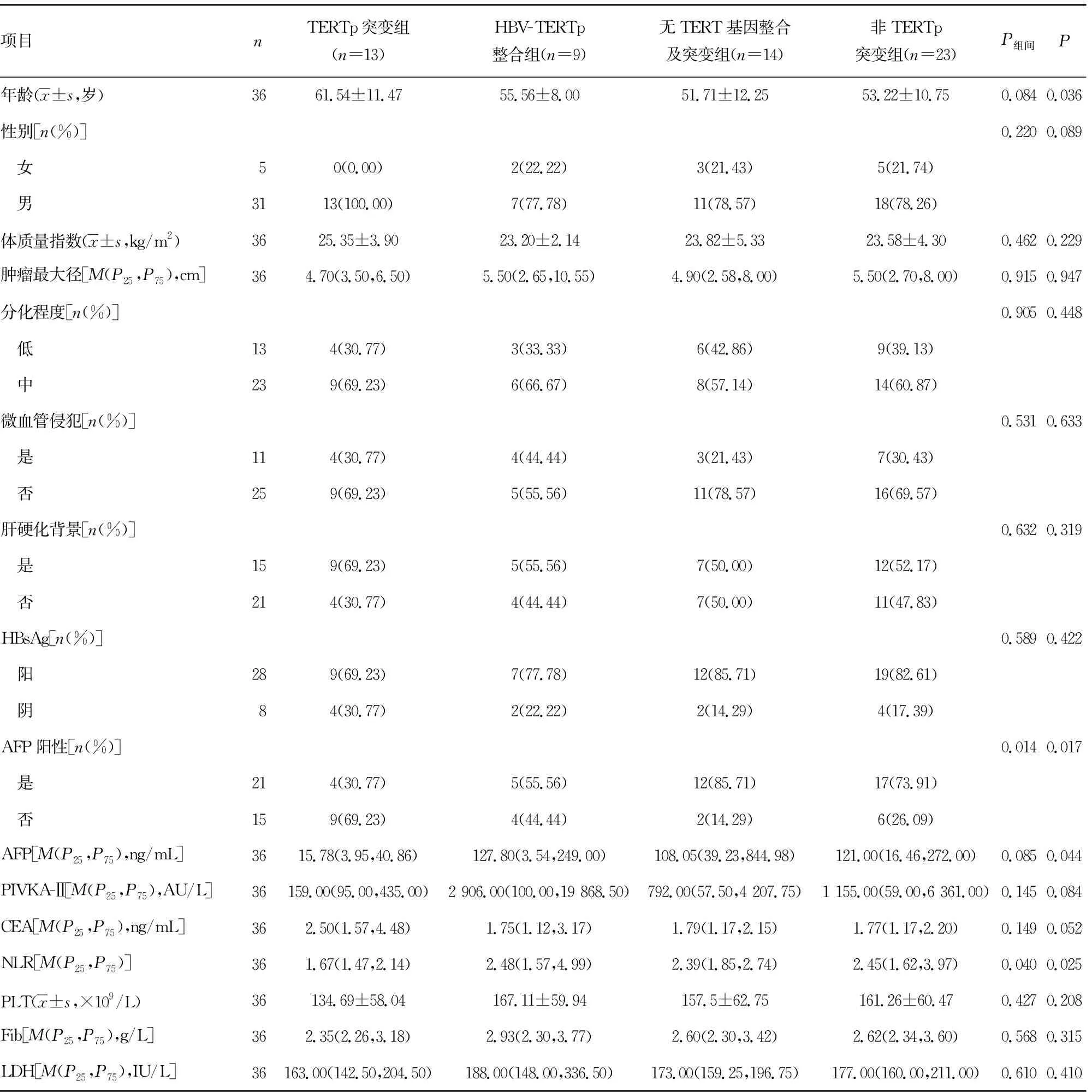
表1 不同TERT基因状态HCC患者的临床特征及实验室指标的比较
2.2外泌体mRNA差异分析 外泌体差异mRNA富集分析显示:HBV-TERTp整合组与无TERT基因整合及突变组间差异基因仅富集到核糖核蛋白复合体;HBV-TERTp整合组与TERTp突变组间差异基因仅富集到神经肽信号通路;TERTp突变组与无TERT基因整合及突变组间、TERTp突变组与非TERTp突变组间差异基因均明显富集到线粒体相关的生物过程(BP)、细胞组分(CC)及分子功能(MF),如氧化磷酸化、呼吸电子传输链、ATP代谢过程、线粒体ATP合成耦合电子转运等,且TERTp突变组与非TERTp突变组间差异基因富集结果P值更小;TERTp突变组与非TERTp突变组间差异基因的富集分析结果分别见图1、图2。
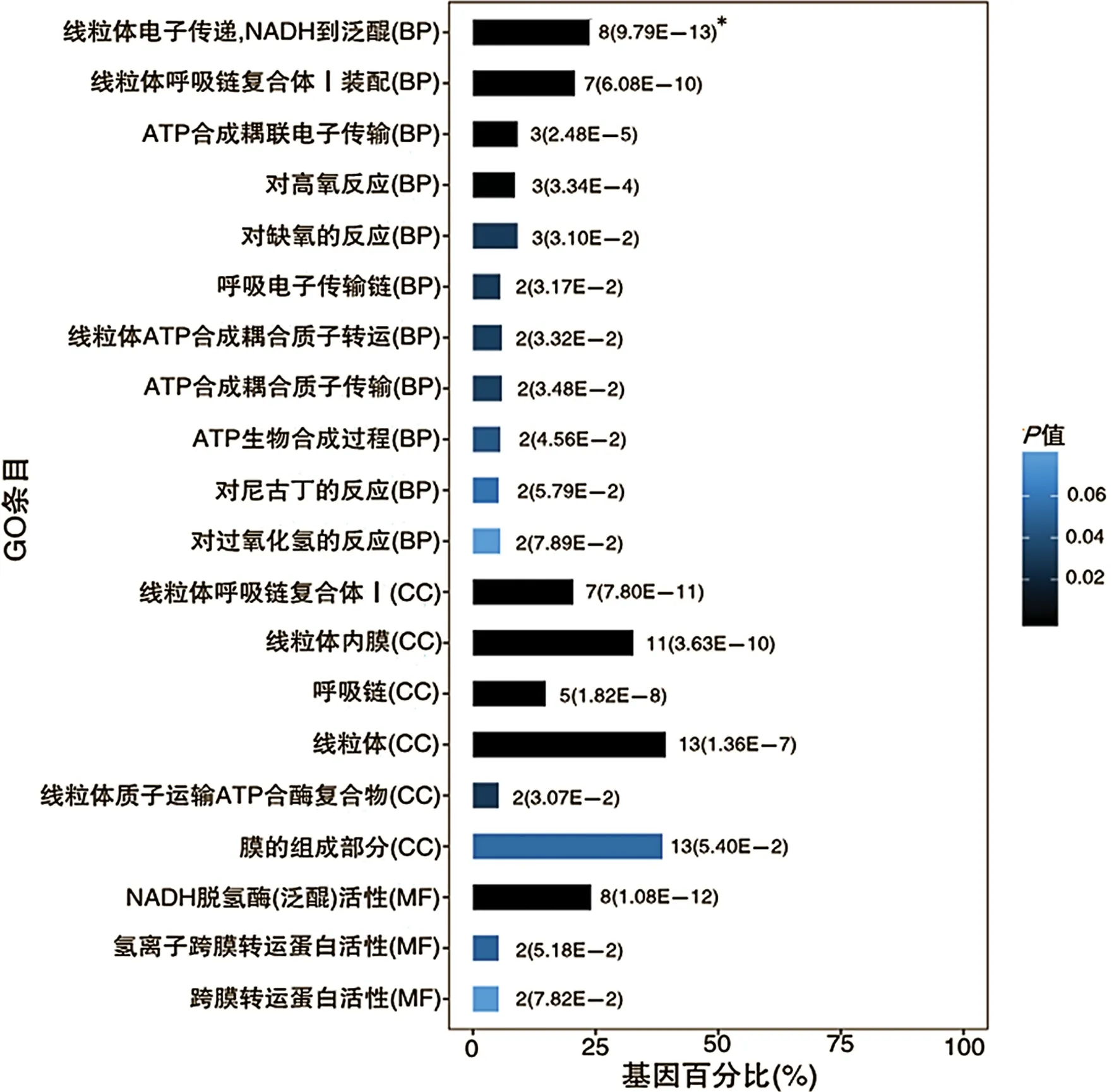
注:*为参与富集的差异基因数(P值)。

注:*为参与富集的差异基因数(P值)。
3 讨 论
在全球,HCC是常见恶性肿瘤,占癌症相关死因中的第四位[4]。HCC已知的危险因素包括慢性肝炎病毒感染、酗酒、非酒精性肝病、黄曲霉素等[1,5]。多数HCC患者确诊时已处于中晚期,治疗选择有限,使得HCC的病死率与发病率之比高达0.95[6]。对HCC发病机制的分子研究有助于早期诊断或探索更多的治疗方式。
本研究纳入36例初治并行肝切除术的HCC患者,通过对肿瘤组织进行肿瘤相关基因及HBV基因组的测序分析,鉴定出HBV-TERTp整合9例,TERTp突变13例,无TERT基因整合及突变14例。TERTp突变与HBV-TERTp整合具有排他性,且发生突变的患者年龄更大,这与其他报道一致[2,7-9]。
本研究发现,HBV-TERTp整合组与无TERT基因整合及突变组间的临床特征及实验室结果更为相似,而TERTp突变组与前述两组多个指标比较差异有统计学意义(P<0.05),因此,将HBV-TERTp整合组与无TERT基因整合及突变组合并为非TERTp突变组进行分析,结果发现TERTp突变组患者AFP水平、AFP阳性率、NLR更低(P<0.05),肿瘤最大径、PIVKA-Ⅱ、PLT、Fib水平也表现出更低的趋势。
以AFP大于20 ng/mL为阳性判断标准[10],AFP阳性率在不同TERT基因状态HCC患者中存在显著差异,TERTp突变组AFP阳性率仅为30.8%,明显低于非TERTp突变组(73.91%),这表明AFP作为启动子突变HCC患者的肿瘤筛查指标时,更容易漏检。AFP不仅是肿瘤诊断标志物,亦被认为在肝癌发展过程中对血管生成和细胞侵袭起调节作用,AFP可以通过Fas/FasL,Caspase-3和PI3K/AKT信号通路促进肝癌细胞的增殖并调节肝癌细胞的凋亡,沉默AFP基因可导致血管内皮生长因子(VEGF)、金属蛋白酶的表达量显著下调[11-12],AFP水平与不良预后相关[10]。PIVKA-Ⅱ又叫异常凝血酶原(DCP),其结构中包含两个环形结构域,该结构域与肝细胞生长因子相似,可通过激活DCP-Met-JAK1-STAT3信号通路刺激HCC生长[13-14],PIVKA-Ⅱ还可诱导表皮生长因子受体(EGFR)和VEGF在人脐静脉内皮细胞(HUVEC)中的过表达,提高肝癌组织周围的成血管作用[15-16]。中性粒细胞能够参与肿瘤微环境的调节,增强肿瘤细胞的侵袭转移、血管生成及细胞外基质重塑;PLT可以为中性粒细胞的募集提供趋化信号,并为肿瘤的扩散提供黏着位点,保护肿瘤细胞免受免疫攻击[17],术前外周血PLT计数与HCC患者预后呈负相关[18];Fib可以转化为纤维蛋白,与PLT、肿瘤细胞一起形成微血栓,并覆盖在肿瘤细胞外,以对抗宿主免疫监视[19]。TERTp突变组与非TERTp突变组间的临床及实验室结果差异,预示TERTp突变HCC侵袭性更弱,也提示不同TERT状态HCC的致癌机制可能存在差异。
为进一步探究不同TERT基因改变在HCC发生、发展过程中的潜在作用差异,本课题组对患者外周血外泌体内的mRNA进行了测序分析。外泌体是最大径为30~100 nm的由胞吐作用释放到细胞外的脂质双层囊泡,含有其起源细胞的各种分子,包括蛋白质和核酸等,可反映其来源细胞的分子特征,也可作为细胞间信息交流的载体[20],外泌体已被证实广泛参与免疫抗原呈递、肿瘤的生长与迁移、组织损伤的修复等过程[21]。本研究外泌体mRNA表达谱发现,TERTp突变组与非TERTp突变组间的差异基因主要富集到线粒体氧化磷酸化等生物过程,参与富集的基因在TERTp突变组上调,提示TERTp突变组HCC患者线粒体相关代谢活动增加。文献报道,TERT也存在于线粒体内,TERT能增加肿瘤细胞的适应能力,提高线粒体活性,并对抗凋亡[3],线粒体TERT可以通过结合线粒体DNA发挥保护功能,从而增加呼吸链活动并防止氧化应激引起的损害[22]。TERT还可以通过增加还原型谷胱甘肽与氧化型谷胱甘肽的比例,将氧化的过氧化物酶还原成其非氧化形式,增强细胞抗氧化防御系统,减轻细胞水平,并赋予癌细胞逃避死亡刺激的能力[23]。因此,推测TERTp突变驱动肝癌发生可能是通过增强线粒体代谢等方式获能以促进肿瘤增殖,抗氧化治疗可能是TERTp突变肝癌患者有效的治疗途径,但具体机制尚不清楚,还需进一步研究。
4 结 论
TERTp突变与非TERTp突变患者的临床特征存在显著差异,TERTp突变患者年龄更大,且具有更温和的实验室特征;TERTp突变患者AFP阳性率低,采用AFP作为肿瘤筛检指标,可能会造成漏检;TERTp突变可能通过增强线粒体代谢等方式获能以促进肿瘤增殖,抗氧化治疗可能是TERTp突变肝癌患者有效的治疗途径。

