“道法自然”的人工光合作用
林军奇,阮志军,陈砚美,刘闪闪,甘喜武,付 军,田正芳
(1. 黄冈师范学院 化学化工学院,湖北 黄冈 438000;2. 黄冈市教育局,湖北 黄冈 438000; 3. 湖北省黄冈中学,湖北 黄冈 438000)
随着人类社会的快速发展,对化石燃料的依赖度不断增加,化石燃料的过度使用带来的空气污染和温室效应等问题引人注目,人类致力于开发新能源替代传统化石燃料。为了满足可持续发展要求,新能源应该是可再生且环境友好的。氢能属于无污染的可再生能源,有望替代传统化石燃料。太阳光能是地球生物所需能量的最终来源,能满足地球上所有生命体对能量的需求,是因为地球上的绿色植物和藻类通过光合作用将H2O和CO2转化为碳水化合物和O2,实现了太阳能到化学能的转换和储存。《道德经》有云:“人法地、地法天、天法道、道法自然”。自然光合作用经历了千百万年的“优选”,其功能十分优越,如果能模拟自然光合作用,利用太阳能将地球上最为丰富的资源H2O分解为H2和O2[1],或者是将H2O氧化至氧气的同时将CO2还原为含低价碳的化合物,如CO,CH4,HCOOH等,都是理想的太阳能向化学能转换方式[2]。前者是最佳的产氢能途径,后者不仅能降低大气中CO2浓度,还可以获得具有经济价值的化学品。
水氧化和二氧化碳还原难以自发进行,常需要选择催化剂,在高中化学教学过程中向学生演示人工光合作用相关反应,如高效的水氧化。既可以让学生明白催化剂对化学反应的重要性,还可以从本质上帮助学生理解催化剂在催化一些高活化能的反应,如水氧化时起的具体作用。最重要的是,从目前最前沿的科研课题人工光合作用中发掘高中化学教育情景素材,能激发学生对化学学习的热情,让他们明白化学可以通过创造物质来解决人类社会发展面临的诸多问题,例如环境与能源问题等,还可以从科学精神和社会责任角度理解化学的价值所在,从而落实对学生化学核心素养的培养。
1 自然和人工光合作用
自然光合作用分为两个阶段:光反应和暗反应。光合作用发生时,光系统I发生水氧化过程,其中蛋白质包裹的Mn4CaO5簇起催化作用,完成两分子的H2O氧化,生成一分子的O2和四个H+,同时生成还原氢[H](以NADPH的形式存在)的生成,暗反应过程涉及到CO2的转化,光系统产生的[H]进一步参与二氧化碳的还原[3]。
自然界中的光合作用包括两个主要反应(反应式1~2),而这两个主要反应的本质则分别是水的氧化和二氧化碳还原两个步骤(反应式3~4),也是科学家在模拟人工光合作用过程中的主要研究对象[4]。

(1)

(2)

(3)

(4)
1.1 水氧化过程
水分解过程分为水氧化(反应式3)和质子还原两个半反应,然而相比于质子还原过程,水氧化生成氧气的过程更具有挑战性,从热力学角度来看,水氧化是一个能量爬坡的反应,且反应需要较高的活化能才能进行,从动力学角度来看,是一个速率非常缓慢的过程,因此也被认为是水分解的瓶颈。化学反应速率和反应活化能相关,催化剂可以通过降低反应活化能,因此开发高效水氧化催化剂能大幅度提升水氧化速率,促进水分解过程。自然界光合作用的光反应体系完成了水氧化过程,产生的氧气满足了地球上所有需氧生命体的需求。科学家们通过数十年的探索,发现叶绿体中负责水氧化产氧的活性中心是由蛋白质包裹的Mn4CaO5簇,直到近几年才通过X-射线衍射确定了钙锰氧簇的晶体结构(图1)[5]。研究表明,该活性中心的催化转化频率(每秒催化产生氧气的摩尔数/催化活性中心的摩尔数)高达100~400 s-1,这意味着它在极大程度上降低了水氧化过程的活化能,为了追求与能用于人工光合作用的,且催化效率能与自然界Mn4CaO5能媲美的水氧化催化剂,包括中国科学家在内的全世界化学工作者不断尝试对其结构进行模拟[6]。
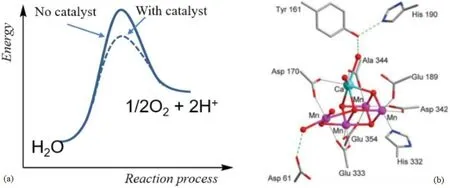
图1 水氧化过程中,催化剂对反应历程的影响(a)以及自然界光催化放氧中心Mn4CaO5簇的结构示意图(b)
模拟具有自然界产氧催化中心Mn4CaO5簇功能首先需要模拟其结构,Mn4CaO5团簇的中心结构包含两个三价的Mn原子,两个四价的Mn原子,一个Ca原子,以及四个三桥联的O原子和一个桥联O原子。混合金属,混合价态的元素组成以及其中特异的Mn3CaO4立方烷结构使得对Mn4CaO5簇结构的模拟异常困难。无机合成化学家尝试通过控制反应条件,筛选不同的合成原料,以期得到元素组成,元素价态,键长比例均类似于Mn4CaO5簇的化合物。尽管已经有一些含有混合价态Mn原子的多核配合物被发现,但并没有得到结构与Mn4CaO5簇较为接近的分子[7]。2015年,中科院理化技术研究所张纯喜研究员课题组在科学杂志上报道了配合物[Mn4CaO4(ButCO2)8(ButCO2H)2(py)](图2,But,叔丁基;py,吡啶)。其合成过程历时十余年。配合物的金属氧中心结构与Mn4CaO5簇极为相似,而且配体官能团结构也与Mn4CaO5簇配位的蛋白质组官能团几乎一致。更为重要的是,[Mn4CaO4(ButCO2)8(ButCO2H)2(py)]能够连续发生四次单电子参与的氧化还原过程,与自然界Mn4CaO5簇在光合作用过程中发生的化学变化完全一致。该工作属于首次对Mn4CaO5簇结构和功能的完全模拟,对于仿生合成学有重大意义[8]。
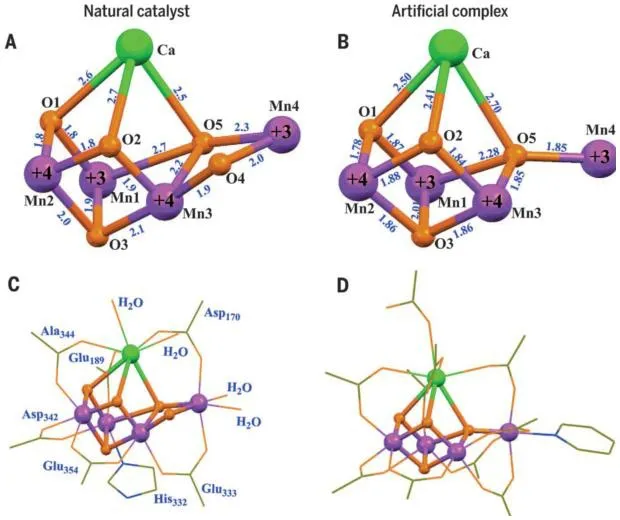
图2 自然界产氧活性中心Mn4CaO5簇的核心结构(A)以及具有仿生结构的[Mn4CaO4(ButCO2)8(ButCO2H)2(py)]配合物的核心结构(B)
尽管Mn4CaO5簇的催化效率非常高,但因为对Mn4CaO5簇的直接模拟十分困难,更多的目光开始聚焦到对其结构的部分仿生。考虑到Mn4CaO5簇中含有一个Mn3CaO4立方烷结构,一些含有类似立方烷结构的化合物被用于水氧化研究[9-11]。另一方面,Mn4CaO5簇中的金属原子通过双桥联和三桥联的氧原子连接,许多含有桥氧、桥羟基或者桥过过氧键结构的双核金属配合物分子被用于仿生水氧化催化,这些配合物的核心结构与Mn4CaO5簇的部分结构类似[12]。
在高中化学关于电解水的章节中,可以尝试将电解实验如电解水与水氧化催化剂概念结合。例如含有钴离子的氧化物或磷酸盐材料表面具有由四个钴离子和四个氧离子组成的Co4O4立方烷结构,这类氧化物就是最简单且与Mn4CaO5结构类似的仿生水氧化催化剂,实验以参照比较的形式出现,在电解水实验时,以干电池作为外部电源,以商品化导电玻璃作为电极,当催化剂不存在时,在导电玻璃电极表面几乎观察不到气泡产生,但如果在溶液中加入磷酸氢钠和醋酸钴,学生可以清晰看到电极表面有固体沉积,同时电极表面有水氧化的气泡产生。该实验不仅可以向学生展示电解水实验,还直观地展现催化剂对于加速化学反应的作用,尤其是在水氧化反应上的神奇效果,拓展延伸知识还涉及到简单的晶体结构,借此向学生展示钴氧化物中金属离子的配位情况,以及其中独特的Co4O4立方烷仿生结构(图3)。
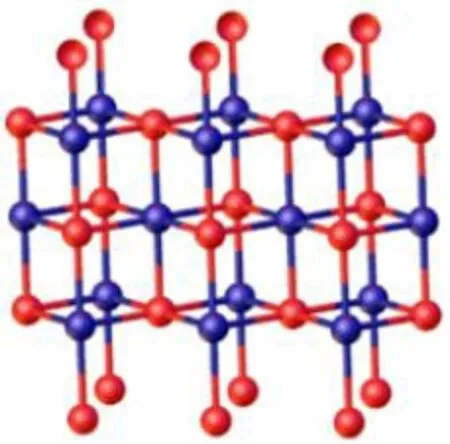
图3 具有类似Mn4CaO5簇结构的钴氧化物的表面原子排布
在诸多水氧化催化剂中,西湖大学孙立成教授课题组报道了的单核结构的Ru配合物[Ru(bda)(isoq)2](图4)非常具有代表性,配合物分子会原位形成二聚体起催化作用,二聚体中含有Ru-O-O-Ru结构,与Mn4CaO5簇的核心结构有相似之处。值的注意的是,如果以Ce4+作为氧化剂,[Ru(bda)(isoq)2]催化水氧化的转化频率高达303 s-1,是第一例催化活性可以媲美自然光合作用的水氧化催化剂[6]。
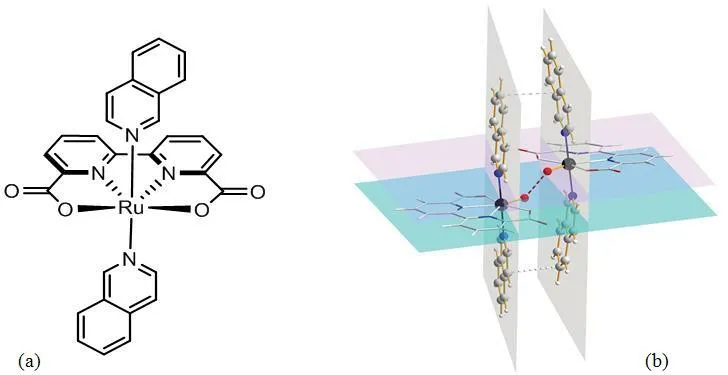
图4 配合物[Ru(bda)(isoq)2]的分子结构(a)及其二聚体形式(b)Fig. 4 The structure of [Ru(bda)(isoq)2] (a) and the dimer of this complex (b)
在高中化学教学过程中,该系列催化剂可以辅助讲解催化剂功能,这些催化剂可以经过简单的一锅法合成得到,且配体和金属盐原料均已经实现商品化,轴向配体也可以调变,其中活性最好的配合物的催化转化频率高达十余万,学生可以在课堂上观察到高效的催化过程。室温条件下,在纯水溶液中加入一定浓度的催化剂,以商品化的硝酸铈铵为氧化剂,可以直接看到直径达到数毫米的氧气气泡产生,学生甚至可以直接通过排水法测定该反应的气体产量,测定反应速率。在自然界中,是不可能存在如此高效的水被氧化到氧气的过程。学生观察到“神奇夸张”的水氧化过程,能直观地感受到催化剂加速反应的作用。
1.2 二氧化碳还原过程
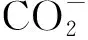
光催化CO2还原体系的基本过程是在太阳光照射以及电子牺牲试剂和光敏剂的辅助下,催化剂的活性金属中心会被还原为低价态中间体,低价态中间体将CO2还原为低价碳化合物,以太阳光能实现CO2向低价碳化合物的转化,尽管一些含贵金属的催化剂都具有较好的光催化CO2还原活性,但基于大规模应用的成本因素考虑,更多含有非贵金属如Fe、Co、Ni、Mn、Cu等的催化剂引起了研究者的广泛关注。上述过渡金属价格较为低廉、地球储量丰富且价态多样化,在光催化CO2还原研究中受到了青睐。
对于CO2还原产物而言,CO和CH4都可以用作化工原料,CH3OH,HCOOH都可以用于燃料电池。如果还原过程选择性太低,还原产物的可利用性将会大大降低。关于CO2还原的研究在上世纪九十年代就有报道[14],但催化效率和产物选择性并不高。由于CO2还原产物种类的多样性和还原产物的还原电位相近,还原产物的选择性难以控制。以碳氧化合物(CO)和碳氢化合物(CH4)为例,在热力学角度上,生成CO的还原电势为-0.52 V vs NHE,比生成CH4所需的还原电势-0.24 V vs NHE还要负,这意味着CH4的生成在热力学上优先于CO的生成;而从动力学过程来看,CO2还原成CO是一个2电子还原反应,而生成甲烷则是一个8电子还原反应,生成CO比生成CH4应该更容易,二者相互矛盾。因此,提升CO2还原产物的选择性一直是难点之一[15]。
中国科学家开展的关于二氧化碳还原的工作起步较晚,但近些年来在相关研究领域也取得了较为卓越的成就。中国科学技术大学谢毅院士长期从事二维纳米材料在CO2还原领域的应用研究,该课题组利用部分氧化的Co层来催化CO2电还原,制备Co3O4与Co共存的4原子厚的薄层,并证实这原子级薄层表面的Co原子相比于块状样品中的Co原子活性和甲酸盐合成的选择性更高,而部分氧化的原子层会进一步提高它们的固有活性。同时完成了材料对CO2还原反应的惰性过程向活性过程转变,从原子结构上实现了CO2至液体燃料的高选择性还原过程[16]。
该课题组长期从事双金属位点型超薄纳米片的设计合成,以期实现精准调控CO2还原产物的选择性。以制备的缺陷态CuIn5S8超薄纳米片为例,理论计算和实验结果均证实材料中的低配位的Cu和In位点能够与二氧化碳分子作用生成高稳定的Cu-C-O-In中间体,而该中间体在同时断裂Cu-C键和C-O键形成自由态的CO分子时则需要克服很高的反应活化能;相比较而言,在该中间体的C原子上加氢形成CHO中间体的反应则是放热反应、能够自发进行,从而使其更倾向于获得接近100%的甲烷选择性。光催化测试结果证实,含硫缺陷的CuIn5S8超薄纳米片在可见光驱动下将CO2还原为CH4的选择性达到近100%,该工作构建了双金属位点CuIn5S8超薄纳米片,改变了关键反应中间体的构型,调节了反应势垒,进而改变了反应路径,最终使得还原产物由CO变为CH4(图5),这为设计高选择性和高活性的二氧化碳光还原催化剂体系提供了新的思路[16]。
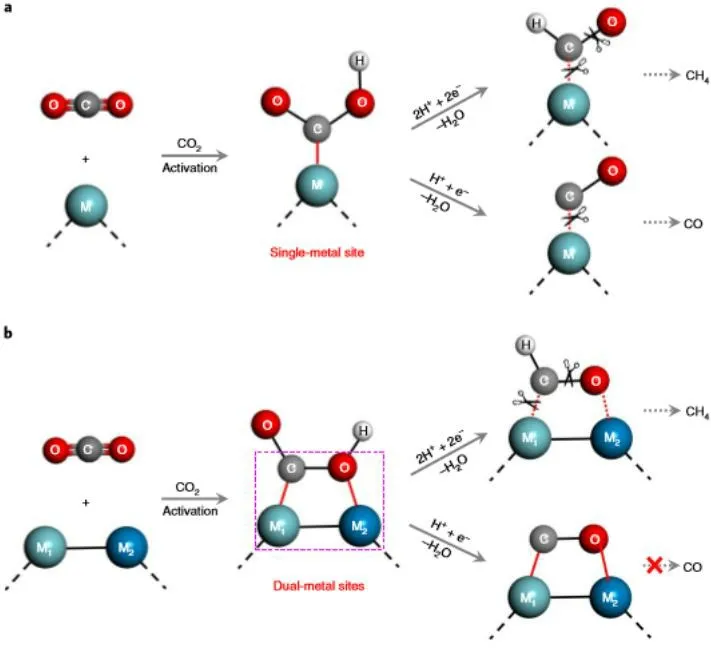
图5 含金属材料催化二氧化碳还原为气体产物的单金属位点催化(a)和双金属位点催化过程(b)Fig. 5 The catalytic process of single metal site (a) and double metal site (b) during the reduction of CO2 to gas production catalyzed by metal containing materials
遗憾的是,尽管二氧化碳还原反应现阶段研究已经将还原选择性控制得非常好,但是还原速率仍难使人满意。实验室研究二氧化碳还原反应使用的检测产物手段依旧只能通过气相色谱或者是离子色谱,常规化学方法还是难以实现检测,目前难以在高中化学课堂上向学生展示二氧化碳还原过程,从本质来讲,还是现阶段二氧化碳还原催化剂活性不够高导致的,相关的探索还有待更深入的进行。
2 展望与结语
尽管光合作用在自然界中广泛存在,但是要实现真正意义上的人工模拟仍然困难重重。一方面虽然实现了CO2还原的高选择性,但人工还原CO2速率与绿色植物的光合还原速率差距还是很大。另一方面,虽然光催化水氧化和CO2还原在实验室都可以独立完成,但是想要在同一个体系中将二者结合起来,形成一个高效的闭合循环,依旧是更大的挑战。人工光合作用好比一所大门,水氧化和CO2还原各自是其中一扇。道法自然,人类想要学习绿色植物,通过太阳能获得氧气和化学能,完全打开人工光合作用这所大门,从能源和环境保护角度实现可持续发展,必须同时打开门的两扇,相关科学研究还有很长的路要走。
本文介绍了人工光合作用的基本原理以及一些中国科学家在相关领域的突出研究成果。人工光合作用试验可以用来培养学生的化学核心素养。在实际教学中,可以利用水氧化实验演示催化剂对于加速水氧化过程的神奇之处,巩固学生对于活化能、反应速率、催化剂等概念的理解,还可以开拓对新兴学科如仿生学的视野。将水氧化催化剂的高活性与二氧化碳还原催化剂的低活性进行比较,既可以让学生了解人工光合作用的困境所在,树立合理使用能源和保护环境的理念,还可以激发他们探索自然科学的兴趣和实现科学突破的志向。从科学精神和社会责任角度培养学生的核心素养,让学生关注与化学有关的社会热点问题,认识环境保护和资源合理开发的重要性,具有可持续发展意识和绿色化学观念。深刻理解化学、技术、社会和环境之间的相互关系,认同化学对社会发展的重大贡献,能运用已有知识和方法综合分析化学过程对自然可能带来的各种影响。

