抗性淀粉体外分析方法的优劣势比较及研究进展
任娜梅 马 蓁 胡新中
(陕西师范大学食品工程与营养科学学院,西安 710119)
根据消化的速度和程度,可将淀粉分为快速消化淀粉(RDS)、慢速消化淀粉(SDS)和抗性淀粉(RS)。RDS是在摄入后能立即引起血糖升高的淀粉组分;相较于RDS,SDS是在小肠中以较慢速率完全消化的淀粉组分[1],RS是指不能被健康人体小肠所消化吸收的淀粉及其降解产物[2,3]。抗性淀粉根据其来源或制备方式的不同被分为五类:物理包埋淀粉(RS1)、非糊化的天然淀粉颗粒(RS2)、老化抗性淀粉(RS3)、化学改性淀粉(RS4)和直链淀粉-脂质复合物(RS5)[4-9]。体外最先定义的抗性淀粉组分是RS3[10]。抗性淀粉能降低餐后血糖、胰岛素响应、血浆胆固醇和甘油三酸酯浓度[11,12],并在结肠中发酵生成H2、CO2、CH4等气体(主要为CO2)以及乙酸、丙酸和丁酸等短链脂肪酸而降低结肠的pH[1,9,13]。此外,抗性淀粉在一定程度上能预防结肠癌、糖尿病和肥胖症等疾病[5,8,14]。食物中的抗性淀粉含量受各种内因和外因的影响,内因主要有:1)一些营养成分,如水分能改变食物相态转移动力学以及淀粉老化的进程[15];蛋白质一方面对淀粉有包埋作用,使淀粉酶难以接触到淀粉颗粒而提高RS1的含量,另一方面,蛋白质可与直链淀粉形成分子间氢键,通过抑制直链淀粉的老化来降低RS3的含量,一般后者的影响更大[16];脂质能与直链淀粉形成螯合物(RS5),通过抑制淀粉颗粒的膨胀或竞争性抑制直链淀粉分子间的相互作用而影响抗性淀粉含量[13,14];可溶性糖可与淀粉分子竞争与水的结合而起到抑制淀粉糊化和老化速率的作用[15,16];一些其他成分,如盐是淀粉老化的促进剂或抑制剂,可通过改变淀粉颗粒的水化性和溶解性来影响抗性淀粉的形成[17,18];2)直链淀粉/支链淀粉比率,通常该比率越高越有利于抗性淀粉的形成[19];3)淀粉颗粒的粒径和聚合度等,通常粒径越大、聚合度越高越有利于淀粉颗粒抵抗淀粉酶的侵蚀。影响抗性淀粉含量的外因主要包括不同制备方式、加工条件及添加剂等因素[20,21]。
抗性淀粉测定方法分为体内和体外两种。体内法主要是通过测定体内未被小肠消化吸收的淀粉组分及其降解物含量,主要包括回肠造口术模型;插管技术;氢呼吸实验[2,12,22]。体外测定法是在体外模拟体内的消化环境测定不能被淀粉酶水解的淀粉组分[23-25],所使用的酶试剂包括普鲁兰酶、α-淀粉酶、热稳定α-淀粉酶、胰α-淀粉酶、胰酶、转化酶及淀粉葡萄糖苷酶。不同酶及不同用量组合的使用均会影响抗性淀粉含量测定的最终结果[8,16]。测定抗性淀粉含量的方法层出不穷,大都在初始方法上不断补充、调整,使测定结果更加真实化、合理化。这些调整包括酶浓度的变化、所用酶的类型、培养的pH、是否加入乙醇以及食物是否经过咀嚼预处理等,均直接对测定的抗性淀粉水平产生影响[26,27]。但目前报道的原理基本均为先加入消化酶消化非抗性部分的淀粉,然后用KOH或DMSO溶解抗性淀粉残渣,再分析经淀粉葡萄糖苷酶转化后的葡萄糖含量[28,29],并计算转化成抗性淀粉含量或者通过测定总淀粉和非抗性淀粉的含量,间接计算得到抗性淀粉含量[3,30]。测定葡萄糖含量的方法有三种,气相色谱分析法、DNS法和GOPOD法。气相色谱法主要是利用物质间的极性、沸点及吸附性差异来实现不同组分的分离,从而定性定量分析特定物质的含量[31]。DNS法测定葡萄糖含量的原理为DNS试剂中的3,5-二硝基水杨酸在碱性条件下可与还原糖共热可被还原成一种棕红色络合物(3-氨基-5-硝基水杨酸),在一定范围内,溶液的颜色与还原糖的含量成正比,但由于反应受显色剂的剂量、显色时间等因素的影响,从而导致测定结果的重复性较差[32]。GOPOD是葡萄糖氧化酶和过氧化酶偶联的双酶体系,葡萄糖氧化酶可先将葡萄糖氧化,生成H2O2,在过氧化物酶的催化下,H2O2与多种显色剂作用,定量生成有色化合物,然后结合标准曲线或者标准品换算得到相应的抗性淀粉含量。目前,国内外鲜有综述对抗性淀粉体外测定方法进行系统的分析并针对其优劣性进行比较,然而抗性淀粉的含量直接影响其体内潜在生理功能特性,并直接决定了富含抗性淀粉的材料在不同产品中应用的加工特性。本文主要对各种抗性淀粉的体外分析方法进行了详细综述并比较其优劣势,旨在为抗性淀粉体外分析及加工应用提供参考。
1 方法概述
1.1 Englyst法(1982年)
Englyst等[33,34]在测定食物中的非淀粉多糖时初步发现了抗性淀粉的存在,并且系统制定了检测抗性淀粉的方法[29,35],见图1。加热酶解消化所得的葡萄糖含量乘以葡萄糖转换为淀粉的换算系数0.9即为抗性淀粉的含量。该法存在许多缺陷,比如样品分析前先经过研磨或破碎,会导致部分RS1的结构被破坏,使得测量结果偏低。其次样品在酶解掉非抗性淀粉组分前经过了预糊化,会使RS2和部分RS1发生糊化,从而失去其酶抗性,导致最终测定结果低于实际含量[28,30]。

图1 Englyst法体外测定抗性淀粉含量原理图
1.2 Berry法
Berry等[36]发现抗性淀粉的存在可导致对纤维素和非纤维素多糖的虚假估计。Berry法在Englyst法的基础上做出了调整,简化了Englyst法的步骤,具体流程如图2所示。该法中使用的两种酶比Englyst法使用的比例高出10倍,从而导致该法测定的抗性淀粉含量比其他使用较低酶量的方法低6%~13%[37]。此外,该法省略了100 ℃的初始加热步骤,因此可以有效测定样品中包含的RS2[29,38];其次,在加入KOH溶液之前,Berry法将干燥的抗性淀粉残渣提前在水中分散开。并且淀粉与淀粉酶是通过在氯丁橡胶塞密封的玻璃管中实现处理的,无需依赖于Englyst法所描述的专用设备。淀粉样品在42 ℃下水浴振荡处理16 h后,向水解液中加入无水乙醇沉淀回收抗性淀粉,离心,用80%乙醇清洗沉淀,最后用丙酮干燥抗性淀粉残渣。直接添加2 mol/L的KOH难以使抗性淀粉残渣均匀分散,为了避免形成难溶的凝胶,在Englyst法的基础上作出了第3次调整,即用水将丙酮干燥的抗性淀粉残渣浸湿,混匀,再加入等体积的4 mol/L KOH溶液。混合液室温培育30 min,间歇混匀。这一调整能使抗性淀粉残渣充分分散,有利于淀粉在随后的步骤中被淀粉葡萄糖苷酶彻底水解,使测量结果更加真实可靠[36]。

图2 Berry法体外测定抗性淀粉含量原理图
1.3 Bjrock法
Bjorck法[38]与S.A.法[39]基本一致,具体流程如图3所示。二者均先使用AOAC膳食纤维法水解样品,再分析样品残渣中的抗性淀粉含量。抗性淀粉含量为在KOH溶液中增溶后的纤维残渣中的总淀粉含量减去不经KOH处理后得到的总淀粉含量[39]。Siljeström等[39]研究发现延长处理时间至60 min或提高KOH浓度至4 mol/L均不会提高游离葡萄糖含量,但将KOH溶液浓度降低至1 mol/L后产生的游离葡萄糖明显降低。Bjrock法的优势在于其可同时测定抗性淀粉含量和膳食纤维含量,但该法也存在缺陷,该法预先使用了耐高温α-淀粉酶在100 ℃下水解样品,这个过程溶解了部分不溶性多糖[26],并且使淀粉发生糊化,造成RS2糊化而失去其酶抗性,因此该法主要测定的是RS3的含量。
1.4 Englyst法(1992年,总淀粉)
Englyst法(1982年)和Berry法在抗性淀粉测定时,对样品均进行了研磨处理,就自身含有RS1的样品而言,这种处理会导致测定结果比实际结果偏低。针对这一问题,1992年Englyst等[38]在制定总淀粉的测定方法时提出一种更接近生理条件的方式来代替研磨前处理,即在玻璃球和瓜尔胶存在的情况下,在酶处理前将样品切碎,用于模拟样品咀嚼过程及通过胃肠道环境时发生的崩解,并加入瓜尔胶来增加样品的黏度,避免样品中的淀粉被过度水解。此外,向样品中添加玻璃珠是为了适当混匀样品并在酶解的过程中打破样品的细胞壁[30]。该法的具体流程如图4所示。样品中的总淀粉含量(TS)即为TG(总葡萄糖含量)与FG(游离葡萄糖含量)的差值。该法使用的KOH溶液浓度高于其他方法,目的是为了充分溶解样品中的淀粉。

图3 Bjorck法体外测定抗性淀粉含量原理图

图4 Englyst(1992)法体外测定总淀粉含量原理图
1.4.1 Englyst法(1992年,RS1)
使用该法测定样品中RS1的含量时,用以减小样品粒径的操作不同于Englyst法(1982年)。其原理是通过研磨或均质破坏样品中的RS1,比较处理前后样品中抗性淀粉含量的变化,这种差值即被认定是RS1的含量[38]。具体步骤如图5所示。
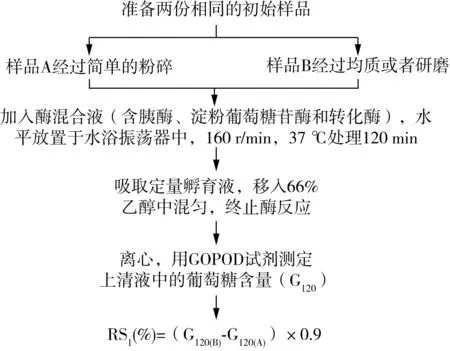
图5 Englyst(1992)法体外测定RS1含量原理图
1.4.2 Englyst法(1992年,RS2)
1992年Englyst等[38]提出了测定RS2的详细方法,如图6所示。其原理为通过煮沸使样品的RS2发生糊化失去其酶抗性,通过比较糊化前后样品中抗性淀粉含量的变化来确定RS2的具体含量。

图6 Englyst(1992)法体外测定RS2含量原理图
1.4.3 Englyst法(1992年,RS3)
Englyst法(1992年)也具体提出了测定RS3的具体方法,如图7所示。该法与Englyst法(1982年)测定的主要都是样品中的RS3,但是二者存在一些差别。该法对使用的酶的种类做出调整(由α-淀粉酶和普鲁兰酶调整为使用胰酶和普鲁兰酶),两处酶解的处理温度也由原先的40℃调整为37℃,65℃调整为60℃,此外还增加了丙酮干燥淀粉残渣的步骤。二者测定葡萄糖含量的方式也不同,Englyst法(1982年)使用气相色谱测定上清液中的葡萄糖含量,而Englyst法(1992年)则使用GOPOD试剂测定上清液的葡萄糖含量[6,30,33]。

图7 Englyst(1992)法体外测定RS3含量原理图
1.4.4 Englyst法(1992年,RDS、SDS和RS)
Englyst等[39]提出的测定RDS、SDS和RS含量的流程如图8所示。该法需与Englyst法(1992年,总淀粉)结合起来才能得到各类淀粉的具体结果。将20 min之前样品被酶解所释放的葡萄糖定义为RDS,将20 min到120 min这段时间释放的葡萄糖定义为SDS,总淀粉减去与快速消化淀粉和慢速消化淀粉的差值即为RS含量[6,30]。

图8 Englyst(1992)法体外测定RDS、SDS、RS含量原理图
1.5 Muir和O’dea法
Muir和O’Dea法[40]是在人体咀嚼过程的基础上进行修正的,但相比于Åkerberg法,该法是在咀嚼后取样进行抗性淀粉分析。将经过前处理的样品分三个方向进行分析,即可分别得到总淀粉和游离葡萄糖含量(图9路径A)、易消化淀粉和游离葡萄糖含量(图9路径B)以及易消化淀粉、游离葡萄糖含量和抗性淀粉含量(图9路径C)。路径B采取酶解处理6 h的步骤是因为食物在小肠中停留的时间大约为6 h,6 h之后食物基本被排出体外。三条路径遵循的规律为:总淀粉+游离葡萄糖=易消化淀粉+抗性淀粉+游离葡萄糖,通过适当计算即可得到每种淀粉的具体含量[40]。Muir和O’Dea法与其他抗性淀粉测定方法的区别在于该法在加入胃蛋白酶酶解后还对样品进行了研磨或均质,这一处理使RS1遭到破坏。在随后的过程中对3种途径获得的液体样品进行煮沸并酶解,该过程使得RS2以及一些天然存在的RS发生糊化,且随后所加入的DMSO可溶解部分未参与形成抗酶微晶的直链淀粉部分,这些步骤都直接影响了抗性淀粉测定结果的准确性[30]。
1.6 Goi法
1.7 Åkerberg法
Åkerberg法可同时测定潜在的可利用淀粉、抗性淀粉以及膳食纤维的含量,该法与体内法测定抗性淀粉含量的结果验证一致性高,重现性好[42]。图11列出了该法的主要步骤。经胃蛋白酶处理后,向试样中加入了定量MgCl2、CaCl2、胰液素、淀粉葡萄糖苷酶以及异丙醇(其中加入钙盐和镁盐是为了提高酶活力,而异丙醇能有效抑制微生物的生长)。收集的滤液可用于测定潜在的有效淀粉组分(如快速消化淀粉和慢速消化淀粉),不溶性沉淀主要包括抗性淀粉、膳食纤维、灰分、蛋白质和盐。用乙醇除去沉淀中的水分,将所得沉淀105 ℃过夜烘干。烘干后的样品即可用于抗性淀粉、蛋白质和灰分含量的分析。为了进行适当的量化,测量总纤维、非淀粉多糖和抗性淀粉的方法之间不应有任何重叠。一般来说,在纤维残渣的分离过程中,淀粉在溶解后通常被认为可完全去除。但从经验来看,高抗性淀粉含量的某些组分似乎不能完全用DMSO分散[42]。一系列实验的结果表明,纤维素残渣主要含有难消化的多糖,包括部分抗性淀粉、木质素的非碳水化合物以及一些不明物质[42-44]。虽然该法不能分开各种形式的抗性淀粉组分,但通过该法基本可测得所有存在形式的抗性淀粉含量[38]。

图9 Muir和O’dea法体外测定抗性淀粉含量原理图

图10 Goi法体外测定抗性淀粉含量原理图

图11 Åkerberg法体外测定抗性淀粉含量原理图
1.8 Champ法
Champ等[45]于1992年进一步修改了原始的Berry方法,并于1999年再次加以改进。Champ法的取样量从10 mg增加到100 mg,样品用胰α-淀粉酶消化,此步骤区别于Englyst法和Berry法使用的胰α-淀粉酶和普鲁兰酶,且样品处理的pH由Englyst法和Berry法的5.0更改为6.9[28,29]。通过插管法和回肠造口术模型两种体内法验证后,结果显示Champ法与回肠造口术模型所获得的结果相比,该法可获得近似的结果,但与插管法所获得的数据相比,该法所测定的抗性淀粉值相对偏低。插管法总是测出比回肠造口模型法更高的抗性淀粉含量值[42]。范媛媛等[45,46]在测定不同品种香蕉样品中抗性淀粉含量时发现,McCleary法稳定性最好,Goi法次之,Champ法最差,这可能是因为Champ法的样品处理温度为65 ℃,在此温度下一些天然淀粉颗粒可能会发生部分溶胀,结构被破坏,结果使抗性淀粉的含量偏低。研究还发现胃蛋白酶对抗性淀粉的测定结果无影响,可能是粗胰α-淀粉酶中已含有活性蛋白酶所致[45]。
1.9 McCleary法
如图12所示,McCleary法[28]分为两部分内容,即先水解样品中的非抗性淀粉,再用KOH溶解沉淀中的抗性淀粉,测定葡萄糖苷酶酶解后的葡萄糖含量,然后通过计算换算为抗性淀粉含量[29]。为避免溶解的抗性淀粉再次重结晶而影响最终抗性淀粉的测定值,KOH溶解了沉淀中的抗性淀粉后要立即加入醋酸钠缓冲液与淀粉葡萄糖苷酶[48]。研究还发现改变控温方式以及处理方式(如控温方式改为空气加热,运动方式改为旋转运动加热处理)均不会影响分析结果。相比于高抗性淀粉含量的食品,低抗性淀粉含量食品的相对变异性普遍较高[28]。McCleary法在水解非抗性淀粉组分时需将pH控制为6.0,这也是经过实验后得出的一个优化的折中方案。pH为6.0时,胰α-淀粉酶和糖化酶的活力都能得到极大保留,pH低于6.0时,胰α-淀粉酶的活力受到抑制,体系黏度增加,淀粉的包埋作用变强,导致KOH不能完全分散开淀粉颗粒,从而使测定结果偏低[48]。

图12 McCleary法体外测定抗性淀粉含量原理图
1.10 其他改进方法
此外,张文伟等[50]考虑到体外测定抗性淀粉过程(16 h,37 ℃)可能会促进微生物的增殖而影响抗性淀粉测定结果的准确性,因此在Goi法的基础上提出了改进,研究了防腐剂及抗生素对抗性淀粉分析的影响,试图通过加入抗生素或防腐剂来改善淀粉处理过程中的发酵现象。研究发现加入苯甲酸钠和山梨酸钾等防腐剂对淀粉酶的水解有明显的抑制作用,且山梨酸钾的抑制作用更强。此外,在淀粉水解16 h后,对照的还原糖量明显低于加入防腐剂的反应液,且对照组的pH值也从初始的6.9降至5.3。该研究也发现加入抗生素能抑制微生物的增殖并且维持pH恒定。防腐剂虽能抑制水解液中微生物的增殖,但必须进行无菌操作,实验步骤较繁琐,抗生素能达到同样的抑菌效果,且无须无菌操作,因此抗生素是较为理想的选择。
2 测定方法的优劣势分析
Berry等[36]通过研究发现抗性淀粉在加热后会失去其部分结晶性质,如当温度加热至约为65 ℃时,RS2即会失去其酶抗性,而加热至120 ℃以上时,RS3则会失去其酶抗性[42]。也有研究发现经热处理得到的部分RS4组分是水溶性或醇溶性的,这使得这部分RS4以及一些寡聚糖能逃避抗性淀粉的检测,从而导致测定结果偏低[3]。其中Muir和O’dea法、Goi法和Åkerberg法在样品预处理时都使用胃蛋白酶先消化掉样品中的蛋白质。Bjorck法与S.A.法的优势在于可以同时测定总膳食纤维及抗性淀粉的含量,但其局限性在于主要测定的是试样中的RS3组分的含量[42]。通过与回肠造口术模型得到的数据相比,Englyst法对主要包含RS3的数量有限的测试样品表现出良好的一致性,但该方法的缺点是复杂且耗时[6,30]。Englyst等还制定了可以量化RS1、RS2、RS3以及RDS和SDS的方法。测定RDS、SDS和RS的方法涉及间接计算,间接计算涵盖了两个实验的误差,所以测量结果缺乏真实可靠性,尤其是针对抗性淀粉含量低的食品。相较于其他方法,Englyst法对水解条件进行了优化,适用于多种底物,且更适合测定RDS和SDS[38]。Muir和O'Dea法也在基于人体咀嚼的基础上修正了方法,该法已与回肠造口术患者的体内分析得到了验证,除个别样品存在轻微差异外,都取得了满意的结果[42]。Goi法在Berry法的基础上作出了3项主要调整。该法对于含有大量抗性淀粉样品的测定效果较显著,对RS含量1%的食品的差异不明显。Goi法比Englyst法更快捷、可靠、且重现性好[38],但Goi法缺乏与体内分析方法的比较[42]。Åkerberg法不能分开各种形式的抗性淀粉组分,但可以测得所有主要形式的抗性淀粉[38]。Champ法简单、快捷,已经经过了插管法和回肠造口术模型两种体内法的验证。McCleary法是唯一经过AOAC认证并采用的方法,该法与通过回肠造口术患者在体内获得的数据非常接近,最适用于食品工业在质量控制和官方食品检验中的广泛应用[42],但也有研究表明该方法不适用于RS质量分数小于1%的样品[48]。此外,在测定抗性淀粉的方法中,消化非抗性淀粉组分处理时是否加入淀粉葡萄糖苷酶对测定的抗性淀粉值有相当大的影响。首先,麦芽糖对胰α-淀粉酶有抑制作用,淀粉葡萄糖苷酶可将麦芽糖水解为葡萄糖,从而消除这种抑制作用[47]。其次,对某些真菌性敏感的含抗性淀粉的食品来说,加入淀粉葡萄糖苷酶(真菌酶)对其抗性淀粉分析是不利的。除了以上因素之外,不同测定方法所使用酶的种类和用量及灭酶方式都不尽相同,这些都会对抗性淀粉含量的分析结果产生不可忽视的影响。
3 结论
抗性淀粉分析方法分为体内和体外两种,体内测定法成本高且对人体有一定的伤害。体外测定方法的基本原理都涉及到用淀粉酶消化去除非抗性淀粉部分,然后用KOH或DMSO溶解抗性淀粉残渣,再经淀粉葡萄糖苷酶酶解转化成游离葡萄糖,通过测定葡萄糖含量并换算为抗性淀粉含量或可通过总淀粉减去非抗性淀粉得到抗性淀粉含量。间接计算过程涵盖了两个实验的误差,故采用间接法测定的抗性淀粉含量缺乏真实可靠性,尤其是针对抗性淀粉含量低的食品。不同的方法使用的酶的种类和用量及灭酶方式等都不尽相同,这些因素都会不同程度地对抗性淀粉的分析结果造成影响。通过比较发现,除Åkerberg法和McCleary法能较为全面的测定RS1、RS2和RS3以外,其他方法均只能测定其中一种或两种类型的抗性淀粉。McCleary法是目前唯一的AOAC采用的且国内外最常用的方法,适用于食品工业在质量控制和官方食品检验中的广泛应用。此外,不同的体外抗性淀粉分析方法仍需针对不同形式的各种食物进行进一步体内验证。由于RS4和RS5结构的特殊性,目前仍未制定可有效量化或囊括二者的抗性淀粉分析方法,这问题将是今后抗性淀粉体外分析需要攻克的技术难关。

