3种藜麦皂苷的超声提取及抗氧化活性比较
傅 钰 张 禾 符 群,2
(东北林业大学林学院1,哈尔滨 150040) (黑龙江省森林食品资源利用重点实验室2,哈尔滨 150040)
藜麦(ChenopodiumquinoaWilld.)是藜科藜属植物,具有一定的耐旱、耐寒、耐盐性,根据其种皮的颜色不同可分为白、红、黑3种。藜麦中富含多种氨基酸、维生素、多酚类[1,2]、黄酮类、皂苷和植物甾醇类物质,其所含脂肪中不饱和脂肪酸占83%[3],具有多种健康功效,可以抗肿瘤[4,5]、抑菌、抗病毒[6,7]、抗氧化等[8,9]。藜麦在1980年被美国宇航局用于宇航员的太空食品。联合国粮农组织认为藜麦是唯一一种单体植物且可满足人体基本营养需求,正式推荐藜麦为最适宜人类的全营养食品,因此藜麦也被国际营养学家称为“未来食品”“超级谷物”[10]。皂苷又称为皂角苷,研究发现皂苷具有多种生理功效,如抑菌、降低胆固醇水平等,多种中药的有效成分都为皂苷。藜麦麸皮中含有大量皂苷,质量分数可达20%~30%[7]。藜麦皂苷水溶后会产生苦涩味,过高剂量服用会产生毒性,但由于其优良特性,近年来成为医学、食品等行业的热点研究对象[11]。
目前,活性成分的提取方法以有机溶剂浸提为主,微波、超声波等技术作为辅助提取。由于植物活性物质具有多元酚羟基和一定的极性,因此在藜麦皂苷的提取中常选用水或乙醇、甲醇、丙酮等有机溶液作为提取剂,这一类溶剂具有较好的溶解性能,并且对植物细胞具有一定的穿透能力,可以促进物质的分离。有机溶剂萃取法成本低廉,设备结构简单,但提取效率往往比较低[12]。超声波辅助提取是利用超声波产生的空化效应,使原料的微小颗粒发生收缩和崩裂,从而释放出活性成分[13]。已有研究对不同颜色的藜麦之间的对比较少,且藜麦制品的原料选择也鲜有关注。赵丹青等[14]对不同品种藜麦的主要营养成分和矿物元素含量进行分析,得到在不同颜色藜麦中,黑色藜麦中各类氨基酸含量均高于其他颜色的藜麦。因此本实验通过超声波辅助乙醇提取法[15],在单因素实验的基础上, 运用响应面优化设计实验对藜麦中的皂苷提取工艺进行优化, 确定最佳提取条件,并对3种藜麦中提取的皂苷进行抗氧化剂效实验, 为提取和评价藜麦中活性成分提供参考。
1 材料与方法
1.1 材料与仪器
黑、红、白藜麦:2018年采集自青海省西宁市多巴镇。
1,1-二苯基-2-三硝基苯肼(≥98%),2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)铵盐,齐墩果酸(≥98%);冰乙酸、无水乙醇、香草醛、铁氰化钾、三氯化铁、过硫酸钾等均为分析纯。
T6紫外可见分光光度计,KQ-300DE数控超声清洗器,EPOCH2全波长酶标仪。
1.2 方法
1.2.1 原料处理
3种藜麦挑选去杂,低温干燥至水分恒定,破碎为60目粉末,冷藏备用。以黑色藜麦为例,研究藜麦皂苷的提取工艺。
1.2.2 齐墩果酸标准曲线绘制与皂苷含量测定
准确称量25 mg齐墩果酸标准品,用乙醇配制成1 mg/mL的母液。分别取0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL母液于7个10 mL试管中,置于70 ℃水浴挥干溶剂。再加入5%香草醛-冰醋酸溶液0.2 mL、高氯酸0.8 mL,在60 ℃水浴下反应15 min,取出后用冷水冷却,加入5.00 mL冰醋酸并在暗处反应15 min。以无标准品的空白样为对照,在550 nm处测定吸光值,以齐墩果酸质量浓度(mg/mL)为横坐标(X),吸光值为纵坐标(Y),绘制标准曲线[16]。得到线性回归方程:Y=1.516 67X+0.016 67,R2=0.999 7。
对提取液按照该方法测定皂苷含量,将测得的吸光度值代入回归方程中得到皂苷浓度,并按照式(1)计算提取液中皂苷提取量。
(1)
式中:c为提取液中皂苷的浓度/mg/mL;V为提取液定容体积/mL;M为藜麦粉质量/g。
1.2.3 超声波辅助乙醇提取藜麦皂苷的工艺研究
准确称取1.000 g黑藜麦粉,以黑色藜麦中皂苷提取量为评价指标进行单因素实验,在300 W超声功率下,分别考察液料比(10∶1、20∶1、30∶1、40∶1、50∶1、60∶1 mL/g),提取时间(20、30、40、50、60 min),提取温度(30、40、50、60、70 ℃),乙醇体积分数(50%、60%、70%、80%、90%、100%)对皂苷提取量的影响。
根据单因素实验结果,采取Box-Behnken实验设计方法,利用Design-Expert设计四因素三水平的响应面工艺优化实验,对超声波辅助提取藜麦中皂苷的工艺参数进行优化。
1.2.4 藜麦提取物的抗氧化活性研究
1.2.4.1 DPPH·自由基清除率测定
在96孔板中依次加入不同浓度梯度的样液100 μL和0.2 mol/L DPPH·溶液100 μL,充分混匀,避光反应30 min后于517 nm波长下测定吸光值Ai。用100 μL无水乙醇代替DPPH·溶液,测定吸光度值Aj。用100 μL无水乙醇代替不同浓度梯度的皂苷提取液,测定吸光度值A0。根据式(2)计算活性物质对DPPH·清除率[17]。
(2)
式中:Ai为样品液的吸光度值;Aj为样品空白管的吸光度值;A0为空白对照管的吸光度值。
1.2.4.2 ABTS+·自由基清除率测定
将7.4 mmol/LABTS+·溶液与2.6 mmol/L过硫酸钾溶液按体积比1∶1混合,室温避光静置12~16 h,用乙醇稀释至在734 nm处吸光度值为0.7±0.02,备用。在96孔板中依次加入25 μL不同浓度梯度的皂苷提取液,200 μL ABTS+·溶液,避光静置6 min,在734 nm处测吸光度值,得到A1。用25 μL乙醇代替样液,测定吸光度值,得到A0。用200 μL乙醇代替ABTS+·溶液,测定吸光度值,得到A2。根据式(3)计算活性物质对ABTS+·清除率[17]。
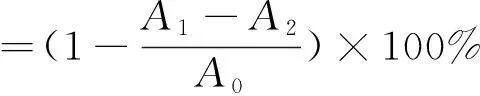
(3)
式中:A0为空白对照吸光度值;A1为样液吸光度值;A2为样液空白管吸光度值。
1.2.4.3 总还原力的测定
取不同浓度梯度的皂苷溶液0.1 mL于试管中,并加入1.00 mL抗坏血酸、2.5 mL磷酸盐缓冲液和铁氰化钾溶液,将试管置于50 ℃水浴中反应20 min,取出后迅速冷却至室温,再加入2.5 mL三氯乙酸。将混合溶液转移至离心管中,在4 000 r/min的条件下离心10 min。取上清液2.5 mL于试管中,加入2.5 mL蒸馏水和1.00 mL三氯化铁,混合均匀后,在700 nm下测量溶液的吸光值,以无水乙醇调零[18]。
2 结果与分析
2.1 提取单因素实验结果及分析
由图1可见,随着液料比、提取时间、提取温度、乙醇体积分数的增加,皂苷提取量总体呈先上升后下降的趋势,其中乙醇体积分数对皂苷提取量的影响最为显著。这可能是由于随着液料比和提取时间的增加,固体原料与溶液的接触面积增加且反应时间加长,使皂苷更充分地溶解于乙醇溶液中,但当液料比增大到一定比例后,其对接触面积的影响将不再明显,且时间继续增加可能会融入其他的杂质干扰了皂苷的溶出,并且破坏皂苷成分,从而使皂苷的提取量下降;提取温度升高会使分子的扩散速度快,皂苷分子溶解在乙醇溶液中的能力变强,当温度过高时,可能会引起溶剂的挥发过大,并且伴随着较多杂质物质的溶出,从而导致皂苷提取量的下降;而体积分数的增加,乙醇提取液的极性与被提取溶质的极性逐渐接近,根据相似相溶的原理,更多的皂苷溶解在乙醇提取液中,但当体积分数增大到100%时被提取溶质的极性会小于提取液的极性,且其他杂质的溶出量会增加,从而导致了藜麦皂苷提取量的减小。

图1 不同单因素对皂苷提取量的影响
2.2 响应面实验结果及分析
2.2.1 响应面结果与方差分析
根据单因素的实验结果,以黑色藜麦中皂苷提取量为响应值,以提取时间、提取温度、液料比、乙醇体积分数为自变量,进行四因素三水平的响应面分析实验,经 Design-Expert 8.0.6 trial 设计的实验方案及结果如表1所示。
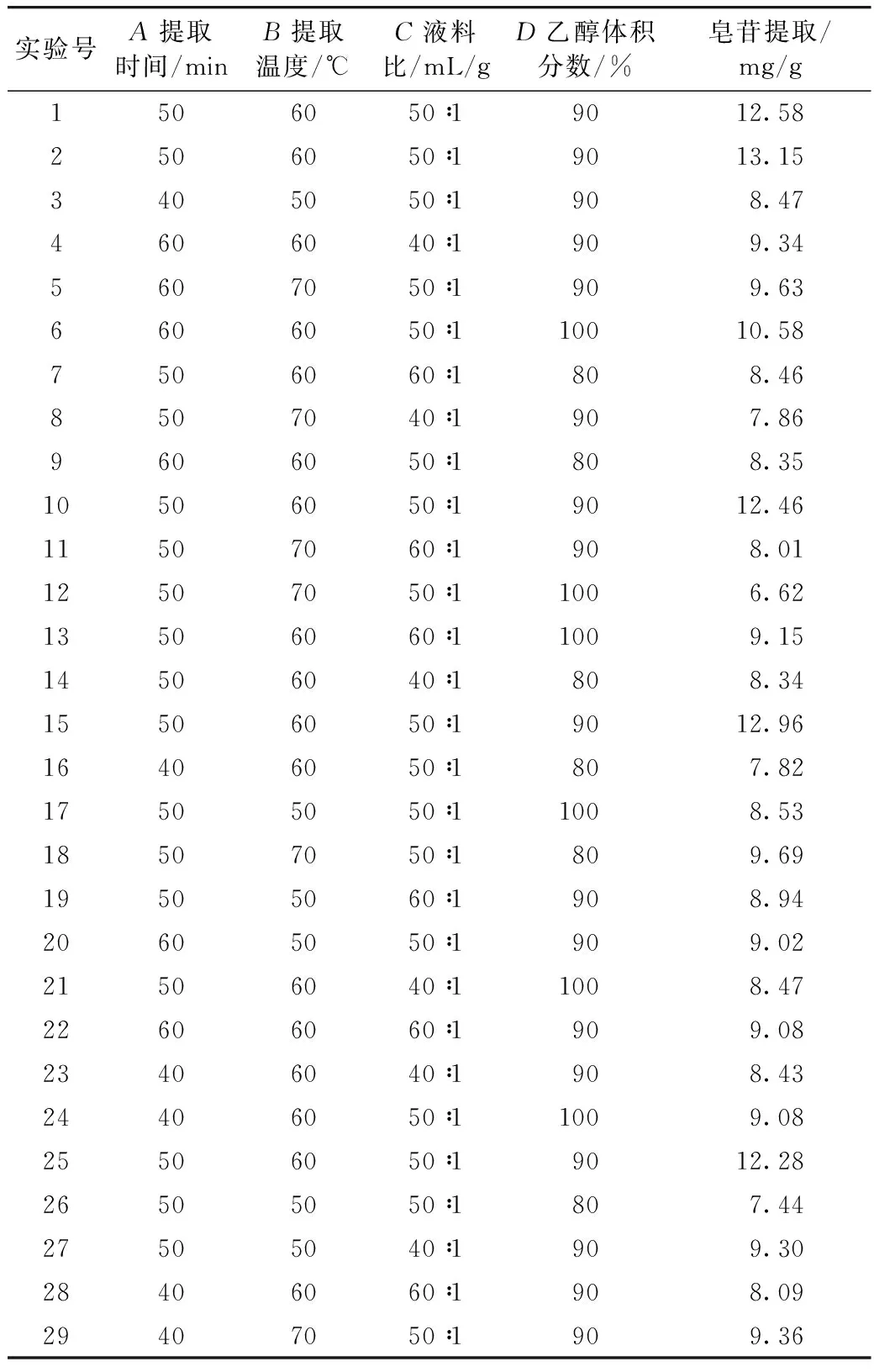
表1 响应面设计实验结果

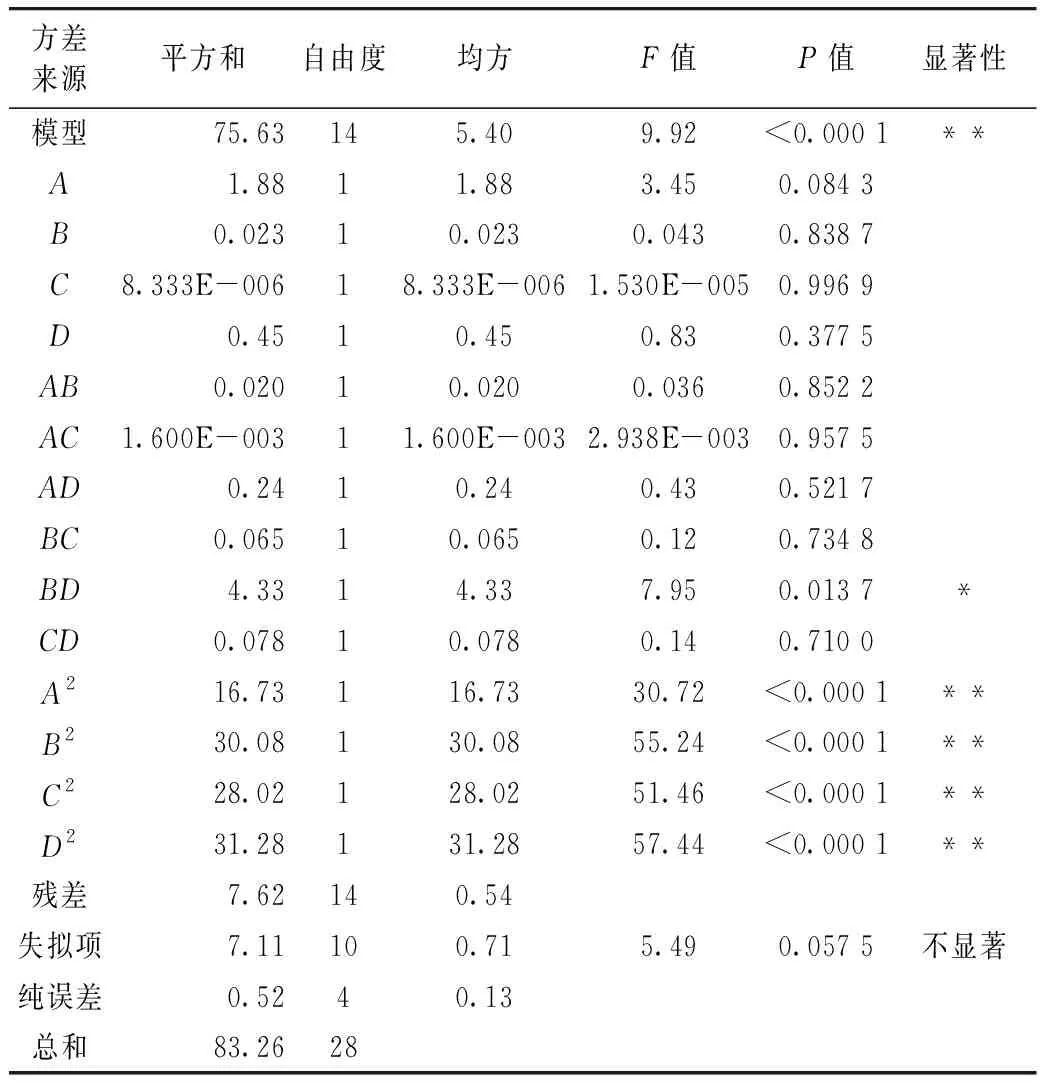
表2 方差分析表
2.2.2 响应曲面与等高线分析
藜麦皂苷提取量的影响因素及其交互作用的显著性如图2~图7所示。通过等高线的形状分析交互影响的显著程,响应面上标记的最高点即为最大值,说明在所选分析的因素水平范围内存在极值[19]。由图2~图7可知,提取时间、提取温度、液料比和体积分数对皂苷提取量均有显著影响。图2表明当温度一定时,随着提取时间的增加,皂苷的提取量增大,当提取时间达到50 min时提取量最高,继续增加提取时间其提取量会发生下降;当提取时间一定时,提取温度有相同的趋势,但影响较小;随着提取温度的增大,皂苷的提取量先增大后减小。图3和图4表示随着乙醇体积分数的增大,藜麦皂苷的提取量先增大后减小,在90%时取得最大值;液料比和提取时间对提取量均有相同的影响趋势,但效果小于体积分数。图5表明当液料比一定时,提取温度增大会使皂苷的提取量先增大后减小,在60 ℃时达到最大值;温度一定时,液料比对提取量有相同的影响趋势。图6表明体积分数和提取温度的增大都会使皂苷提取量先增大后减小,分别在90%和60 ℃时取得最高点。图7表明体积分数和液料比对皂苷的提取量影响效果相同,提取量随着体积分数和液料比的增大而先升高后下降,在90%和50∶1 mL/g时达最大值。
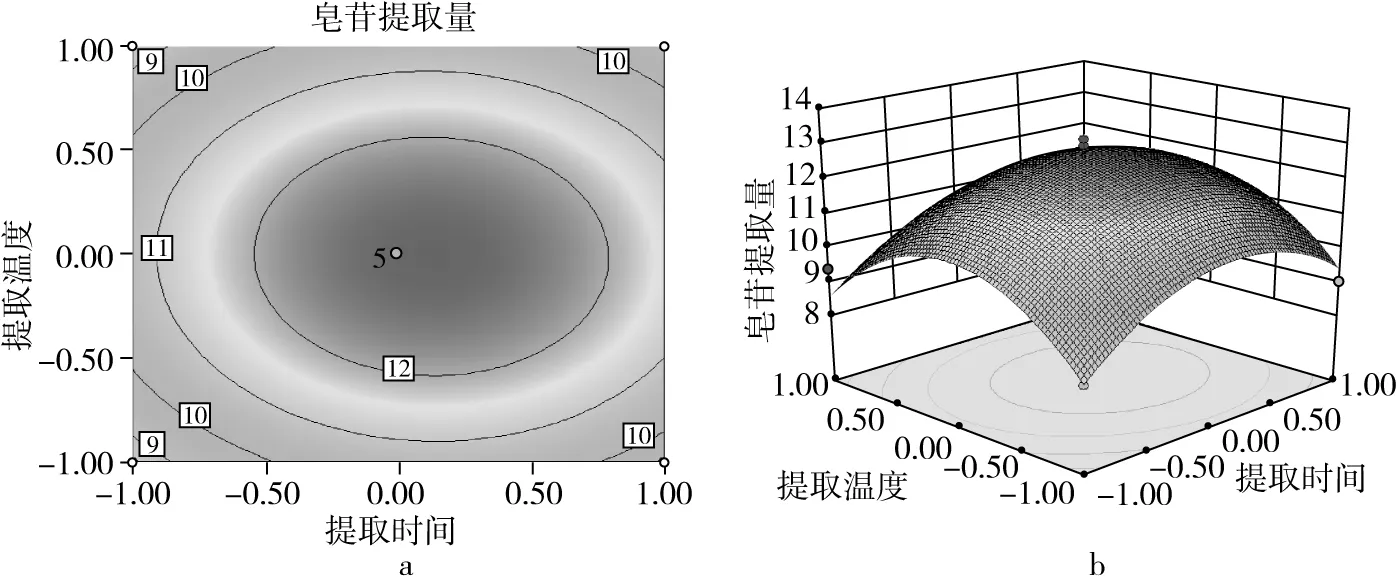
图2 提取时间及提取温度对皂苷提取量的等高线及响应面

图3 提取时间及液料比对皂苷提取量的等高线及响应面

图4 提取时间及乙醇体积分数对皂苷提取量的等高线及响应面
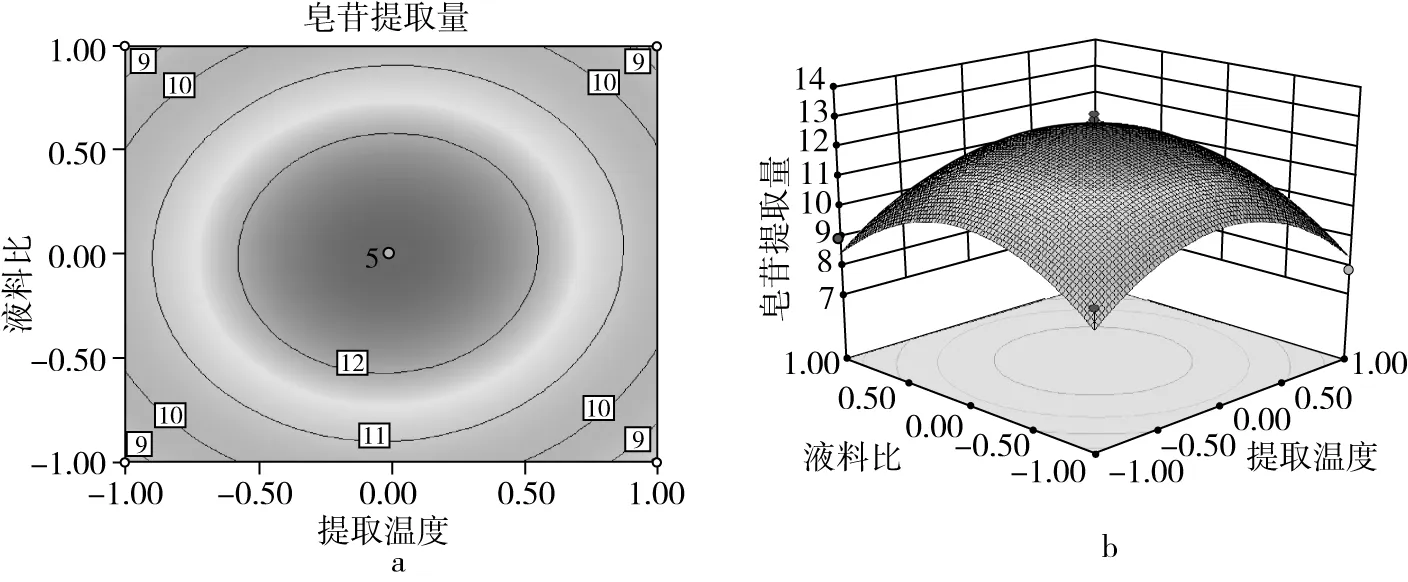
图5 提取温度及液料比对皂苷提取量的等高线及响应面
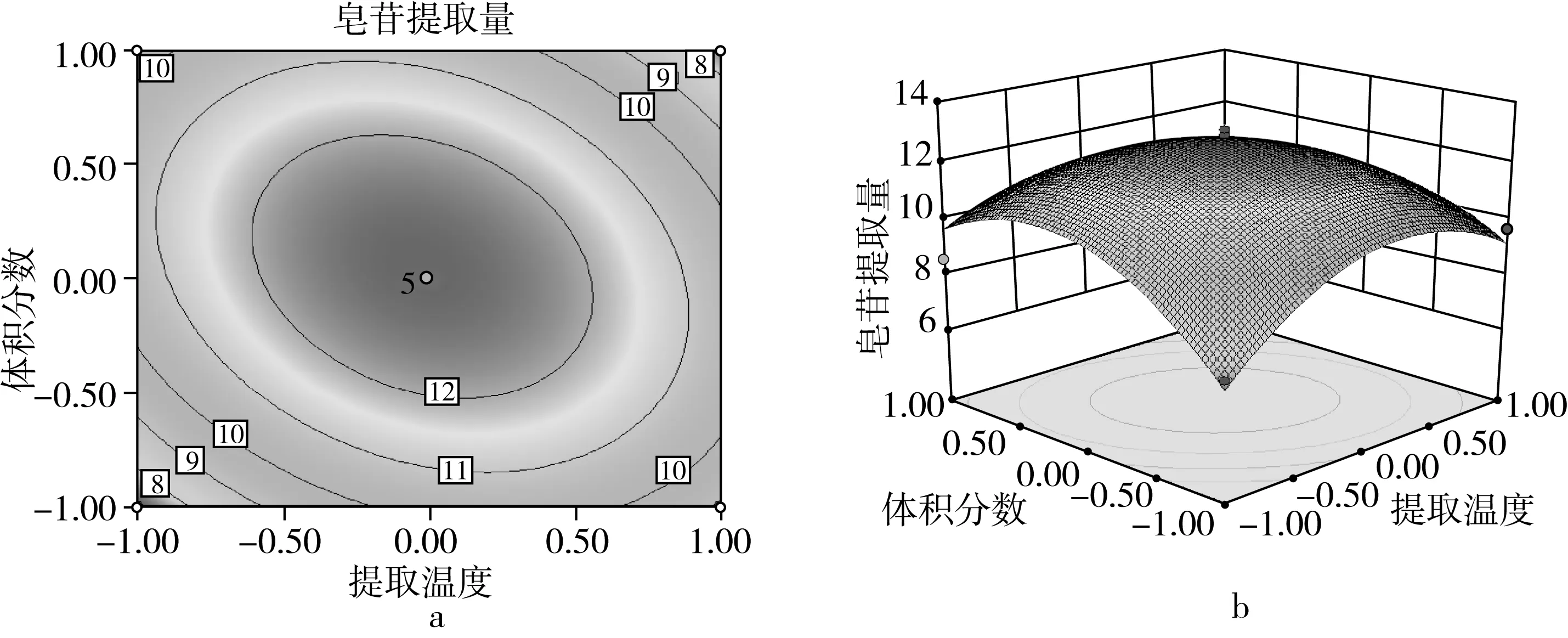
图6 提取温度及乙醇体积分数对皂苷提取量的等高线及响应面
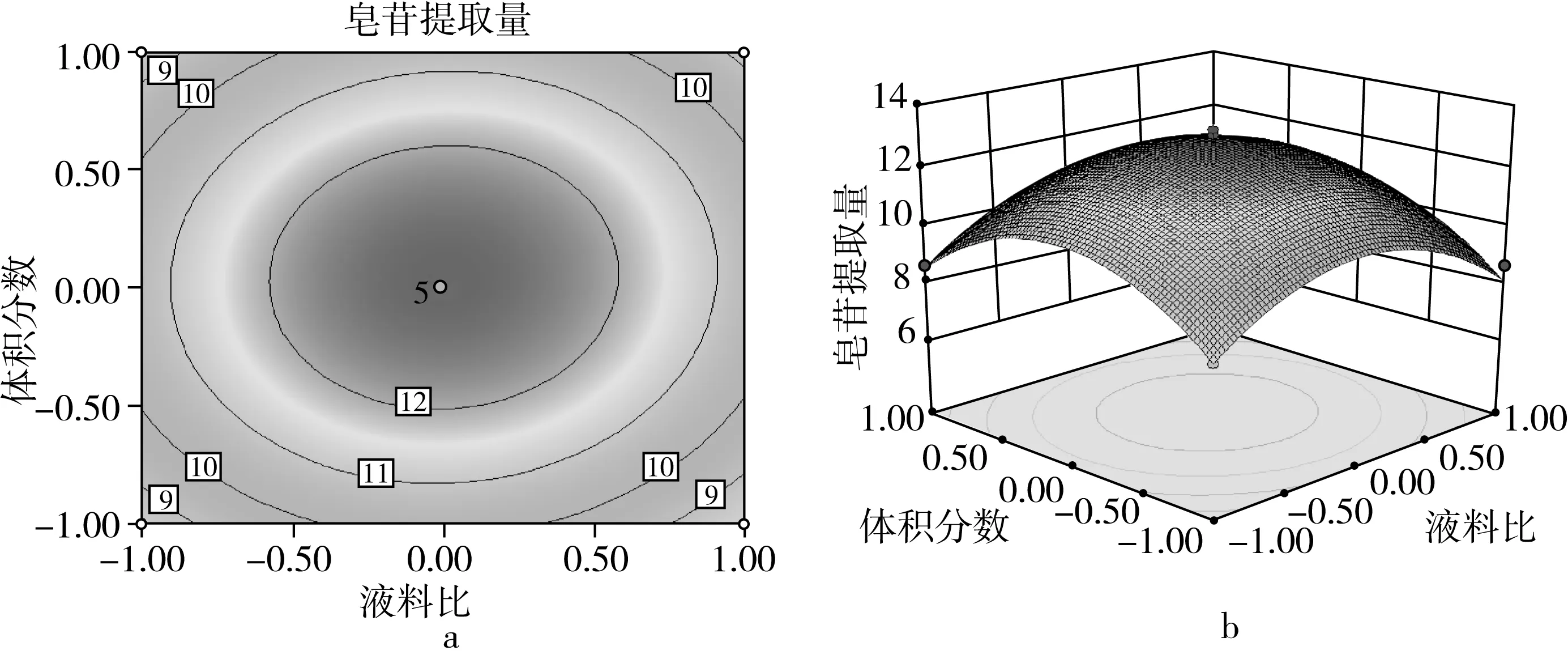
图7 液料比及乙醇体积分数对皂苷提取量的等高线及响应面
2.2.3 最佳条件确定和回归模型验证实验结果
通过响应面分析得到超声波辅助乙醇提取藜麦中皂苷的最佳工艺条件为:提取时间51.29 min,提取温度59.74 ℃,液料比50.02∶1 mL/g,乙醇体积分数90.57%,在此条件下皂苷提取量为12.717 5 mg/g。为使实际操作中更便于控制,调整最佳工艺为:提取时间50 min,提取温度60 ℃,液料比50∶1 mL/g,乙醇体积分数90%。在此条件下进行最优工艺的验证,计算出皂苷提取量为12.65 mg/g,实际得率与模型预测值的误差为0.5%,证明模型理论预测值与实际值拟合效果良好。
采用相同方法对白色、红色藜麦皂苷提取工艺进行研究,因素优化后的水平结果与黑色藜麦无显著差异。
2.2.4 3种不同颜色的藜麦的抗氧化能力评价
2.2.4.1 DPPH·自由基清除能力
黑、白、红3种颜色藜麦中的皂苷对DPPH· 的清除能力如图8。随着3种藜麦皂苷浓度增加,其清除DPPH·自由基的能力均呈现显著增加趋势,当浓度达到10 mg/g时,3种藜麦的清除能力集中在较小的范围内;当浓度较低时,3种不同品种的藜麦在其相同皂苷浓度条件下对DPPH·自由基的清除能力差异较大。黑色、红色、白色藜麦皂苷的IC50分别为2.205、3.724、4.303 mg/g。总体趋势表现为黑色藜麦>红色藜麦>白色藜麦,即随着其种皮颜色的由深至浅,抗氧化能力逐渐减弱。这可能是由于不同颜色的藜麦中含有的有效抗氧化皂苷量差异较大,其中深色藜麦含有较多且活性高,导致抗氧化能力更强。

图8 不同藜麦皂苷对DPPH·自由基清除的影响
2.2.4.2 ABTS+·自由基清除能力
黑、白、红3种颜色藜麦中的皂苷对ABTS+·清除能力结果如图9。随着皂苷浓度的增加,藜麦皂苷对ABTS+·自由基的清除能力也在逐渐增强。当皂苷浓度达到10 mg/g时,黑、红、白三色藜麦皂苷清除率差异显著(P<0.05),说明不同品种的藜麦中皂苷种类可能有所不同,因此在清除ABTS+·自由基时表现出了不同的能力大小。在皂苷浓度较低时,红色和白色藜麦清除能力相近,仍显著小于黑色藜麦。3个品种的藜麦对ABTS+·自由基的清除能力大小为:黑色藜麦>红色藜麦>白色藜麦。
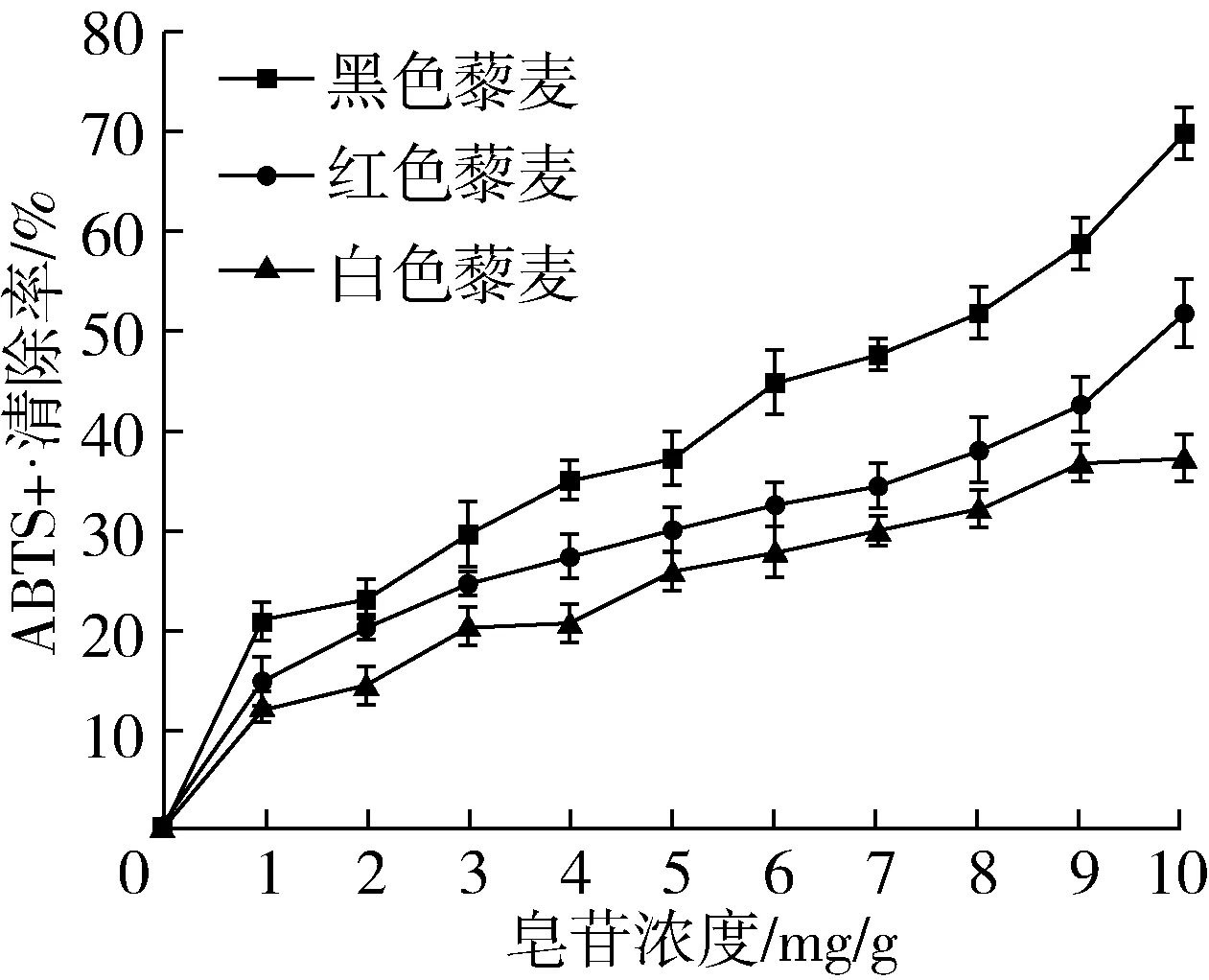
图9 不同藜麦皂苷对ABTS+·自由基清除的影响
2.2.4.3 总还原力
黑、白、红3种颜色藜麦中的皂苷总还原能力对比结果见图10。总还原力的强弱与吸光值的大小成正比。由图10可知,3个不同品种藜麦皂苷的总还原力随着皂苷浓度的增大而逐渐增强,其中黑色藜麦的还原能力极显著大于红色藜麦和白色藜麦(P<0.01),而白色藜麦略大于红色藜麦。已有研究证明,皂苷类化合物的抗氧化活性与皂苷元配基的结构和糖残基的数量有关[20],因此可能是由于黑色藜麦与其他两色的糖基不同导致活性差异显著。

图10 不同藜麦皂苷总还原能力对比
3 结论
采用超声波辅助乙醇提取藜麦中皂苷化合物,单因素实验结果表明,4个因素对皂苷的提取量影响趋势相似,即先增大后减小。通过响应面优化出最佳工艺为:乙醇体积分数90%,液料比为50∶1 mL/g,超声功率300 W,提取温度60 ℃,提取时间50 min,此时皂苷的提取量为12.65 mg/g,结合响应面实验可得出4个因素对提取量的影响显著程度为:提取时间>体积分数>提取温度>液料比。
对比了黑、红、白3种藜麦皂苷的抗氧化能力强弱,结果表明,在对DPPH·、ABTS+·自由基的清除能力方面表现为:黑色藜麦>红色藜麦>白色藜麦;在总还原能力方面表现为:黑色藜麦>白色藜麦>红色藜麦。藜麦皂苷具有良好的抗氧化能力,且由于品种的不同其抗氧化能力也有所差异,整体上表现为深色藜麦皂苷活性优于浅色藜麦皂苷,其中黑色藜麦的抗氧化能力最强。本研究体现出显著的皂苷与抗氧化活性间剂量-效应关系。藜麦提取物为混合物,今后研究可对提取物的成分进行鉴定,以充分确证和评价藜麦皂苷活性。
不同颜色的藜麦之间存在一定程度的品质差异,在口感方面,浅色藜麦优于深色藜麦;但在抗氧化能力方面,黑色藜麦的抗氧化能力显著高于红色和白色藜麦。因此,在食品加工生产中可根据不同产品需求选择不同颜色的藜麦原料。

