丙型肝炎病毒高水平复制细胞株的构建及其机制初步研究
宋武慧,易志刚
复旦大学上海医学院基础医学院病原生物系, 教育部、卫健委、医科院医学分子病毒学重点实验室, 上海 200032
丙型肝炎病毒(hepatitis C virus, HCV)属于黄病毒科,其基因组为单股正链线性RNA[1]。人体被HCV感染后可罹患慢性肝炎和肝硬化,最终发展成肝细胞肝癌,甚至死亡[2]。目前的研究认为,HCV编码的蛋白前体经宿主细胞及病毒自身的蛋白酶切割后,产生结构蛋白和非结构蛋白,其中非结构蛋白主要参与病毒翻译复制过程[3]。支持HCV高水平复制的细胞株只有Huh 7.5,它是由α-干扰素(IFN-α)以100 IU/ml的浓度处理HCV 复制子细胞后获得。研究人员发现该HCV cured细胞支持HCV高水平复制,但并非所有HCV cured细胞株皆有对病毒易感的新特征[4]。虽然对HCV的探索已有突破性进展,但病毒翻译复制等关键生活周期环节并未彻底研究清楚。细胞模型的缺乏制约了对HCV生活周期进行深入研究,因此构建支持病毒高水平复制的细胞模型将为深入开展HCV基础性科学研究提供有力的工具。
1 材料和方法
1.1 材料
肝癌细胞系Huh 7为本室保存[5]。肝癌细胞系Huh 7.5和HCV全长基因组质粒Jc1G为美国洛克菲勒大学Charles Rice 教授馈赠[6]。HCV亚基因组sg-Jc1为本室人员在Jc1G基础上构建[5]。试剂:DMEM(Dulbecco’s modified eagle medium)培养基(美国Corning Cellgro公司,10-013-CVa),胎牛血清(以色列Biological Industries公司, 04-001-1ACS),杀稻瘟菌素(美国Invitrogen公司,R21001),体外转录试剂盒(美国Invitrogen公司,AM1334),海肾荧光素酶检测试剂盒(美国Promega 公司, E2820),IFN-γ(美国Proteintech公司, HZ-1301),IFN-α(美国PBLassay science公司, 11200-2), ECL 化学发光试剂盒(美国PerkinElmer公司, NEL103E001EA),TRIzolTMReagent (美国Invitrogen 公司, 15596018),反转录试剂盒(日本Takara公司,DRR047A),荧光定量PCR试剂盒 (日本Takara公司,DRR041A)。实验中所用抗体及来源如下:NS3抗体(美国Virogen公司; 217-A),HRP羊抗鼠二抗 (美国Santa Cruz公司; sc-2005),β-actin抗体 (美国Sigma公司; A1978), MDA5 抗体 (美国CST公司; 5321S), RIG-I 抗体 (美国Enzo Life Sciences 公司; Alme1),MAVS 抗体(美国Santa Cruz 公司;sc-166583)。
1.2 方法
1.2.1 HCV复制子细胞株的建立 将HCV 亚基因组sg-Jc1酶切线性化后体外转录的RNA电转入Huh 7细胞,3 d后换含有5 μg/mL的杀稻瘟菌素(blasticidin)培养液置5% CO2、37 ℃培养。此后每隔2 d换液继续培养至细胞单克隆出现。取5~6个克隆,分别种于96孔板中继续置37 ℃培养,培养液中blasticidin的浓度调节为0.5 μg/mL。待细胞在板上长满后,转至更大孔径培养板中, 长满后再转至细胞培养瓶中继续置5% CO2、37 ℃培养,传代扩增细胞并冻存于液氮罐。
1.2.2 HCV cured细胞株的建立 将HCV亚基因组复制子细胞株以5×104细胞/mL铺于T25细胞培养瓶,置5% CO2、37 ℃培养过夜。次日更换含有 1 000 IU/瓶 IFN-γ的新鲜培养基,每隔2 d换液1次,待培养瓶内细胞长满后进行传代,培养3周。3周后撤去IFN,继续培养细胞1周后,取细胞样本检测病毒RNA,阴性细胞进行传代扩增并冻存于液氮罐。
1.2.3 病毒感染 将细胞以5×104孔铺板于48孔板,待细胞汇合度为30%~40%时加入病毒Jc1-G[感染复数 (multiplicity of infection, MOI) 为0.1]。感染后6 h用磷酸盐缓冲液(phosphate buffered saline, PBS)洗3遍,更换新鲜培养基,48 h后收集细胞上清液和细胞。
1.2.4 荧光素酶活性检测 开启荧光检测仪GloMax® 20/20 Luminometer(美国Promega公司),将机器参数设置为Read 10 s; delay 2 s。取上清液10 μL,加入10 μL 2×passive lysis buffer混匀后加入50 μL 1× renilla luciferase substrate,吹吸5次后插入仪器样品槽读取荧光数值。
1.2.5 蛋白质印迹检测 取细胞蛋白样品进行丙烯酰胺凝胶电泳(10%分离胶),电转印至硝酸纤维素膜上,用含有5% 脱脂奶粉和0.05% 吐温的PBS置室温封闭1 h,分别加NS3抗体和β-actin抗体置4 ℃孵育过夜,次日加HRP羊抗鼠二抗置室温孵育2 h后,用ECL化学发光检测。
1.2.6 荧光定量PCR TRIzol 裂解细胞后加入氯仿混匀,12 800 g 离心15 min,取上清液加入等量的异丙醇(isopropyl alcohol), 温和地上下颠倒数次,12 800 g 离心15 min。用预冷的75%乙醇洗涤沉淀物后加入焦碳酸二乙酯(DEPC)水溶解。取1 μg RNA按照反转录试剂盒试剂盒操作步骤进行反转录。取反转录产物参照荧光定量PCR试剂盒试剂盒说明书进行荧光定量PCR。定量引物见表1。
1.2.7 统计学分析 应用Graphpad Prism 6软件作图并分析数据。组间采用t检验比较差异,P<0.05表示差异有统计学意义。
2 结果
2.1 HCV cured细胞株Huh 7A和Huh 7B的建立
首先建立HCV亚基因组复制子系统。将体外转录的sg-JFH1 RNA电转到Huh 7细胞中,3 d后用5 μg/mL的blasticidin进行克隆筛选。筛选出2株单克隆细胞株,命名为6#和8#。
利用IFN-γ分别处理6#和8#HCV亚基因组复制子细胞,每隔2~3 d用含有IFN-γ培养液传代培养,3周后换不加IFN-γ培养基继续培养1周,将获得的2株细胞株分别命名为Huh 7A和Huh 7B,应用荧光定量PCR检测HCV RNA拷贝数。结果显示,6#和8#细胞株均检测出HCV RNA,提示HCV亚基因组复制子细胞株成功建立;Huh 7、Huh 7A和Huh 7B细胞内未检测出HCV RNA,提示Huh 7A和Huh 7B是HCV cured 细胞株(图1)。
2.2 Huh 7A和Huh 7B细胞株支持HCV高水平复制
为验证Huh 7A和Huh 7B细胞株是否支持HCV高水平复制,利用HCV Jc1-G株分别感染Huh 7、Huh 7.5、Huh 7A和Huh 7B细胞,感染72 h后收集上清液和细胞分别进行荧光素酶活性测定、蛋白质印迹和荧光定量PCR检测。结果显示,与Huh 7相比,Huh 7A和Huh 7B细胞上清中Gluc活性水平显著上调(图2A);Huh 7A和Huh7B

表1 定量PCR引物

Replicon 6# and 8# cells were generated by electroporation of in vitro transcribed sgJc1 RNA into Huh7 cells and selection with blasticidin. The two replicons 6# and 8# cells were treated with interferon gamma and designated as Huh 7A and Huh 7B respectively. HCV RNA levels in indicated cells were quantified by quantitative RT-PCR and normalized against GAPDH RNA levels. Results are reported as mean±s (n=4).
细胞内 HCV NS3 蛋白表达和 HCV RNA拷贝数相比较Huh 7亦显著增加,其中HCV RNA水平较Huh 7细胞显著增加,与Huh 7.5细胞内病毒RNA水平接近(图2B、C)。以上结果提示,所获得的Huh 7A和Huh 7B细胞株与HCV cured细胞株Huh 7.5在HCV易感性方面相似。
2.3 Huh 7A和Huh 7B细胞株 RIG-I/MDA5/MAVS 的内源性表达
为检测Huh 7A和Huh 7B细胞株内源性RIG-I/MDA5/MAVS表达,收集Huh 7、Huh 7.5、Huh 7A和Huh 7B细胞分别进行蛋白质印迹和荧光定量PCR检测。结果显示,与Huh 7细胞相比,Huh 7A和Huh 7B 细胞内RIG-I内源性蛋白表达轻微下调,分别降至Huh 7细胞的60%和80%,但mRNA水平差异无统计学意义(P>0.05),P值分别为0.56和0.14;Huh 7、Huh 7A和Huh 7B细胞内MDA5和MAVS蛋白表达和mRNA水平皆无显著差异(图3A、B)。Huh 7.5细胞内源性RIG-I表达明显降低,蛋白水平和mRNA水平分别降至Huh 7细胞的21%和52%(P<0.05)(图3A、B)。有趣的是,Huh 7.5细胞内源性MDA5表达亦显著下调,蛋白水平几乎检测不到,mRNA水平仅有Huh 7细胞的27%(图3A、B)。Huh 7.5细胞内源性MAVS蛋白和mRNA水平轻微上调,但差异无统计学意义(P=0.32),见图3A、B。

Huh 7 cells,Huh 7.5 cells, Huh 7A cells and Huh 7B cells were infected with HCV Jc1G at an MOI of 0.1 for 2 days. A: Gaussia luciferase (Gluc) activity in the supernatant from infected cells is shown. Results are reported as mean±s (n=4). ****P<0.000 1, ****P<0.000 1, ***P=0.000 1. B: HCV RNA levels in the infected cells were determined by quantitative RT-PCR and normalized against GAPDH RNA levels. Results are reported as mean±s (n=3). *P=0.022 1, ***P=0.000 5, **P=0.001 6. C: Western blot analysis of infected cells with antibodies against the proteins indicated. Representative result from three independent experiments is shown.
2.4 Huh 7A和Huh 7B细胞株干扰素刺激基因(interferon-stimulated genes,ISGs)表达较Huh 7细胞无显著差异
为验证Huh 7A和Huh 7B细胞株中抗病毒效应ISGs表达是否异常,利用IFN-α分别处理Huh 7、Huh 7.5、Huh 7A和Huh 7B细胞,应用荧光定量PCR检测ISGs表达。结果显示,Huh 7A和Huh 7B细胞株isg56,mx1,mx2,oax1,oax2,viperin,cxcl10,ifitm1和ifitm3表达变化与Huh 7 细胞株趋势一致,其mRNA水平与Huh 7细胞的相比皆无显著差异;与Huh 7、Huh 7A和Huh 7B细胞株相比,Huh 7.5 ISGs表达变化和水平亦无明显差异(图4A)。
为进一步验证ISGsmx1表达水平是否异常,利用不同浓度IFN-α分别处理Huh 7、Huh 7.5、 Huh 7A和Huh 7B细胞, 应用荧光定量PCR检测mx1表达。结果显示,10 U/mL IFN-α即可提高细胞内mx1 mRNA水平,且随着IFN-α浓度的增加,mx1表达水平显著上调;但这种变化在4种细胞之间皆无显著差异,提示Huh 7.5、Huh 7A和Huh 7B细胞株对HCV易感可能与mx1无关(图4B)。
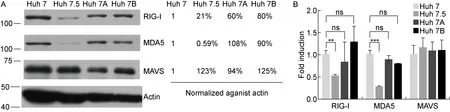
A: Western blotting analysis of the endogenous protein expression in Huh 7 cells,Huh 7.5 cells, Huh 7A cells and Huh 7B cells with the indicated antibodies. Gel analysis of proteins in panel A with Image J software. B: Real-time PCR quantification of endogenous RIG-I, MDA5, MAVS mRNA levels in indicated cells. The mRNA levels fold induction was normalized to the Huh 7 group. Results are reported as mean±s (n=4). **P=0.001 4, ***P=0.000 3. Similar results were observed in another independent experiment.
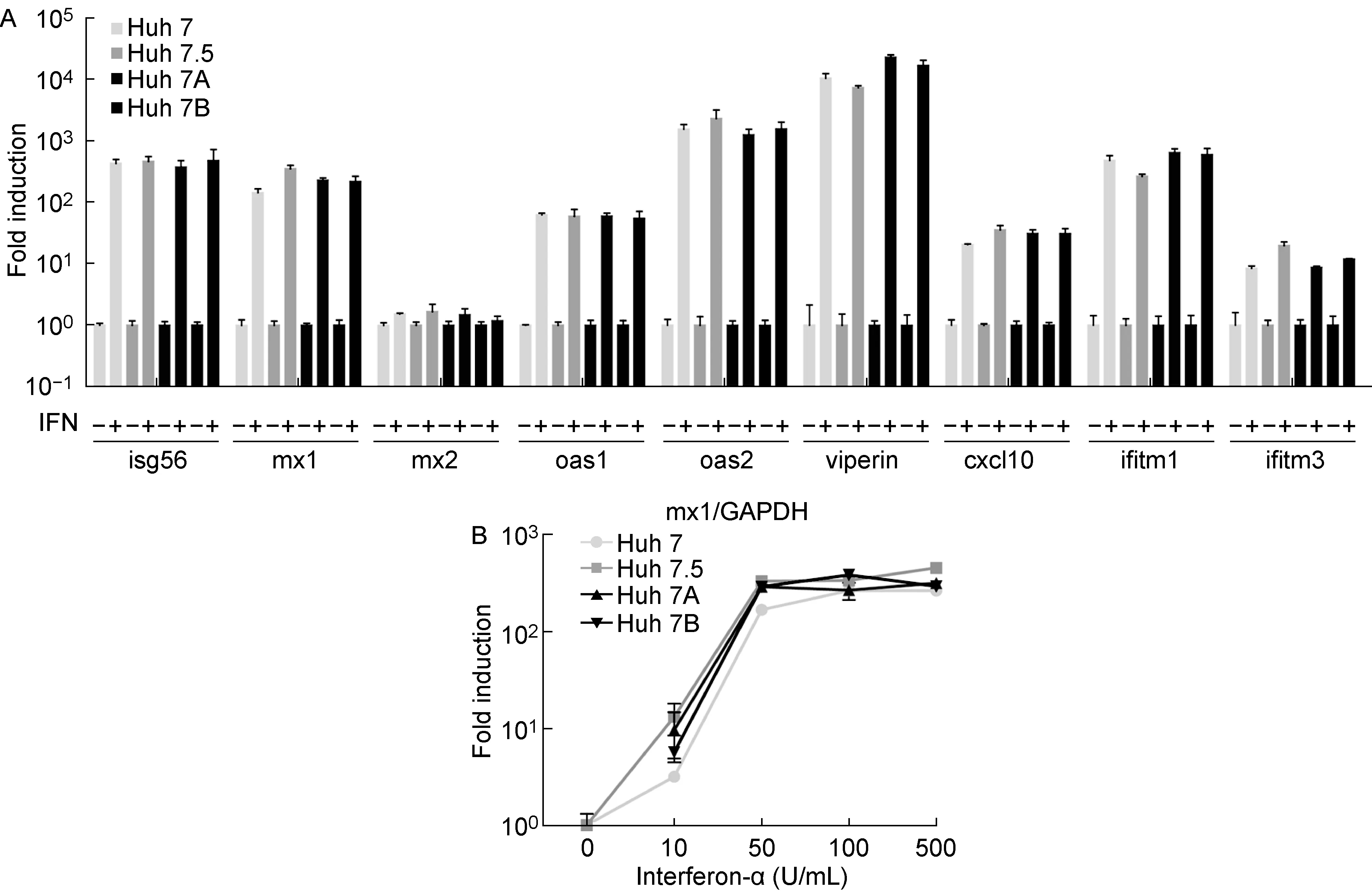
A: Huh 7,Huh 7.5, Huh 7A and Huh 7B cells were seeded and untreated or treated with 500 IU/ml of interferon-alpha for 6 hours respectively. The indicated ISGs mRNA levels were quantified by quantitative PCR and normalized against GAPDH RNA levels. The mRNA level fold induction was normalized to the IFN-untreated groups. Results are reported as mean±s (n=4). Similar results were observed in another independent experiment. B: Huh 7,Huh 7.5, Huh 7A and Huh 7B cells were seeded and treated with 0, 10, 50, 100 and 500 IU/ml of interferon-alpha respectively. Following incubation for 6 hours, the indicated mx1 mRNA levels were quantified and normalized against GAPDH RNA levels. The mRNA level fold induction was normalized to the 0 IU/ml of IFN groups. Results are reported as mean±s (n=4). Representative data from multiple experiments with similar results are shown.
3 讨论
目前HCV仍然是严重危害人类健康的重要病原体之一[1]。近年来,一些靶向HCV蛋白的药物(direct-acting antiviral agent, DAA)被批准上市,具有抗病毒效果好、副作用小的优点,但药物费用高昂,且部分患者治疗效果不佳[7]。虽然针对HCV的治疗已经取得重大进展,但病毒的生活周期等重要环节尚未研究透彻,还需深入探讨。Blight等发现HCV复制子细胞经过IFN-α处理后显示出对病毒易感的特性,将其命名为Huh 7.5[4],该细胞株是目前唯一公认支持HCV高复制水平的细胞株。为构建支持HCV高复制水平的细胞株,本研究采取IFN-γ治疗HCV复制子细胞策略,分别处理单克隆复制子细胞株6#和8#,筛选出2株细胞株(Huh 7A和Huh 7B)。实验结果显示,在Huh 7A和Huh 7B细胞株中,病毒基因组中插入的Gluc报告基因活性和病毒RNA复制水平明显上调,病毒蛋白的表达亦显著增加,接近Huh 7.5的病毒复制水平,表明Huh 7A和Huh 7B细胞株可支持病毒高水平复制。虽然不同的单克隆复制子细胞株中病毒复制水平存在差别,但本研究获得的2株HCV cured细胞株Huh 7A和Huh 7B对HCV易感性并无显著差异,提示HCV cured细胞株易感机制可能与宿主细胞因素相关。
有文献报道RIG-I/MDA5/MAVS通路通过识别HCV双链RNA后诱导产生IFN从而抑制病毒复制[8]。已有研究发现Huh 7.5细胞内RIG-I突变,但在Huh 7细胞中敲除该基因后并不能增加病毒复制水平,提示Huh 7.5细胞对HCV易感可能与RIG-I突变不相关[9]。本研究检测Huh 7、Huh 7.5、Huh 7A和Huh 7B细胞中RIG-I/MDA5/MAVS蛋白和mRNA水平,发现Huh 7.5细胞表达RIG-I显著下调;有意思的是MDA5表达亦明显降低,但这是否与Huh 7.5细胞对HCV易感相关还需进一步验证。而Huh 7A和Huh 7B细胞中RIG-I/MDA5/MAVS表达水平与Huh 7细胞无显著差异,说明Huh 7A和Huh 7B细胞对HCV易感可能与RIG-I/MDA5/MAVS通路无关,或许存在其他机制。
抗病毒ISGsmx1被报道可能与HCV cured细胞易感性相关,有报道发现用IFN-α刺激HCV cured细胞,抗病毒基因mx1激活倍数显著减少,敲除该基因后病毒复制水平增加,而回补该基因则抑制病毒复制[10]。本研究用IFN-α处理4种细胞并检测已报道的具有抗病毒效应的ISGs激活水平,发现无论在Huh 7.5细胞还是在Huh 7A和Huh 7B细胞中,ISGs的激活水平均与Huh 7细胞中的一致。为进一步验证mx1与Huh 7.5、Huh 7A和Huh 7B细胞HCV易感相关性,用不同浓度的IFN-α处理细胞,发现4种细胞中mx1激活水平随着IFN剂量增加而增加,激活倍数无显著差异,说明不同株的HCV cured细胞其易感性机制不同。
综上所述,对HCV cured细胞易感性虽有不少研究,但具体机制尚存在争议。下一步我们将在Huh 7.5、Huh 7A和Huh 7B细胞株中继续探索易感机制,为建立更好的细胞模型提供理论基础,从而为病毒学基础研究提供有力工具。

