柳州地区新生儿B族链球菌对抗菌药物的耐药性、血清型与分子遗传背景特征分析Δ
傅锦坚,陈继昌,肖 萍
(1.柳州市妇幼保健院检验科,广西 柳州 545001; 2.柳州市妇幼保健院新生儿科,广西 柳州 545001; 3.柳州市妇幼保健院药学部, 广西 柳州 545001)
B族链球菌(Group BStreptococcus,GBS)是引起新生儿败血症和脑膜炎的主要病原体[1-3]。据估计,10%~30%的妊娠期妇女直肠阴道定植有GBS,而母体携带GBS是新生儿感染的主要来源[4]。在没有任何干预的情况下,GBS定植的母亲娩出的新生儿中有1%~2%可有严重性的感染,如败血症或脑膜炎等[4]。新生儿GBS疾病是分娩期间由母亲-新生儿的垂直传播或由医护人员的水平传播引起的[5]。在0~6日龄新生儿中发生的感染被称为早发型,在7~90日龄新生儿中发生的感染被称为晚发型;脓毒症和肺炎常见于早发型,而脑膜炎和菌血症在晚发型中更常见[6]。研究者已开发多种技术去更好地理解GBS的种群结构,其中多位点序列分型(multilocus sequence typing,MLST)是标准的分型方法[7-8]。循证医学证据显示,分离自不同国家不同人群的GBS菌株的MLST结果表明,只有少数的克隆复合体(clonal complex,CC),包括CC1、CC10、CC17、CC19和CC23与GBS的定植或侵袭性感染有关[9]。在上述CC中,CC17是一种高毒力克隆,主要与新生儿的侵袭性疾病有关;CC19可引起新生儿或成人的侵袭性疾病[10]。最近的研究结果表明,母体或新生儿定植的菌株中,CC1、CC19和CC23的分离比例非常高[10]。研究结果表明,CC17是荚膜型别(CT)Ⅲ的同质克隆复合体,不同的CC表达的荚膜型别不一致[8-10]。多糖荚膜是GBS最重要的毒力因子,基于表面多糖结构的差异,研究者已将其分为10种CT(Ⅰa、Ⅰb、Ⅱ—Ⅸ),被称为10种血清型[8-10]。由于西部地区研究新生儿GBS定植的调查报道较少,因此,本研究旨在分析柳州地区新生儿定植的GBS菌株对抗菌药物的敏感性、血清分型和分子特征。
1 资料与方法
1.1 研究人群和样本收集
本研究对日常监测样本进行采样。凡是2015年1月至2020年4月在柳州市妇幼保健院出生的新生儿,在母亲采集样本进行GBS分析的情况下,对娩出的新生儿出生后立即用无菌取样器涂抹耳朵、口腔和脐带后放置运送培养基送检。上述样本监测和采集的过程,获得柳州市妇幼保健院伦理委员会的批准(批件号为20170010)。
1.2 GBS的分离鉴定
取出采样拭子,将其接种于GBS鉴定显色平板(郑州安图生物工程股份有限公司)中,5%CO2、37 ℃下培养18~24 h,挑选粉色、紫色、红色等可疑阳性菌落进行革兰染色、形态学和过氧化氢酶等鉴定,再进行CAMP试验,观察溶血模式,确定分离株为GBS。
1.3 药物敏感试验和耐药基因检测
使用K-B纸片扩散法进行药物敏感试验,折点和抗菌药物纸片的选择基于美国临床与实验室标准化委员会提出的标准执行。对以下抗菌药物进行药物敏感试验,包括青霉素、头孢曲松、左氧氟沙星、克林霉素、红霉素、氯霉素、利奈唑胺和万古霉素。多重耐药的判定标准为菌株对≥3种不同型别的抗菌药物产生耐药。此外,聚合酶链式反应(polymerase chain reaction,PCR)方法用于检测四环素耐药基因(tetM、tetO、tetL、tetK、tetT和tetS)、大环内酯类耐药基因(ermA、ermB、ermTR和mefA/E)和林可酰胺类耐药基因(linB)[11]。
1.4 GBS的分子特征分析
采用MLST方法对GBS的7个管家基因进行测序后,将测序结果通过MLST的数据库(http://eburst.mlst.net)查询得出序列分型(sequence type,ST)和等位基因。使用网站自带程序eBURST确定特定ST的CC,单ST指未能聚集成CC的ST。使用PCR方法对GBS携带的10种血清型别进行鉴定,并对GBS的毒力基因,如黏附相关基因(scpB)、入侵相关基因(hlyB)和alp表面定位蛋白抗原基因(alphaC、rib、epsilon、alp2/3和alp4)进行分型分析,所有的鉴定参照相关文献[11]中方法进行处理。
1.5 统计学方法
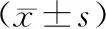
2 结果
2.1 新生儿GBS定植的临床特征
新生儿平均住院时间为(7.18±11.89)d。共检出50株GBS,其中,男性新生儿检出28株(占56.0%);初产分娩新生儿检出26株(占52.0%);顺产新生儿检出19株(占18.0%);发生肺炎、窒息的新生儿分别检出16、4株(分别占32.0%、8.0%),见表1。

表1 新生儿GBS定植的临床特征Tab 1 Clinical characteristics of neonatal GBS colonization
2.2 新生儿GBS菌株的血清型与耐药、毒力基因之间的关系
50例GBS菌株中,80.0%的菌株呈现多重耐药性;所有GBS菌株均对青霉素、头孢曲松、利奈唑胺和万古霉素敏感,均对红霉素和克林霉素耐药;60.0%的菌株同时携带红霉素和四环素的耐药基因,主要的耐药基因为ermA和tetM;GBS菌株的血清型主要为Ⅰa型(21株,占42.0%)、Ⅲ型(21株,占42.0%)和Ⅰb型(8株,占16.0%);所有的菌株均携带毒力基因scpB和hlyB。不同血清型携带的基因不一致,例如,血清型Ⅰa型菌株中,携带耐药基因tetT的菌株数所占比例最高(8株,占38.1%)(P=0.005);血清型Ⅲ型菌株中,携带alp表面定位蛋白抗原基因rib的菌株数所占比例最高(14株,占66.7%)(P<0.001);血清型Ⅰa型菌株中携带alphaC的菌株数所占比例远高于血清型Ⅰb型和Ⅲ型,差异有统计学意义(P<0.001)。新生儿GBS菌株的血清型与耐药、毒力基因之间的关系见表2。
2.3 新生儿GBS菌株克隆型、血清型和耐药基因、毒力基因的特征
50株GBS菌株中,最常见的基因序列类型为ST12型(15株,占30.0%)、ST19型(10株,占20.0%)、ST17型(9株,占18.0%)和ST23型(5株,占10.0%)。ST17型和ST19型主要与血清型Ⅲ型有关,对四环素、红霉素和克林霉素耐药,携带有耐药基因tetM和ermA,毒力基因rib;ST12型和ST23型主要与血清型Ⅰa型有关,携带有耐药基因tetM和ermA,毒力基因alphaC和epsilon。新生儿GBS菌株克隆型、血清型和耐药基因、毒力基因的特征见表3。
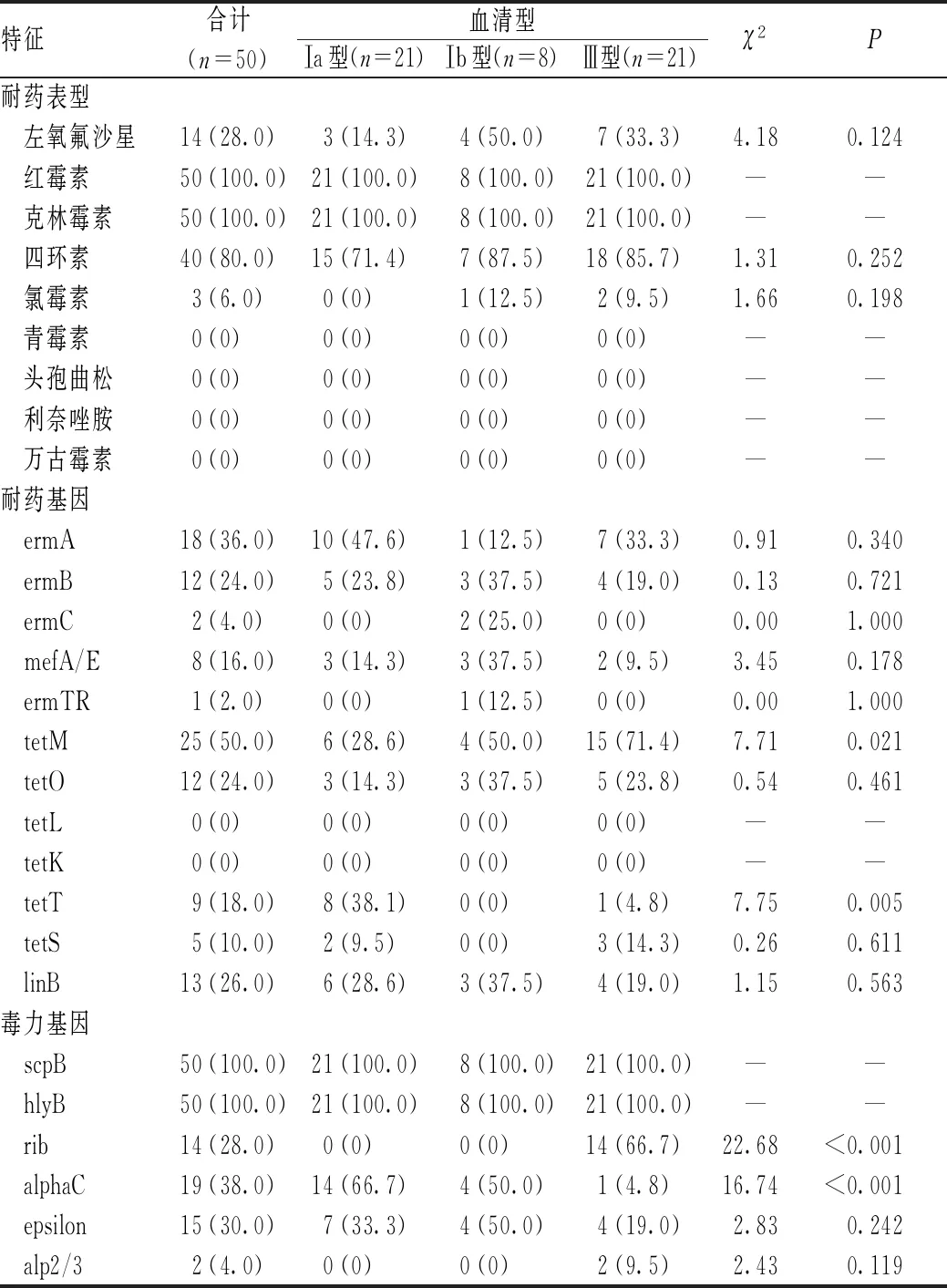
表2 新生儿GBS菌株的血清型与耐药、毒力基因之间的关系Tab 2 Correlation between drug resistance, virulence gene and serotypes of neonatal GBS strains
3 讨论
青霉素是推荐用于预防和治疗GBS疾病的一线药物。本研究中,所有GBS分离株均对青霉素敏感,这表明青霉素仍是预防用药的首选,与最新的荟萃分析结果相似[12]。指南推荐,若对青霉素过敏,建议使用红霉素和克林霉素作为替代药物。但本研究结果显示,所有的50株GBS菌株均对红霉素和克林霉素耐药,与以往的研究结果相似[13]。此外,最新的荟萃分析结果亦表明,亚洲国家分离的GBS菌株对红霉素和克林霉素的耐药率高于非亚洲国家[12]。上述研究结果表明,使用抗菌药物对新生儿进行预防性用药时,需要在药物敏感试验结果的指导下进行,尤其是对于青霉素过敏的新生儿。本研究中,80.0%的GBS菌株呈现多重耐药性,主要对红霉素、克林霉素和四环素耐药。与本研究结果类似的一篇来自中国新生儿侵袭性GBS菌株研究结果显示,79.9%的菌株呈现多重耐药性,主要对红霉素、克林霉素和四环素耐药[14]。上述结果凸显了临床实验室持续监测GBS菌株对抗菌药物耐药性的重要性。
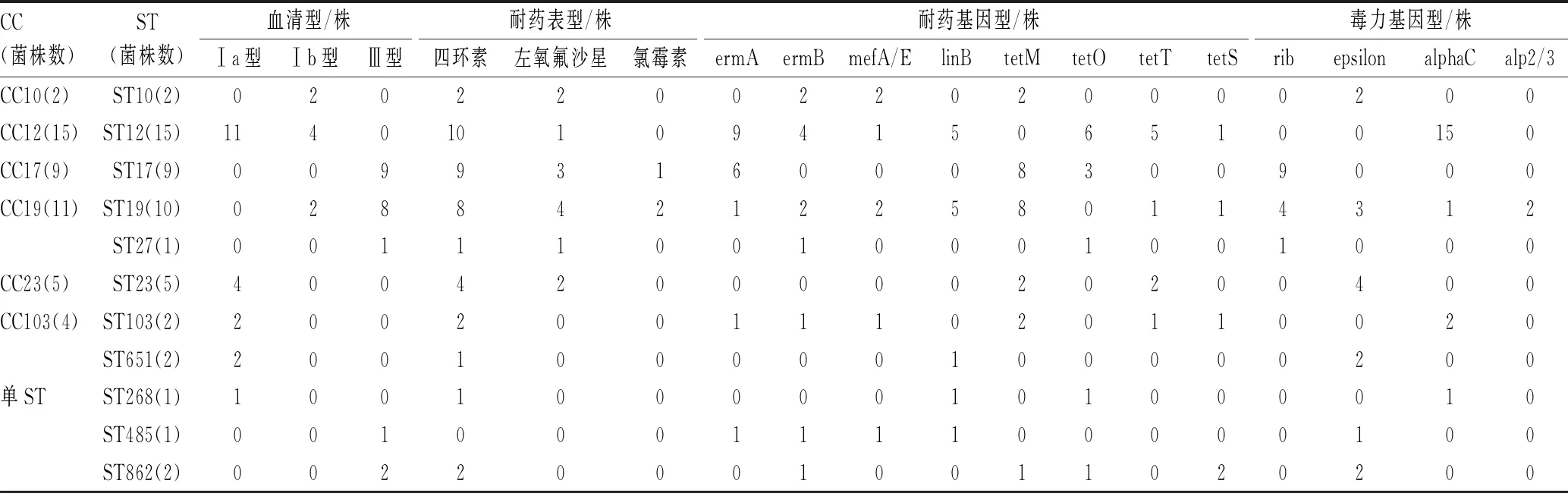
表3 新生儿GBS菌株克隆型、血清型和耐药基因、毒力基因的特征Tab 3 Characteristics of clonotype, serotype, drug resistance gene and virulence gene of neonatal GBS isolates
较少有研究报道GBS菌株的耐药机制。erm基因是主要的大环内酯类耐药基因,通过甲基化修饰核糖体并抑制红霉素结合,达到对红霉素耐药的目的,而mef基因编码充当药物外排泵的膜蛋白,将抗菌药物往外排。本研究中,8株GBS菌株同时携带ermB、ermA和(或)mefA/E,表明GBS对红霉素的耐药性主要通过上述2种机制介导。链球菌中四环素的耐药性主要是由tetM、tetO或tetT基因编码的核糖体保护蛋白介导的,由tetK或tetL基因编码介导的外排机制相对罕见[15]。本研究结果与之类似,有70.0%的菌株至少携带1种上述耐药基因。最为重要的是,60.0%的菌株同时携带红霉素和四环素耐药基因,主要的耐药基因为ermA和tetM。上述耐药基因的存在可能是耐药基因水平转移的结果,未来的研究必须更多地关注GBS菌株对抗菌药物耐药的遗传机制。
已有研究报道,可通过研究开发针对GBS血清型的疫苗对GBS疾病进行预防。疫苗的研发取决于人群监测中GBS血清型分布的准确数据。本项针对新生儿群体的研究数据显示,42.0%的血清型集中在Ⅰa型,另外42.0%的血清型集中在Ⅲ型,16.0%血清型为Ⅰb型,与广州市新生儿GBS菌株的分子特征相似[16]。目前正在进行的临床试验为三价(Ⅰa型、Ⅰb型和Ⅲ型)GBS疫苗[11],在不久的将来,按照现在的监测数据,若能在我国投放使用,将能很好地覆盖新生儿人群。但也有研究结果显示,在不同的国家,流行的主要血清型别不一致,如在韩国主要流行的血清型为Ⅲ型和Ⅴ型[17]。上述研究结果显示,不同的国家,由于地理位置、种族、人群不一致,GBS的血清型分布亦存在时间、空间和人群的差异性[18-21]。未来仍需继续对妊娠期、围产期妇女和新生儿定植和感染的GBS菌株进行持续性监测,以方便获取GBS的遗传背景和血清学信息,用于下一步疫苗的研制。
本研究从50株GBS定植菌株中分离鉴定出11种ST,其中最常见的ST为ST12、ST19、ST17和ST23,占全部菌株的78.0%。本研究共鉴定出6种CC,分别为CC10、CC12、CC17、CC19、CC23和CC103,其也是全球最常见的CC。已有研究结果认为,ST19/Ⅲ与定植有关,而ST17/Ⅲ主要与侵袭性感染有关[11]。在致病菌株中,最常见的CC是CC17,其对应的血清型为Ⅲ型。据报道,由于其高致病性和毒力,CC17最常引起新生儿脑膜炎,尤其是免疫系统尚未成熟的婴幼儿。在新生儿侵袭性感染的发生和发展过程中,CC17菌株通过特殊的毒力机制增强了GBS的致病性和侵袭性,这是>80%的患儿发生脑膜炎的主要原因[10]。CC17定植是新生儿GBS感染的主要危险因素[16]。荷兰的一项研究结果发现,1987—2011年,GBS感染发生率升高的主要原因是CC17的流行率升高[22]。本研究中发现9株ST17菌株,属于定植菌株而非感染菌株。CC17和CC19是GBS血清型Ⅲ型最常见的重要基因谱系,因此,Ⅲ型可能是导致婴儿GBS定植的最常见血清型。此前的研究结果显示,尽管进行了产前抗菌药物预防性用药,血清型Ⅲ型的ST17和ST19克隆在产后8周仍可检测出来[23],可以部分解释为何产前进行了抗菌药物预防性用药,仍有部分菌株可引起新生儿的侵袭性感染。
此外,本研究结果显示,在GBS菌株中存在着特定的血清型-遗传背景-毒力基因-耐药基因的组合,如ST17-Ⅲ型-ermA-rib,ST19-Ⅲ型-linB-tetM-rib-epsilon和ST12-Ⅰa型/Ⅰb型-ermA-linB-alphaC等。值得注意的是,本研究中发现,GBS毒力基因rib和alphaC存在于特定的克隆和血清型菌株中,如alphaC仅存在于ST12菌株中,而所有ST12菌株的血清型均为Ⅰ型(Ⅰa型和Ⅰb型)。rib仅存在CC17和CC19中,这2个克隆均属于血清型Ⅲ型。上述研究结果提示,在调查GBS的分子特征时,需要综合考虑GBS的特定蛋白,以便发现新的流行病学趋势,并在以后的疫苗研发中加以考虑和应用。
综上所述,本研究运用多种方法鉴定了新生儿定植性GBS菌株的耐药表型、耐药基因型、血清型、毒力基因和遗传背景分析,并发现GBS的遗传背景具有一定的特异性,凸显了在以后的研究中仍需对日常监测发现的GBS菌株加以鉴定分析,以期发现新的流行病学趋势,并在日后研发多价GBS疫苗中加以考虑和应用。此外,本研究发现,从新生儿群体中分离的GBS菌株呈现多重耐药性,凸显了日后持续监测GBS耐药性的重要性。

