驱动蛋白分子KIF18A的结构与功能研究进展
朱长军 ,周之春
(1.天津师范大学生命科学学院,天津 300387;2.天津师范大学分子细胞系统生物学重点实验室,天津300387;3.天津师范大学天津市动植物抗性重点实验室,天津 300387)
细胞分裂是生命个体存活、生长以及物种繁衍的基础,是母细胞分裂成子细胞的过程.有丝分裂是最主要的真核细胞分裂方式.有丝分裂过程中,纺锤体微管的精准调控、微管与动粒的附着(KT-MT attachment)是染色体整列(chromosome alignment)和中板集合的核心[1-2].细胞在有丝分裂前中期(prometaphase),高度动态不稳定的动粒微管能够有效捕获染色体[3],牵引着染色体向赤道板聚集整列.有丝分裂中期,动粒微管协助染色体整齐地排列在纺锤体中间区域(亦称染色体中板集合),纺锤体组装检验点(spindle assembly checkpoint,SAC)严格监控染色体的中板集合过程.有丝分裂后期,SAC失活,姐妹染色单体彼此分离并移向纺锤体两极,最终进入2个子细胞中.
驱动蛋白分子是以微管为轨道的马达蛋白,在细胞器迁移、组织器官发育、信号传导、有丝分裂、减数分裂等过程中发挥了重要作用.驱动蛋白kinesin-8家族的多种微管结合蛋白(microtubule-associated protein,MAP)通过影响微管的聚合和解聚行使着调控微管动态不稳定性的功能.KIF18A是kinesin-8家族的一员,能够以微管为轨道向正极运动,倾向于结合较长的微管,其活性具有长度依赖性并影响着纺锤体的长度,可保障姐妹染色体整列的及时顺利完成[4-6].本文就KIF18A的蛋白结构、细胞内定位及其在有丝分裂过程中的调控作用等加以综述.
1 KIF18A基因和蛋白分子的结构与功能
1.1 KIF18A基因及其蛋白结构
2005年,Luboshits等[7]在人的骨髓间充质干细胞表达文库中克隆出了MS-KIF18A,它在人体的睾丸和气管中均有表达.该基因属于kinesin-8家族,定位于人类染色体11p14,包含17个外显子,基因全长约87.57kb,开放阅读框(open reading frame,ORF)2 697 bp,编码898个氨基酸,蛋白相对分子质量约为102×103.MSKIF18A的蛋白分子功能域如图1所示.
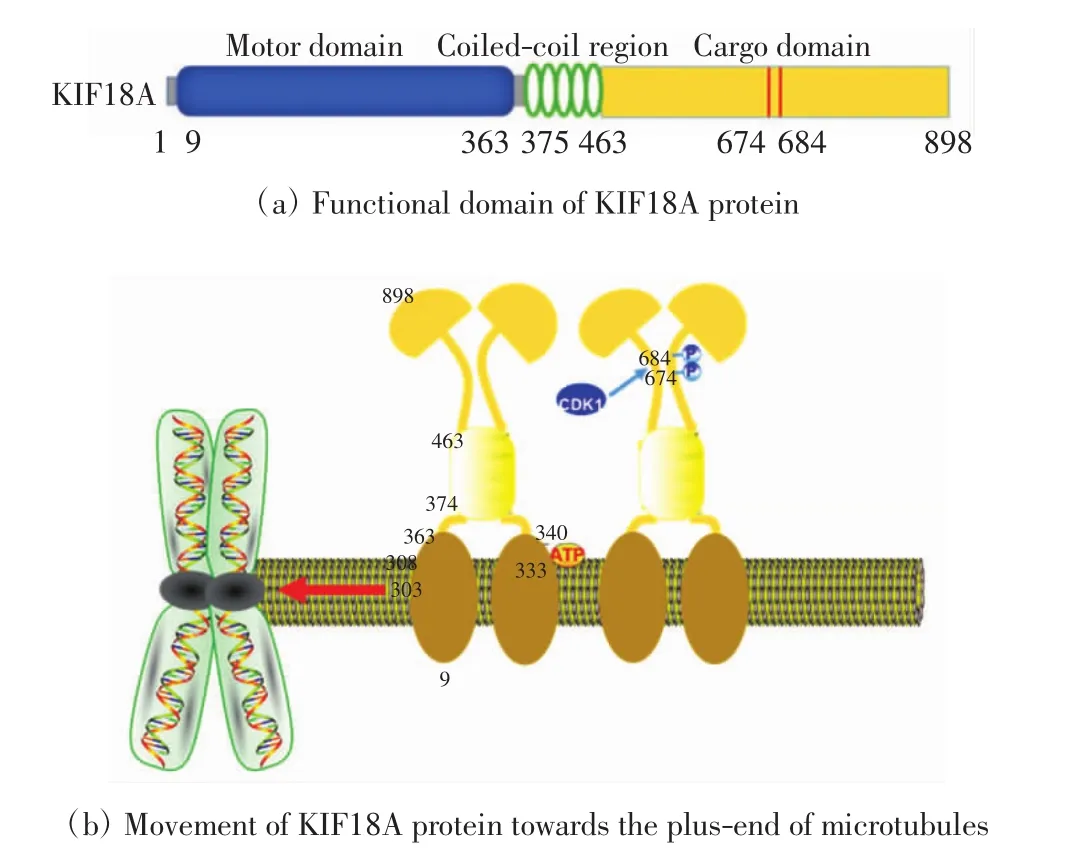
图1 KIF18A蛋白分子的结构和运动Fig.1 Structure and movement of KIF18A protein
MS-KIF18A的功能域包括:N端球形的马达结构域(motor domain),位于氨基酸序列N9到N363,其中ATP结合催化结构域为N333~N340,微管结合位点结构域为N304~N308,赋予其靶向微管正极的运动能力及类似微管解聚酶的活性;中央卷曲螺旋结构域(helical coiled-coil domain),位于氨基酸序列N375到N463,主要由α-螺旋形成同源二聚体;C端扇形的尾部结构域(tail domain),位于氨基酸序列N464到N898,具有微管结合位点,可调控KIF18A蛋白功能,使其能够稳定运动到微管正极末端并聚集[8-9],同时也含有多个蛋白激酶作用的保守序列.在N端和杆状区之间有一段Neck铰链区域,位于氨基酸序列N364到N374,与驱动蛋白13家族的微管解聚酶结构域序列一致,Neck铰链的长度保障了KIF18A在微管上的运动和穿过微管结合蛋白障碍物的能力[10].KIF18A蛋白以二聚体形式在微管上向微管正极末端运动,细胞周期依赖性激酶1(CDK1)可对其674和684位点的丝氨酸进行磷酸化修饰.
KIF18A蛋白在多个物种中均有表达.应用TCOFFEE和MEGA7.0软件对不同种属间的KIF18A蛋白进行序列比对和进化树分析,结果分别如图2和图3所示.由图2和图3可以看出,Kif18A蛋白家族的分子结构在不同物种中非常保守,特别是该蛋白分子的马达结构域.这些现象预示该蛋白分子在生命进化过程中调控细胞的基本生命活动:一方面,该蛋白分子的功能与生命进化过程中细胞的基本功能密切相关;另一方面,该蛋白分子在不同物种中的功能应该非常相似,具有保守性.因此,人们可以使用多种模式生物,如酵母、果蝇、非州瓜蟾等研究KIF18A蛋白分子的功能及其应用,还可以应用小鼠等动物模型为以Kif18A蛋白为靶点的药物开发提供前期实验指导.
1.2 KIF18A基因的转录
KIF18A与雌激素受体ERɑ在体外和体内均可结合,雌激素水平较高的细胞中KIF18A在mRNA水平和蛋白水平上都有所增加.KIF18A基因的转录可通过转录因子雌激素受体ERα被雌激素激活,受雌激素正调节[11-13].应用染色质免疫沉淀实验和荧光素酶报告系统检测发现,这些细胞中转录因子ERα和c-Jun均可以结合并活化KIF18A基因的启动子,如图4所示,ERα是负责KIF18A基因转录的主要转录因子[11].KIF18A的启动子区有多个转录因子结合位点,在ERɑ缺失细胞中是否存在其他转录因子与KIF18A启动子结合调控KIF18A基因的转录,还有待深入研究.
1.3 KIF18A蛋白分子的细胞内定位
KIF18A是细胞周期特定时期的表达蛋白[4]:G1期细胞内KIF18A的表达极低,G2/M期KIF18A表达明显提高.在间期细胞(interphase)中,由于C端存在核定位序列,因此KIF18A主要位于细胞核内且与微管正极结合蛋白(End-Binding 1,EB1)共定位,即定位于微管正极末端.在有丝分裂前中期和中期细胞中,KIF18A主要定位在微管正极末端和动粒外板间,也可在纺锤体微管和星体微管检测到KIF18A染色.后期和末期细胞中,KIF18A蛋白转移至纺锤体中央区(spindle midzone)和中小体(midbody),少量定位在纺锤体和星体微管正极末端[14].KIF18A蛋白分子的马达区和尾区均有微管结合的功能区,尾区含核定位序列.马达区和杆状区共同作用才能使该蛋白在有丝分裂末期定位于中体.KIF18A蛋白分子在细胞内的定位还可能受蛋白翻译后修饰如磷酸化修饰等的调控.

图2 不同物种间KIF18A蛋白分子序列的比对Fig.2 Sequence alignment of KIF18A proteins among different species
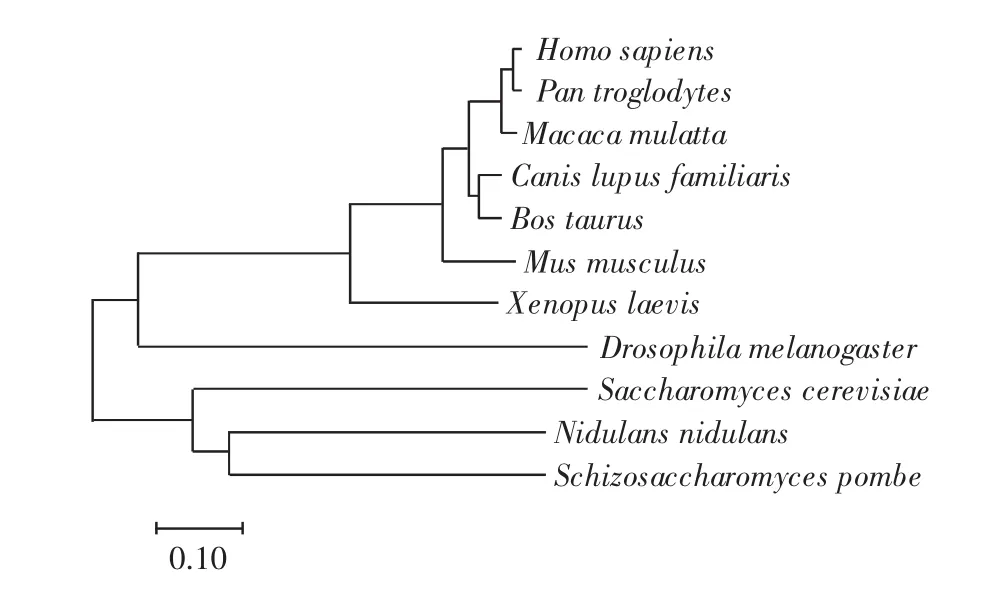
图3 KIF18A蛋白家族在不同物种中的进化分析Fig.3 Evolutionary analysis of KIF18A protein family in different species
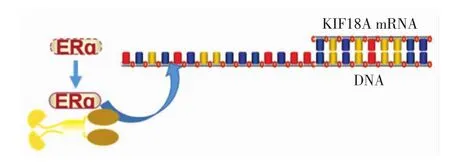
图4 KIF18A和雌激素受体ERα相互结合激活KIF18A基因的转录Fig.4 Interaction between KIF18A and ERα(estrogen receptor)and activativation on the transcription of KIF18A gene
1.4 KIF18A蛋白分子的功能
1.4.1 KIF18A的运动功能(motor activity)
KIF18A的马达结构域位于N端,在C端存在微管结合位点.KIF18A的运动以微管为轨道,体外微管滑动实验(microtubule-gliding assay)结果发现,全长KIF18A可向微管正极运动[4,15],这表明KIF18A与其在果蝇和酵母中的直系同源物(Klp67A和Kip3)一样,均为靶向微管正极运动的马达蛋白[6].细胞中的KIF18A抗体免疫荧光染色结果表明:在有丝分裂早期,内源性KIF18A与动粒外板蛋白Hec1共定位;中期,外源GFPKIF18A与动粒(CREST)共定位.GFP-KIF18A-MD突变体(MD,motor dead,马达结构域突变失去马达活性)的免疫荧光染色结果显示,GFP-KIF18A-MD沿纺锤体微管弥散分布,不与动粒共定位,这说明KIF18A依赖其N端的马达结构域在微管上向正极滑动并最终定位到动粒微管末端[5].
1.4.2 KIF18A的微管解聚酶活性(depolymerase activity)
KIF18A在酵母中的直系同系物kinesin-8家族成员kip3能够以长度依赖方式发挥微管解聚酶的活性[6].在人的HeLa细胞中,应用小分子RNA干扰KIF18A的表达后细胞内微管的稳定性明显升高,抑制了冷诱导的微管解聚[4].纯化的KIF18A蛋白在体外实验中能够以ATP依赖的方式直接解聚微管,且对长微管的解聚能力明显高于短微管[4].关于KIF18A的微管解聚酶活性尚有争议.Du等[15]报道KIF18A是通过抑制微管蛋白在正极的聚合从而抑制微管伸长,并非直接解聚微管.在微管动态不稳定性中,KIF18A并不影响灾变(catastrophe)的频率,但会使修复(rescue)的频率增加,进而使得整体的停滞时间延长.因此KIF18A可能通过两种方式抑制微管正极的动态不稳定性:解聚微管或阻止新的微管蛋白组装[16].
2 KIF18A的生物学作用及其调控机制
2.1 KIF18A在有丝分裂中的作用
KIF18A利用N端含有的ATP结合位点,依靠水解ATP供能在微管上运动并运送与其C端结合的货物.通过与定位在生长微管正极末端的EB1蛋白进行共定位研究,确定KIF18A是一个正极朝向的驱动蛋白[17].KIF18A在细胞周期中的表达具有特异性,在G1期表达较低,在G2/M期表达量升高[4],这表明KIF18A主要在细胞有丝分裂期发挥功能.如图5所示,KIF18A可促进染色体排列到赤道板上,为后续姐妹染色单体的精确分离做准备,保证细胞有丝分裂的正常进行[4-5,17-20].
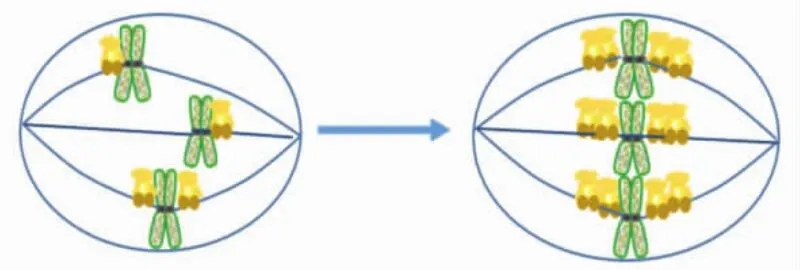
图5 KIF18A在有丝分裂早期促进姐妹染色体的中板集合Fig.5 KIF18A promotes congression of sister chromosomes in early mitosis
抑制细胞内KIF18A的表达会导致姐妹染色单体移动速率加快,动粒振幅(oscillation amplitude)增大,染色体转向频率(switch rate)降低,同时动粒内部间距(inter-kinetochore distance,IKD)增大,张力降低,纺锤体变形(拉长形成香蕉形纺锤体)[4].细胞转染过表达GFP-KIF18A融合蛋白后的染色结果显示纺锤体缩短,动粒内部间距变小,染色体振幅降低,染色体震动频率降低[6].这些现象说明KIF18A可降低染色体的振动频率,缩短动粒振幅,促进染色体转向,抑制纺锤体延伸,降低纺锤体的动态不稳定性,而这些作用都依赖于KIF18A蛋白具有的马达活性.
有丝分裂后期细胞中单个核的形成也需要KIF18A发挥正常功能.Fonseca等[21]发现,依赖KIF18A的中期染色体排列使染色体到达极的距离相等,KIF18A缺失细胞中的落后染色体在后期移动距离则较长.KIF18A缺失会导致间期细胞核组织缺陷,后期核形态异常,末期核纤层蛋白分布失常,p53依赖性检验点则能够抑制形成微核的KIF18A缺陷细胞进行分裂[21].
利用KIF18A的小分子化合物抑制剂BTB-1处理细胞时,也可观察到“香蕉状”纺锤体,因此认为KIF18A对于纺锤体形态的维持具有重要作用[22].抑制KIF18A的表达或功能可将细胞阻滞于有丝分裂早期,并激活细胞有丝分裂纺锤体检验点.在缺失KIF18A的细胞中,对Mad2的染色定位表明,染色体未正确连接微管时SAC检验点会被激活.Zhu等[17]、Janssen等[23]研究发现,细胞缺失KIF18A会导致微管与动粒正常连接处动粒之间的张力异常,从而激活有丝分裂纺锤体检验点,进而影响细胞的有丝分裂进程.
2.2 KIF18A对精子发育的作用
KIF18A对于细胞分裂过程中正常的染色体分离是必不可少的.Liu等[24]研究发现,KIF18A功能缺失会引起微管动力学、纺锤体完整性和检验点激活的严重缺陷,从而导致小鼠发生性细胞再生障碍.敲除KIF18A基因表达可导致雄性小鼠完全不育,但雌性小鼠没有受到影响.组织学检验结果显示,KIF18A-/-小鼠的睾丸生精小管发育严重受损,从而导致小鼠睾丸萎缩,在有丝分裂和减数分裂过程中造成染色体重组缺陷.进一步研究表明,KIF18A基因沉默会导致CENP-E和BubR1降解并伴随着姐妹染色单体的过早分离.这说明KIF18A与BubR1和CENP-E能够在生理上相互作用并在有丝分裂过程中被调节.
Czechanski等[20]研究发现,生殖细胞缺陷 2(gcd2)突变小鼠在胚胎发育过程中出现生殖细胞缺失从而导致不育,这是KIF18A的马达结构域中R308K的错意突变造成的结果.KIF18A缺失会导致染色体排列缺陷,体细胞还可进行有丝分裂,而生殖细胞则会发生有丝分裂停滞和凋亡,这表明KIF18A是生殖细胞中细胞周期进展所必需的基因之一.
2.3 KIF18A生物学作用的调控机制
2.3.1 蛋白结构功能域对KIF18A功能的调控
KIF18A在有丝分裂间期主要定位于细胞核内,有丝分裂期沿纺锤体微管运动到动粒微管正极末端与动粒外板之间.Stumpff等[25]对野生型KIF18A进行截短突变实验,发现仅N端结构域截短的突变体沿纺锤体微管分布,不能与动粒共定位;仅C端结构域截短的突变体可稳定结合微管,并能定位在细胞核内.两种截短突变体都失去了调控纺锤体长度和染色体中板集合的功能,说明KIF18A的N端和C端均具有微管结合区,并且KIF18A在动粒的准确定位是其功能发挥的必要条件[8-9,25].KIF18A的N端截短突变(aa1-406)在体外的运动速率是全长野生型KIF18A的2.5倍,C端尾部截短则可减缓KIF18A的移动速率.进一步研究发现,C端尾部可通过静电作用与微管结合,抑制KIF18A从微管解离,但KIF18A向微管正极运动以及对于微管动态不稳定性的调控仍然依赖N端[9,25].此外,Kim等[26]应用KIF18A尾部结构域与其他驱动蛋白(KIF4A、KIF5B)的马达结构域构建融合蛋白发现,KIF18A在微管正极末端的定位及其对微管长度的调控不仅依赖尾部结构域,其马达区的Loop2结构也发挥了关键作用.总之,KIF18A的功能发挥需要它的正确定位和分子马达的活性,而其恰当定位又依赖于C端尾部与微管的结合以及N端马达结构域的运动功能.2.3.2 蛋白翻译后修饰对KIF18A功能的调控
KIF18A功能的发挥也受到翻译后修饰的调控.细胞周期依赖激酶 1(cyclin-dependent kinase-1,CDK1)能够催化KIF18A的Ser674与Ser684位点发生磷酸化.CDK1对KIF18A进行磷酸化后,动粒的振幅增加,这与敲除KIF18A的结果相似.细胞中转入外源模拟磷酸化KIF18A后,磷酸化状态的KIF18A无法运动到动粒微管末端并聚集,而是定位在微管网架上,因此磷酸化作用很可能会使KIF18A无法定位到微管末端,从而无法发挥降低微管动态不稳定性的功能,使得动粒振幅增大.Höfner等[27]通过活细胞成像实验发现,KIF18A的CDK1磷酸化修饰并不会影响姐妹染色单体的中板集合(congression)时间,但延迟了中板变薄(thin metaphase plate,tMP)的时间,推测是 CDK1的磷酸化修饰影响了KIF18A的运动能力,进而影响了形成tMP的时间.De Wever等[28]发现蛋白磷酸化酶(PP1,protein phosphatase-1)可以特异性地结合并去磷酸化KIF18A,与蛋白激酶CDK1的作用相互拮抗,二者可共同调控KIF18A促进染色体整列和中板集合的活性.除CDK1外,KIF18A还与许多有丝分裂蛋白激酶具有共定位,如Aurora A、Aurora B、PLK1、Mad2 和MSP10等,这些蛋白激酶是否也参与磷酸化修饰并调节KIF18A的定位和功能尚不清楚.
KIF18A是细胞G2/M期特异性表达的蛋白分子,这预示着它在有丝分裂后期极有可能发生蛋白分子降解.Yang等[29]研究发现,KIF18A可被SUMO2共价修饰,虽然该修饰不影响KIF18A的蛋白稳定性和胞内定位,但非SUMO2化突变体会引起细胞周期阻滞,使得细胞无法离开有丝分裂期.KIF18A还是APC/C(the anaphase promotingcomplex/cyclosome)-Cdc20 的底物,如图6所示,APC/C可以结合KIF18A的C端LR结构域(在453~653之间),在有丝分裂后期促使KIF18A降解[30].这些结果显示,KIF18A的蛋白降解对于细胞有丝分裂与胞质分裂的顺利进行和完成至关重要.
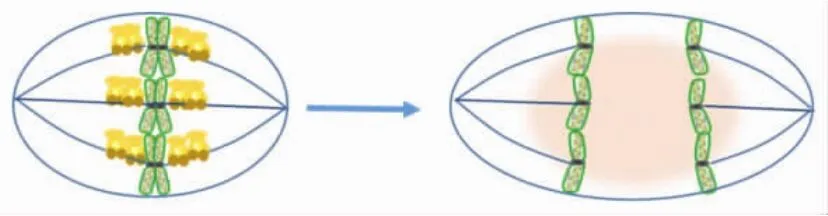
图6 KIF18A在有丝分裂后期被降解Fig.6 Degradation of KIF18A at anaphase in late mitosis
2.3.3 生物大分子对KIF18A功能的调控
Ye等[31]研究发现,KIF18A可与多种蛋白分子相互作用,这对于KIF18A及其结合蛋白功能的正常发挥非常重要.如肝癌上调蛋白(hepatoma upregulated protein,HURP)可与KIF18A直接结合,促进KIF18A蛋白翻转(turnover),抑制KIF18A向微管正极运动的能力,从而增加微管的稳定性.Huang等[32]的免疫共沉淀实验结果表明,有丝分裂期的细胞中,KIF18A能够与微管正极结合马达蛋白CENP-E和有丝分裂检验点蛋白BubR1结合,同时KIF18A能够提高CENP-E蛋白的稳定性,促进CENP-E在动粒处的定位,稳定动粒微管与染色体的结合.如图7所示,微管结合蛋白KBP也可以结合KIF18A并抑制其活性.KBP能够阻止KIF18A和KIF15的催化结构域与微管晶格相互作用,从而阻断它们的活性.中期细胞中KBP过表达会抑制染色体的正常排列,降低纺锤体的长度,破坏纺锤体的双极性,这些作用与KIF18A和KIF15的功能抑制是一致的.Malaby等[33]通过研究KBP过表达对KIF18A和KIF15定位的影响,也证实了KBP会干扰马达蛋白之间的相互作用.
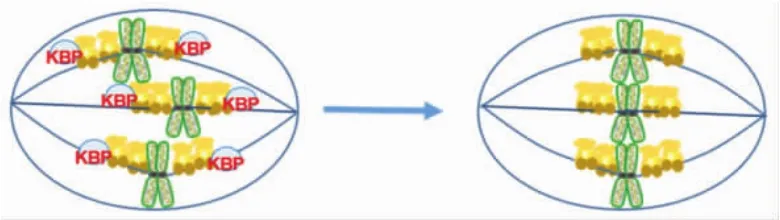
图7 微管结合蛋白KBP与KIF18A相互作用并抑制KIF18A功能Fig.7 Microtubule binding protein KBP binds KIF18A and inhibits its function in early mitosis
Manning等[34]使用siRNA干涉细胞内源KIF18A后抑制了Astrin(aster-associated protein)在动粒处的定位,说明KIF18A可能在一定程度上通过促进Astrin在动粒的定位稳定KT-MT附着,进而调控染色体的中板集合[34].KIF18A还与Kid(kinesin-10家族蛋白)共同促进了染色体在赤道面的定位,而KIF4(kinesin-4家族蛋白)则与Kid一起协助染色体的整列[35].
HEST(kinesin-14家族蛋白)是一种调控纺锤体微管交联与滑动的驱动蛋白.Weaver等[8]研究发现,干涉HEST会造成纺锤体缩短,同时干涉HEST与KIF18A则可以恢复由于KIF18A沉默引起的纺锤体异常延伸,这说明具有类似于解聚酶活性的KIF18A和具有滑动活性的微管结合蛋白HEST协作,可共同调控纺锤体微管的长度.
另外,KIF18A还参与调节Sirt2介导的微管蛋白的乙酰化.Tang等[36]研究发现,敲除KIF18A后卵母细胞减数分裂过程中乙酰化酶Sirt2的表达降低,乙酰化微管蛋白水平升高,最终导致纺锤体组织缺陷.微管蛋白K40R mRNA可诱导微管蛋白去乙酰化,保护卵母细胞免受KIF18A下调的影响,使得卵母细胞的纺锤体形态恢复正常.
3 KIF18A与肿瘤发生、发展的关系
KIF18A蛋白在多种肿瘤中均有高表达,包括肝细胞癌[37]、胶质母细胞瘤(Glioblastoma,GBM)[38]、乳腺癌[17]、肺癌[19]、胆管癌(CCA,cholangiocarcinoma)[39]、卵巢癌[40]、滑膜肉瘤(SynSa,Synovial sarcoma)[41]、横纹肌肉瘤(RMS,Rha-bdomyosarcoma)[42]、前列腺癌[43]等,这预示着KIF18A与肿瘤的发生、发展密切相关,可成为多种肿瘤分子诊断和治疗的靶标.
KIF18A的表达与临床大肠癌发展有关.结肠癌是一种常见的实体癌,近年来全球发病率逐年增加[44-45].目前结肠癌治疗的难点是预后,25%的结肠癌初发病人都有复发[46],复发后25%的病人出现转移[43,47].Nagahara等[48]对113例初期CRS手术病人进行调查研究,发现这些病人中的KIF18A均明显高表达,并与肿瘤分期、淋巴和血管迁移、淋巴转移、组织浸润相关,说明KIF18A与结肠癌的进展有关.Zhu等[49]、Zhong等[50]研究发现,KIF18A能够诱导Akt磷酸化,小鼠中敲除KIF18A可明显促进细胞凋亡,推测KIF18A能通过激活PI3K-Akt信号通路促进结直肠癌的发生发展.
KIF18A在人乳腺癌细胞中也高表达,且其过表达与乳腺肿瘤的分级、迁移和预后有关.Zhu等[17]、Alfarsi等[51]对乳腺癌细胞进行研究,发现过表达KIF18A会导致多核细胞的产生,低表达在体内外则均能大幅度减弱细胞增生能力,这是通过KIF18A在微管末端稳定微管以及PI3K-Akt信号转导途径的失活而诱导了细胞凋亡.Zhong等[50]、Li[52]等研究发现,肺腺癌中KIF18A在转录和翻译水平均上调,KIF18A的异常表达与临床病理恶性程度相关.在肺腺癌中能够观察到KIF18基因突变,其表达也受DNA拷贝数的调控,KIF18A基因敲除能够抑制肺腺癌细胞的体内和体外增殖,诱导细胞凋亡和G2/M期阻滞.与KIF18A同时高表达的基因都集中在细胞周期信号通路中,因此深入研究KIF18A在肺腺癌中的作用机制具有重要临床意义.
4 结论与展望
KIF18A是一个以微管为轨道向微管正极末端运动的分子马达蛋白,通过影响微管末端动态不稳定性调控染色体的中板集合,在有丝分裂期发挥功能.在有丝分裂后期,该蛋白被泛素化降解,保证有丝分裂过程中染色体的精确分离,促使有丝分裂及胞质分裂的顺利完成.有丝分裂早期,KIF18A在靠近动粒的微管正极末端定位是其功能发挥的必要条件,定位不仅依赖其N端的马达活性,具有微管结合能力的尾部结构域也起到关键作用.KIF18A还受到可逆的蛋白磷酸化/去磷酸化修饰,但该蛋白翻译后修饰如何调控KIF18A的功能尚缺乏系统研究.ERɑ可与KIF18A结合并促进其转录,但KIF18A是否还受其他转录因子的调控仍不清楚,因此KIF18A的基因转录调控机制研究尚待深入.在减数分裂过程中,缺少KIF18A的细胞将不能完成减数分裂,进而会导致雄性动物精子形成障碍和睾丸发育不良.在针对多种肿瘤的研究中都发现KIF18A与肿瘤的迁移、发生、发展、预后等有关,但其影响肿瘤迁移的机制尚不明确.鉴于KIF18A在肿瘤发生发展过程中的重要作用,以KIF18A为分子靶点探讨多种肿瘤的早期诊断和有效治疗将为不同肿瘤的诊疗提供新的思路和策略.

