Cd胁迫对2个耐Cd能力不同的小麦品种幼苗生长和生理特征的影响
张 欣,王英杰,豆昕桐,王华忠,岳洁瑜
(天津师范大学 天津市动植物抗性重点实验室,天津 300387)
金属镉(Cd)是农业土壤中毒性最大、分布最广泛的污染物之一.Cd在土壤中的移动性较强,且半衰期长,易被植物吸收积累[1].植物过量吸收Cd易造成植株矮化、叶片褪绿、根长变短、生物量降低[2-3].Cd在植物体内累积会导致植物体内的膜系统和抗氧化系统被破坏[4],亚细胞结构发生变化,阳离子(如钙、钾等)发生置换,进而影响金属离子的稳态[5].Cd胁迫还会抑制高等植物的光合作用[6].近年来,叶绿素荧光技术作为植物光合作用的探针,是研究植物逆境胁迫表型的有力工具之一.测定植物的叶绿素荧光参数能够对植物响应生物与非生物胁迫进行有效分析,加快作物耐性的鉴定与筛选[7].Cd对植物的光系统I(PSI)和光系统Ⅱ(PSⅡ)均有影响,对PSⅡ的抑制更为显著[8].植物遭受Cd胁迫时,叶绿素荧光参数的变化可以反映出Cd对光合作用的毒性效应[9].
Ca2+是一种胞内信号分子,在细胞内以结合态或游离态存在,主要分布于细胞核、内质网、线粒体、质膜及胞质中.逆境胁迫会使细胞中的活性氧过度积累,研究发现活性氧可以调节细胞质膜Ca2+通道的活性或开放程度,表明活性氧对Ca2+信号水平能起到调节作用[10].在植物细胞程序性死亡(PCD)过程中,特别是在细胞凋亡早期,Ca2+往往表现出急剧增加,由此认为Ca2+可能是启动PCD的早期信号[11].
小麦属于抗Cd能力较强和Cd积累型作物,幼苗阶段是其生活周期的起始阶段,对Cd胁迫较敏感.尽管已有学者从不同角度研究了Cd胁迫对小麦生理方面的影响,但不同小麦品种对Cd胁迫的吸收和耐性存在很大差异[2-3].合适的Cd浓度能够使各品种小麦幼苗的指标变异幅度和变异系数变大,可获得较好的鉴定分析效果[12].本课题组前期研究发现,不同浓度的Cd对13个小麦品种幼苗阶段的影响不尽相同,浓度为100 μmol/L的Cd能把13个小麦品种对Cd的耐性强弱区分开[13].因此,本研究以100μmol/L的Cd浓度为基准,设置 4 个 Cd 浓度(10、50、100、300 μmol/L),通过水培实验分别处理2个Cd适应性不同的小麦品种,研究幼苗阶段二者对不同浓度Cd胁迫响应的生理变化规律.研究一方面有助于加深理解作物对Cd胁迫的适应性;另一方面,可以为找到减少小麦Cd损伤的有效措施和提高Cd耐性水平的方法提供理论基础.
1 材料与方法
1.1 材料与培养
小麦品种河农6425(Henong 6425,Cd敏感型)和92R137(耐Cd型),种子均由天津市农业科学院提供.
取大小均匀一致、饱满、健康无损伤的小麦种子,清洗后放置于铺有2层湿润纱布的培养盆中,室温下蒸馏水培养,间隔12 h换1次水.小麦生长至一叶期时将蒸馏水替换成1/10 Hoagland营养液继续培养.待小麦幼苗长至一叶一心时,从中筛选出生长一致的麦苗,平均分成5组,分别移至Cd浓度为0(对照组)、10、50、100 和 300 μmol/L 的 1/10 Hoagland 营养液中培养,每3 d更换1次营养液.
1.2 生长形态的观察及生长指标测定
在Cd处理小麦幼苗期间,每天观察幼苗生长状况,每隔2 d测量1次生理指标.对照组和实验组每次均取15株幼苗测量株高、叶长以及最长根长.
1.3 幼苗中Cd含量的测定
Cd胁迫处理小麦幼苗14 d后,分别收获对照组和实验组幼苗的地上和地下部分.先后用自来水、蒸馏水和去离子水冲洗干净,晾干表面水分,分别称鲜重.108℃下杀青15 min后85℃烘干至恒重,分别称量干重后,研磨成粉末用于消化分析.消化前分别称取粉末0.2 g,浓硝酸消化后,用电感耦合等离子发射光谱法(ICP-AES)(Leeman Labs INC,New Hampshire,USA)测定Cd在幼苗地上和地下部分器官中的积累量.每个样品重复测3次.
1.4 叶绿素荧光特性的测定
利用双通道调制叶绿素荧光仪(Dual-PAM-100,上海泽泉科技股份有限公司)测量小麦叶片PSI和PSⅡ的活性变化,叶片暗适应20 min后测量相关荧光参数,包括Fv/Fm、YⅡ、qP 和Fv/F0.
1.5 Fluo-8AM检测小麦根细胞中Ca2+的分布
Fluo-8AM荧光指示剂能特异性地与细胞内的Ca2+结合,被一定波长的激发光激发后产生荧光,从而检测出细胞内Ca2+水平的变化.
具体操作:用100 mmol/L的Cd处理小麦幼苗.分别切取对照组和Cd处理组的小麦根尖1~2 cm,每个样本至少取5株幼苗,放入配置好的Fluo-8AM染色液中,4℃条件下避光孵育2 h.染色完成后,用0.2 mmol/L的CaCl2溶液漂洗3次,25℃条件下避光放置2 h.染色结束后,用正置荧光显微镜(Leica DM50003)在避光条件下进行观察并拍照.
1.6 数据处理与分析方法

采用Excel 2007和IBM SPSS Statistics 22.0软件进行数据处理.
2 结果与分析
2.1 不同浓度Cd胁迫对小麦幼苗生长的影响
用不同浓度的Cd溶液处理92R137和河农6425的小麦幼苗,每2 d测量1次小麦的生长指标,0~8 d内2个小麦品种株高、叶长和最长根长生长情况分别如表1、表2和表3所示,Cd处理14 d后小麦幼苗生长情况及变异系数如表4所示.
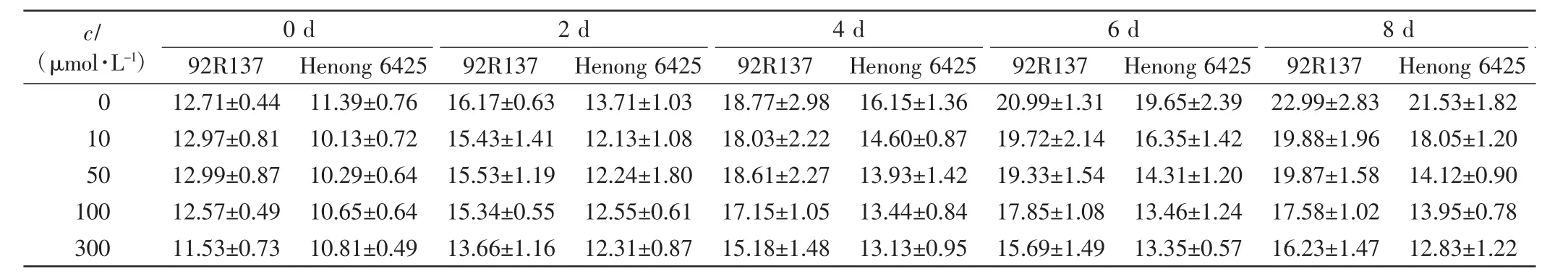
表1 不同浓度Cd处理下2个小麦品种幼苗的株高Tab.1 Seedling height of two wheat cultivars treated with different concentrations of Cd cm
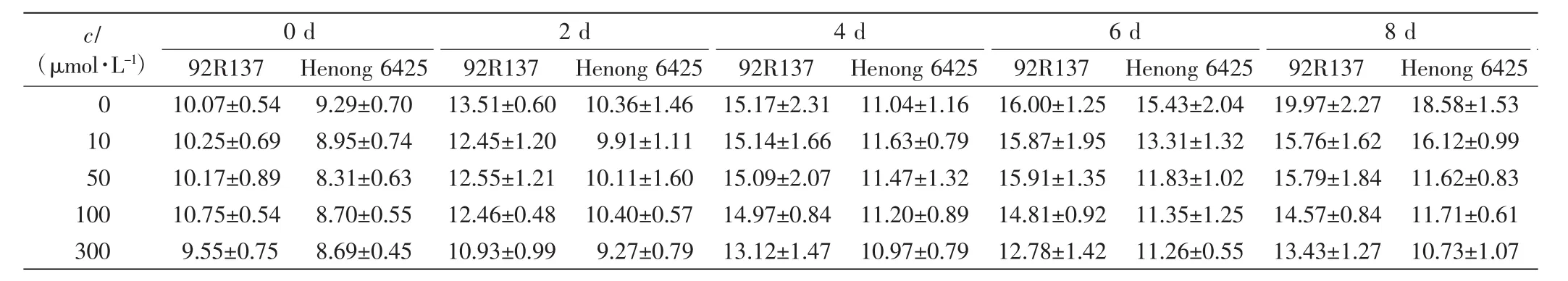
表2 不同浓度Cd处理下2个小麦品种幼苗的叶长Tab.2 Leaf length of two wheat cultivars treated with different concentrations of Cd cm
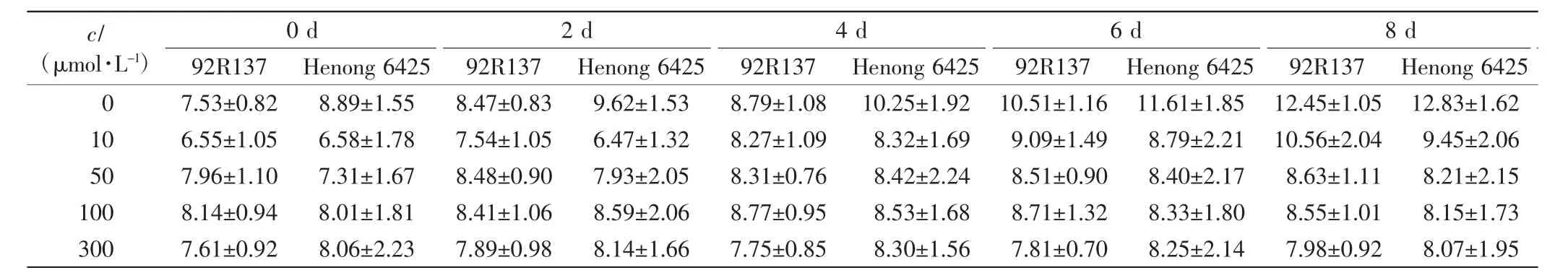
表3 不同浓度Cd处理下2个品种小麦幼苗的最长根长Tab.3 The longest root length of two wheat cultivars treated with different concentrations of Cd cm
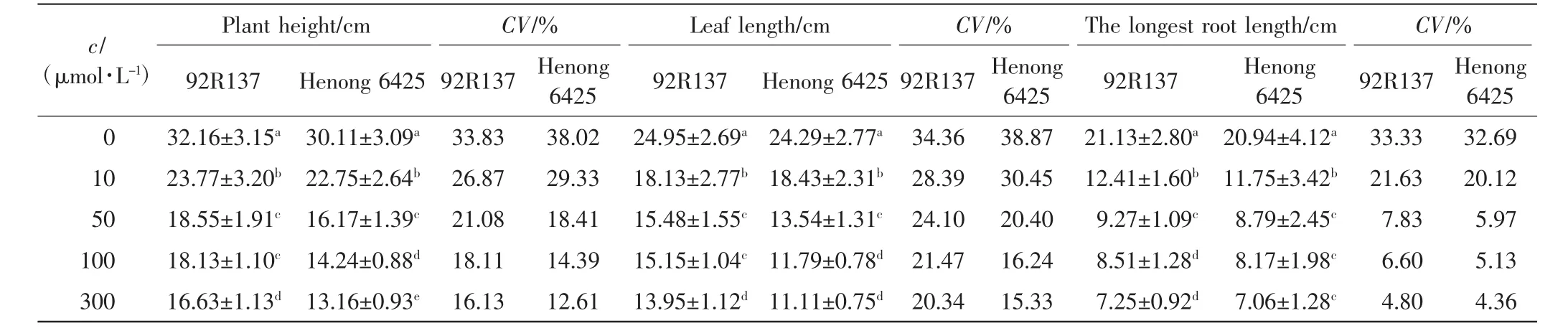
表4 不同浓度Cd处理14 d后小麦幼苗的生长情况及变异系数Tab.4 Growth of two wheat cultivars and coefficient of variation treated with different concentrations of Cd after 14 days
由表1、表2和表3可以看出,与对照组相比,不同浓度的Cd处理均会抑制小麦的株高、叶长和最长根长的生长,Cd毒性效应明显.随着Cd处理浓度的增加,2个小麦品种幼苗的株高、叶长和最长根长均呈下降趋势,且培养时间越长下降幅度越大.2个小麦品种在10 μmol/L Cd处理下,前期长势良好,Cd处理6 d后生长缓慢;Cd浓度高于50 μmol/L时,处理4 d后生长缓慢.比较2个小麦品种,同一Cd处理浓度下同一时刻92R137的长势好于河农6425.
本研究用变异系数衡量一个性状能否作为标准来筛选相应指标,变异系数越大,该指标越灵敏.在10 μmol/L Cd处理下,与对照组相比,92R137和河农6425株高的变异系数分别下降了7.26%和8.69%,叶长变异系数分别下降了5.97%和8.42%,最长根长变异系数分别下降了11.7%和12.57%.在50 μmol/L Cd处理下,2个品种小麦生长被抑制,生长缓慢,与对照组小麦相比,92R137和河农6425株高变异系数分别下降了12.75%和19.61%,叶长变异系数分别下降了10.26%和18.47%,最长根长变异系数分别下降了25.5%和26.72%.在100 μmol/L Cd处理下,与对照组小麦相比,92R137和河农6425株高变异系数分别下降了15.72%和23.63%,叶长变异系数分别下降了12.89%和22.63%,最长根长变异系数分别下降了26.73%和27.56%.在300 μmol/L Cd处理下,与对照组小麦相比,92R137和河农6425株高变异系数分别下降了17.7%和24.07%,叶长变异系数分别下降了14.02%和23.54%,最长根长变异系数分别下降了28.53%和28.33%.这说明最长根长最适宜作为不同小麦品种耐Cd能力的筛选指标.
使用Duncan多重比较法对比2个小麦品种在Cd处理14 d后的生长变化.各个浓度Cd处理组中的2个小麦品种与对照组小麦间均有显著差异(P<0.05).92R137小麦的最长根长在Cd浓度为100 μmol/L和300 μmol/L时无显著差异(P>0.05);河农 6425小麦的最长根长在Cd浓度为50、100和300μmol/L时均无显著差异(P>0.05).
2.2 不同浓度Cd胁迫对小麦幼苗含水量的影响
植株含水量能在一定程度上反映植物对Cd的耐受性[16].2个小麦品种幼苗在不同浓度的Cd处理14 d后,地上和地下部分的含水量如图1所示.由图1可以看出,随着Cd浓度的增加,2个小麦品种幼苗的地上和地下部分含水量均逐渐降低,河农6425地上和地下部分的含水量均低于92R137相应部位的数值.
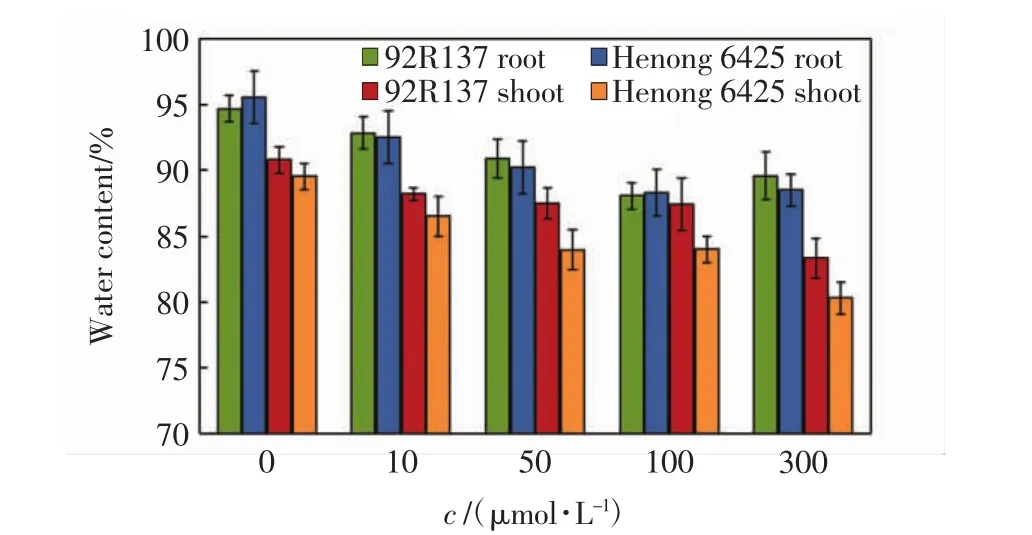
图1 不同浓度Cd胁迫14 d后小麦幼苗不同部位的含水量Fig.1 Water content in different part of wheat seedlings treated with various concentrations of Cd after 14 days
2.3 不同浓度Cd胁迫下小麦幼苗的Cd含量与转移系数
不同浓度Cd处理14 d后,小麦幼苗不同部位的Cd含量如图2所示.由图2可以看出,92R137小麦植株在各处理浓度中的Cd含量均高于河农6425.在小麦根部,2个小麦品种均在10 μmol/L Cd处理浓度下就达到了较高的吸收量,Cd处理浓度为50 μmol/L时,根部Cd吸收量显著降低,随着Cd处理浓度的进一步增加,根部的Cd吸收量又呈增加趋势.在地上部分,2个小麦品种的Cd吸收量均随着Cd处理浓度的增加呈上升趋势.
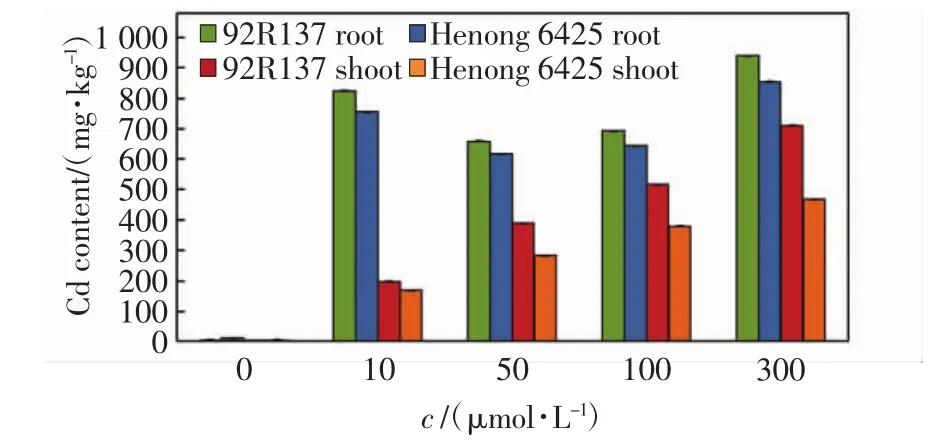
图2 不同浓度Cd胁迫14 d后小麦幼苗不同部位的Cd含量Fig.2 Cd content in different part of wheat seedlings treated with different concentrations of Cd after 14 days
2个小麦品种对Cd的转移系数有明显差异,如图3所示.
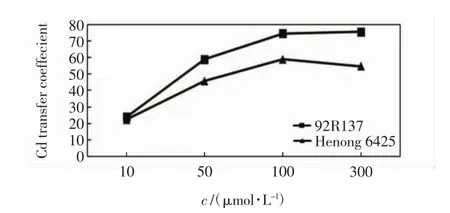
图3 不同浓度Cd胁迫14 d后小麦幼苗的Cd转移系数Fig.3 Cd transfer coefficient of wheat seedlings treated with different concentrations of Cd after 14 days
由图3可以看出,92R137的Cd转移系数在各个Cd处理浓度下均高于河农6425小麦的数值.Cd处理浓度为10 μmol/L时2个品种的转移系数差异不显著,随着Cd处理浓度的增加,差异逐渐增大.92R137小麦的转移系数随Cd处理浓度的增加一直呈增加趋势,而河农6425小麦的转移系数在高浓度Cd处理下有所降低.
2.4 不同浓度Cd胁迫对小麦叶片光合特性的影响
不同浓度Cd处理下,2个小麦品种幼苗的叶绿素荧光参数如图4所示.
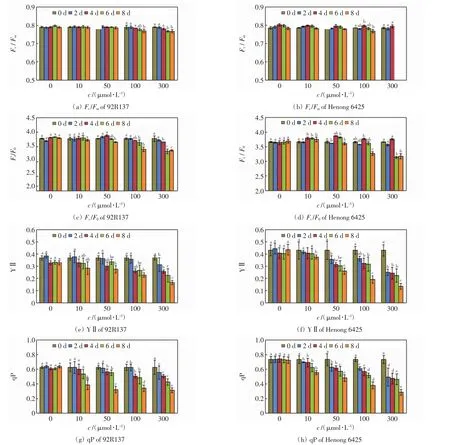
图4 不同浓度Cd处理下2个小麦品种的叶绿素荧光参数Fig.4 Chlorophyll fluorescence parameters of two wheat cultivars treated with different concentrations of Cd
由图4可以看出,Cd处理浓度≤10 μmol/L时,2个小麦品种的Fv/Fm和Fv/F0均相近,且不会随着培养时间的延长发生明显变化,YⅡ和qP在培养后期则显著下降.Cd处理浓度为50 μmol/L时,2个小麦品种的Fv/Fm和Fv/F0均不会随着培养时间的延长发生剧烈变化,YⅡ和qP则随着培养时间的延长急剧下降.Cd处理浓度>50 μmol/L 时,Fv/Fm和Fv/F0在培养6 d后出现下降,YⅡ和qP则在培养2 d后就显著下降.总的来看,低浓度Cd处理时2个小麦品种的叶绿素荧光参数变化幅度较小,高浓度Cd处理时YⅡ和qP随着处理浓度的增加和培养时间的延长急剧下降,且河农6425的变化幅度高于92R137的变化幅度.
2.5 Cd胁迫下小麦根细胞Ca2+分布的检测
用浓度为100 μmol/L的Cd处理2个小麦品种幼苗,根尖中的Ca2+分布情况如图5所示.
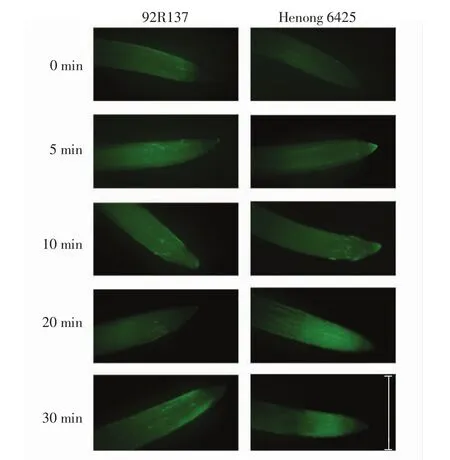
图5 Cd处理下2个小麦品种根尖中Ca2+的分布(标尺为1cm)Fig.5 Ca2+distribution of root tips in two wheat varieties treated with Cd(scale is 1 cm)
由图5可以看出,正常小麦根尖有少量的Ca2+均匀分布,Cd处理后小麦根尖Ca2+随处理时间的延长而上升,积累于分生区.92R137小麦根尖的荧光亮度随培养时间的延长逐渐增强,即Ca2+水平逐渐上升;河农6425小麦根尖Ca2+积累的速率随培养时间的延长逐渐加快,Cd处理20 min时Ca2+水平明显高于92R137的水平.这说明Ca2+作为信号分子参与了小麦响应Cd胁迫的过程.
3 讨论与结论
本研究以Cd敏感型小麦品种河农6425和耐Cd型品种92R137为实验材料,比较分析了2个小麦品种在遭遇Cd胁迫时做出的生长和生理响应.孟桂元等[17]认为,植物的发芽期和苗期由于防御系统尚未完全建立,是对Cd胁迫比较敏感的时期,因此本研究选用幼苗期小麦进行Cd胁迫实验.植物生长在受到Cd胁迫后,生长指标最先发生变化,如根、茎、叶等组织的生物量都会受到影响[17].本研究结果发现,与对照组小麦相比,Cd胁迫处理组中小麦幼苗的株高、叶长、最长根长等均有不同程度的下降.Cd处理浓度越大小麦受Cd胁迫的抑制效应越明显.从表型性状受抑制的程度和植株含水量来看,92R137对Cd胁迫的适应性强于河农6425.由变异系数的对比结果可知,各生长指标的变异系数差异显著,其中最长根长的变化幅度最大,说明最长根长最适合作为不同小麦品种耐Cd能力的筛选指标.
Cd胁迫下,小麦根和叶中的Cd含量均随着处理浓度的增加而上升,且根中的含量大于叶片中的含量,说明根部是小麦积累重金属Cd的主要器官,这与张大众等[3]的研究结果一致.不同基因型小麦富集和转移Cd的能力也不尽相同,基因型92R137耐Cd能力较强,且地上部积累的Cd离子浓度较高,表明92R137小麦能有效吸收培养液中的Cd离子并转运至地上部.这与刘翔宇等[18]研究不同基因型狗牙根耐Cd及Cd富集特性的结果一致.当不同浓度Cd处理小麦幼苗14 d时,92R137的转移系数高于河农6425,转移系数高表明植物在重金属Cd胁迫下可能存在较好的运输和解毒机制,可利用自身的解毒机制减少Cd产生的危害,这与顾翠花等[14]的研究结论一致.
Cd胁迫会抑制植物碳同化和电子传递,导致植物的光合能力下降.光合作用中光系统Ⅱ(PSⅡ)是逆境下敏感脆弱的部位之一.利用叶绿素荧光动力学方法可以快速、灵敏、无损伤地研究和探测各种逆境对PSⅡ的影响.本研究结果表明,Cd浓度低于50 μmol/L时,Fv/Fm、Fv/F0、YⅡ、qP 均无显著变化,表明低浓度 Cd 胁迫下小麦光反应是正常的.Cd浓度高于50 μmol/L时,这些参数均随着Cd胁迫浓度的增大和处理时间的延长而降低.王瑞波[7]的研究也表明Cd胁迫会抑制小麦PSⅡ的光化学活性.比较2个小麦品种,92R137叶绿素荧光参数的变化幅度低于河农6425,表明92R137在Cd胁迫下耗散过剩光能的能力和光保护能力均较强.
Ca2+对植物生长发育以及外界信号响应具有重要调控作用[19].Cd胁迫能够诱导Ca2+水平在30 min内迅速升高,这与杨振[20]在拟南芥中的研究结论相同.赵凤命等[21]的研究证明,Ca2+含量的升高参与了凋亡早期信号转导和凋亡的执行阶段.因此,Cd胁迫诱导Ca2+水平变化可能在细胞程序性死亡早期活性氧的产生中起重要作用,使细胞发生程序性死亡.Cd胁迫能够诱导2个小麦品种根尖的Ca2+水平在短期内迅速升高,92R137小麦根尖Ca2+水平随时间匀速增加,荧光亮度逐渐增强,河农6425小麦根尖Ca2+积累速率逐渐加快,Cd处理20 min时Ca2+水平明显高于92R137中Ca2+的水平.
总的来看,Cd胁迫显著抑制了小麦的生长.Cd适应性强的品种92R137小麦幼苗的Cd转移系数高,叶绿素荧光参数(Fv/Fm、Fv/F0、YⅡ、qP)高于 Cd 适应性差的品种河农6425.由于小麦对Cd胁迫的响应还涉及到小麦吸收和累积Cd、抗氧化酶保护、基因调控等过程,因此本课题组后续将进一步研究小麦整个生长发育期以及土壤环境下小麦的耐Cd胁迫反应机制.

