白藜芦醇抗人胰腺癌BXPC-3细胞增殖及机制探索
首都医科大学药学院(100069)李欣亚 张筱宜 赵明
白藜芦醇(Resveratrol)简称Res,被认为是最有希望的天然化学防癌剂之一。其化学名称为三酚(3,5,4’-trihydroxystiIbege),分子式为C14H12O3,相对分子质量为228.25[1],属于非黄酮类多酚化合物,分子结构式如附图1所示。白藜芦醇的天然存在形式有顺式和反式两种异构体,在植物中主要以反式异构体形式存在,生理活性强于顺式[2]。白藜芦醇主要存在于葡萄、花生等种子植物中,在新鲜葡萄皮中的含量最高,达50~100μg/g。1997年,Jang等对白藜芦醇在肿瘤发生、发展各阶段的抑制作用进行了初步研究[3],此后白藜芦醇开始肿瘤化学预防和化学治疗领域的一个研究热点。有研究证实,白藜芦醇对于鼻咽癌[4]、结肠癌[5]、肺癌[6]、肾小细胞癌[7]等具有抗肿瘤效应,在肿瘤的起始、促进、发展三个阶段均有抑制作用。但迄今为止,白藜芦醇抗肿瘤的确切机制依然未能完全阐明。
本文以反式白藜芦醇为研究对象,采用MTT法评价体外抗人胰腺癌BXPC-3细胞和人正常肝细胞LO2增殖活性。在此基础上,探索白藜芦醇作用机制。一方面,用流式细胞技术检测对BXPC-3细胞周期分布和凋亡的影响;另一方面,利用紫外光谱、测定DNA粘度等手段研究与DNA的相互作用;利用分子对接的方法模拟与DNA相互作用的模式。
1 材料
1.1 细胞系BXPC-3,人原位胰腺癌细胞(来自ATCC细胞库);LO2,人正常肝细胞(来自ATCC细胞库)。
1.2 主要试剂 白藜芦醇(用含1%DMSO的RPMI-1640培养基配制成所需浓度);RPMI-1640培养基(Gibco公司);胎牛血清(Hyclone公司);青霉素、链霉素(石药集团中诺药业(石家庄)有限公司);DMSO(Hyclone公司);CT-DNA(小牛胸腺DNA)(sigma公司,42%GC含量,为B型DNA);PBS(每升溶液中含有NaCl8.2g,KCl0.20g,Na2HPO4·H2O1.56g,KH2PO40.2g,pH为7.4);CT-DNA储备液(0.0165gCT-DNA用6mL PBS溶解,浓度为c=667μM)(置于4℃冰箱冷藏保存,不超过4天)。
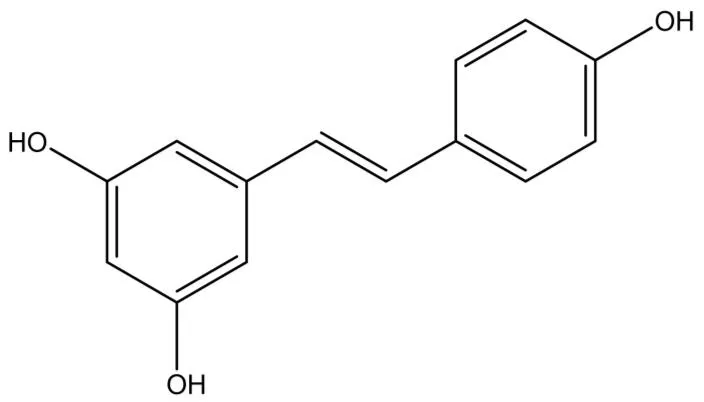
附图1 反式白藜芦醇分子结构式
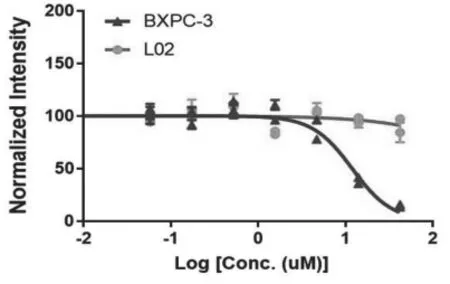
附图2 白藜芦醇抑制BXPC-3细胞生长的浓度-效应依赖关系

附图3 白藜芦醇影响BXPC-3细胞周期分布。注:3A.空白组BXPC-3细胞周期分布;3B.白藜芦醇作用48h BXPC-3细胞周期分布;3C.细胞周期分布定量结果

附图4 白藜芦醇诱导BXPC-3细胞凋亡。注:4A.空白组BXPC-3细胞流式分析结果;4B.白藜芦醇作用48h BXPC-3细胞流式分析结果;4C. 流式分析定量结果
1.3 主要仪器 高压灭菌锅:400 Ep-Z,Bruckmanning公司;细胞孵育箱:INC 153,memmer公司;低温离心机:SPD 111V,Thermo公司;6孔细胞培养板:Costar公司;石英自动双重纯水蒸馏器:1810-B,江苏荣华仪器制造有限公司;流式细胞仪:COULTER EPICS@XL(贝克曼·库尔特公司,美国);紫外分光光度计:2550,岛津公司;Ubbeholde粘度计。
2 方法
2.1 MTT法评价体外抗肿瘤细胞增殖活性将对数生长期的BXPC-3和LO2细胞分别以1×105个/mL的密度接种于96孔板,在37℃、5% CO2的培养箱中培养4小时,实验组按预设浓度(依次为0.001,0.057,0.173,0.520,1.559,4.678,14.03,42.11μM,各浓度复4孔)加入白藜芦醇,对照组加入等体积溶媒。继续培养48小时后,每孔加25μL浓度为5mg/mL的MTT溶液,置于37℃温箱孵育4小时,除去上清液,加入DMSO,待结晶溶解,立即于酶标仪上检测各组细胞在570nm和630nm处的吸光度(O.D.)值。计算不同浓度白藜芦醇对肿瘤细胞的抑制率:生长抑制率=[(对照组平均O.D.值-样品组平均O.D.值)/空白组平均O.D.值]×100%。用Prism计算IC50(半数有效抑制浓度)值。
2.2 流式细胞术检测对BXPC-3细胞周期和凋亡的影响 将处于对数生长期的BXPC-3单细胞悬液接种于6孔板中(细胞数量至少1×106个/mL),给药组加入20μL浓度为1×10-5mol/L的白藜芦醇,对照组加含0.1%DMSO的培养基。孵育48小时后,收集细胞,并调整细胞数量至1×106cells/mL。按照Annexin V-FITC/PI双染细胞凋亡检测试剂盒和细胞周期检测试剂盒说明书操作,用流式细胞仪进行检测。
2.3 与小牛胸腺DNA(CT-DNA)相互作用评价
2.3.1 紫外吸收光谱 配制浓度为16.7μM的CT-DNA溶液;配制浓度为21.2μM的白藜芦醇溶液。根据预实验结果,将4mL CT-DNA分别与20μL、40μL、60μL、80μL、100μL、120μL、140μL白藜芦醇溶液混合,在37℃温箱中孵育三小时,依次测定紫外吸收。
2.3.2 粘度法 配制浓度为16.7μM的CTDNA溶液,溶剂为PBS缓冲液。根据预实验结果,向CT-DNA溶液中依次加入0.260、0.390、0.520、0.650、1.000、1.300、2.000、3.000mL浓度为42.4μM的白藜芦醇溶液(样品终浓度分别为0.83、1.23、1.66、2.02、3.03、3.85、5.65、7.95μM)。用Ubbeholde粘度计测定缓冲液流经毛细管所需的时间t0及CT-DNA溶液(含浓度不等的白藜芦醇)流经毛细管所需的时间t。计算相对粘度:η=(t-t0)/t。以η1/3对结合比率[白藜芦醇]/[CT-DNA]作图。
2.3.3 分子对接研究 采用Discovery Studio 2017 R2模拟软件Ligandfit模块,将白藜芦醇和CT-DNA(PDBID:1NAB)进行分子对接,分析白藜芦醇和CT-DNA可能的相互作用模式。
3 结果
3.1 白藜芦醇对BXPC-3和LO2细胞增殖的影响如附图2所示,白藜芦醇可明显抑制BXPC-3细胞增殖,呈浓度依赖性,IC50为11.86±2μM;而对于LO2细胞几乎没有影响。说明白藜芦醇抑制肿瘤细胞和正常细胞的增殖具有一定选择性。
3.2 白藜芦醇对BXPC-3细胞周期和凋亡的影响 40μM白藜芦醇作用BXPC-3细胞48h的细胞周期分布检测结果见附图3(AC)。与空白组相比,白藜芦醇处理后,BXPC-3G0/G1期细胞比例从60.69提高为71.30,G2/M%期细胞比例从14.78降低为8.23,说明白藜芦醇可以在G0/G1期阻滞BXPC-3细胞增殖。40μM白藜芦醇作用BXPC-3细胞48h的细胞周期分布检测结果见附图4(A~C)。与空白组相比,白藜芦醇处理后,BXPC-3细胞凋亡率显著增加至50.6%。
3.3 与小牛胸腺DNA(CT-DNA)相互作用
3.3.1 紫外吸收光谱法研究白藜芦醇与CT-DNA的相互作用 由于CT-DNA在大于300nm的范围内无紫外吸收,因而选择220nm~300nm范围测定CT-DNA以及白藜芦醇和CT-DNA作用后的紫外光谱(附图5)。从图中可以看出:CT-DNA在220nm~300nm范围内最大吸收波长为258nm,吸收强度为1.355;随着白藜芦醇的含量不断增加,CT-DNA的紫外吸收发生减色现象,但最大吸收波长无明显偏移现象。

附图5 白藜芦醇含量对CT-DNA紫外吸收光谱的影响

附图6 不同浓度白藜芦醇对CT-DNA紫外吸收的影响

附图7 不同浓度白藜芦醇对CT-DNA溶液粘度的影响。注:η为溶液粘度,c(CT-DNA)=16.7μM,1–8:c(白藜芦醇)=(0.83,1.23,1.66,2.02,3.03,3.85,5.65,7.95)μM
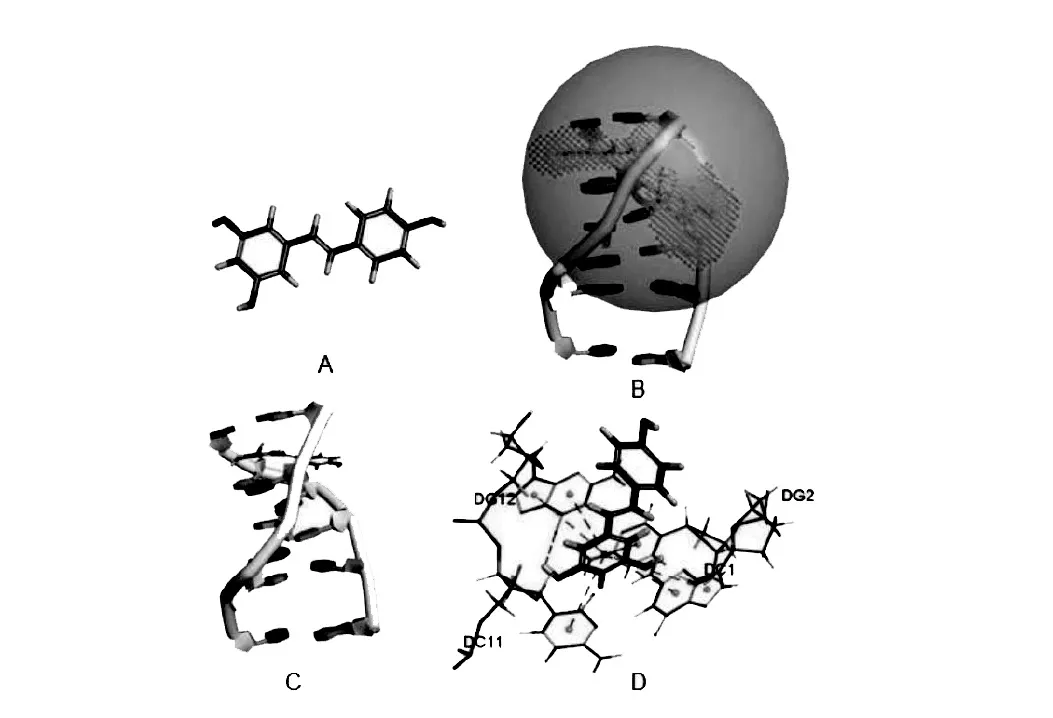
附图8 白藜芦醇与CT-DNA相互作用的分子对接。注:8A.白藜芦醇分子结构式;8B.CT-DNA的活性口袋;8C.白藜芦醇嵌插入CT-DNA碱基对之间;8D.白藜芦醇与碱基C和G相互作用
当小分子和CT-DNA发生相互作用时,可引起体系中电子能级和分布的变化,可以通过紫外吸收光谱判断它们的作用方式。一般认为,当这种方式是小分子插入CT-DNA分子的双螺旋碱基之间的嵌插作用时,小分子紫外光谱的最大吸收波长向长波方向移动(通常红移10~15nm),吸收强度降低(减色效应,吸收强度降低30%~50%);如果作用方式非特异性的静电作用结合到荷负电荷的CT-DNA双螺旋外部的沟槽作用,紫外光谱可能不表现上述变化,或者变化很微弱。因为当小分子以嵌插方式结合于DNA碱基对之间时,会合碱基对发生π-π堆积效应,与π*空轨道与碱基对的π电子轨道发生耦合,能级下降。从而导致π-π*跃迁能减小,其吸收光谱表现为峰位的红移。耦合后π轨道因部分填充电子使π-π*跃迁几率减小,产生减色效应[8][9][10]。由此推断,白藜芦醇与CT-DNA可能的结合模式为嵌插。
根据Stern-Volmer方程,A0/A=1+Kc[11],A0/A对c作图(附图6),用直线拟合,R²=0.9031,可由渐近线方程y=0.274x+0.985求得白藜芦醇与CTD N A的结合常数K=2.75×105。
3.3.2 粘度法研究白藜芦醇与CT-DNA的相互作用 随着白藜芦醇浓度的增加,DNA溶液的粘度逐渐增加。以η1/3对结合比率[白藜芦醇]/[CT-DNA]作图(附图7),R²=0.9918。一般来讲,当小分子配体以插入方式与DNA相互作用时,DNA相邻碱基对的距离会变大以更好地容纳配体分子,这就会导致DNA双螺旋结构伸长,DNA溶液粘度增加;当小分子配体与DNA为静电作用或沟槽结合时,DNA溶液粘度无明显变化;当小分子配体以部分插入方式与DNA作用时,可能使DNA双螺旋结构纽结,使其粘度增加[12][13][14]。由此推断,白藜芦醇与CT-DNA的结合模式为插入或部分插入。小分子药物与DNA嵌插结合时,会使DNA相邻碱基对的距离变大及整个DNA双螺旋链增长,从而导致溶液的黏度增大[15]。
3.3.3 分子对接法研究白藜芦醇与CTDNA的相互作用 白藜芦醇分子结构式如附图8A。阿霉素能嵌插到DNA的C-G碱基对中,与DNA双螺旋结构结合,活性口袋如附图8B。从附图8C可以看出,白藜芦醇以平行于碱基对的方式对接插入CT-DNA。从附图8D可以看出,白藜芦醇分子中与两个羟基相连的苯环与胞嘧啶脱氧核糖核苷酸中碱基的嘧啶环和鸟嘌呤脱氧核糖核苷酸中碱基的嘌呤环通过π-π堆叠的疏水键连接,且白藜芦醇分子上的C3-OH与嘌呤环上的酮基氧原子形成氢键。白藜芦醇与CT-DNA(1NAB)结合能-27.25kcal/mol。据此推断,白藜芦醇分子与CT-DNA的相互作用模式可能为嵌插作用。
4 讨论
癌症属于多发性疾病,严重威胁人类健康。2019年国家癌症中心发布的全国癌症报告显示,已经成为严重威胁中国人群健康的主要公共卫生问题之一,占居民全部死因的23.91%,每年恶性肿瘤所致的医疗花费超过2200亿,防控形势严峻。随着中医药的发展,人们从中药中不断发现抗肿瘤有效成分。近年来大量研究表明虎杖及其白藜芦醇等活性成分具有良好的抗肿瘤活性[16]。国内外对白藜芦醇药理作用及作用机制进行了有价值的探索,取得了鼓舞人心的结果。
本文首先评价白藜芦醇对肿瘤细胞生长的抑制作用,采用MTT法比较其体外抗人胰腺癌BXPC-3细胞和人正常肝细胞LO2增殖活性,结果表明,白藜芦醇可明显抑制BXPC-3细胞增殖,且此抑制作用呈浓度依赖性,而对于LO2细胞几乎无影响。由此可见,白藜芦醇对肿瘤细胞和正常细胞的增殖抑制作用具有一定选择性。在此基础上,本文继续研究白藜芦醇对人胰腺癌BXPC-3细胞周期分布及凋亡情况的影响,与对照组相比,白藜芦醇处理组BXPC-3G0/G1期细胞比例明显提高,G2/M期细胞比例明显降低,说明白藜芦醇可能在G0/G1期阻滞BXPC-3细胞增殖。流式检测结果显示,白藜芦醇作用组与对照组相比,BXPC-3细胞凋亡比例显著增加。因此,白藜芦醇可促进人胰腺癌BXPC-3 细胞凋亡。
在分子层面,本文采用紫外吸收光谱、粘度法、分子对接探索了白藜芦醇与CT-DNA的相互作用模式。紫外吸收光谱实验结果显示,随着白藜芦醇浓度的增加,CT-DNA溶液的吸收峰不改变,吸光度递减。由此推断,白藜芦醇与CT-DNA的结合模式可能为嵌插。粘度实验结果显示,随着白藜芦醇浓度的增加,CT-DNA溶液的粘度逐渐增加,并且η1/3与[白藜芦醇]/[CT-DNA]呈线性关系,白藜芦醇与CT-DNA可能的结合模式为嵌插。分子对接结果也提示白藜芦醇与CT-DNA最可能的相互作用模式为嵌插作用。
综上分析,白藜芦醇可能在人胰腺癌BXPC-3细胞周期的G0/G1期阻滞细胞增殖,促进其凋亡,也可能通过插入CTDNA的碱基对与CT-DNA相互作用,从而影响CT-DNA的复制和转录,因而表现出抗人胰腺癌BXPC-3细胞增殖活性。
5 致谢
感谢“基础与专业药学国家级实验教学示范中心(首都医科大学)”和“医学化学与药学北京高等学校示范性校内创新实践基地(首都医科大学)”两大平台的支持。感谢国家级虚拟仿真实验项目、内源式预防药物教育部工程研究中心和多肽及小分子药物北京市重点实验室的支持。感谢2020年北京高等学校高水平人才交叉培养“实培计划”、首都医科大学本科生科研训练项目(XSKY2020)的支持。