腹膜后纤维化致肾盂积水的临床分析:附17例报道
刘世博,高 辉,冯元春,李 静,张 彤,万 利,刘燕鹰,李胜光,罗成华,张学武△
(北京大学国际医院1. 腹膜后肿瘤外科,2. 风湿免疫科,3. 放射科,4. 检验科,5. 病理科,6. 肾内科,北京 102206; 7. 北京大学人民医院风湿免疫科,北京 100044)
特发性腹膜后纤维化(retroperitoneal fibrosis,RPF)是以腹膜后组织慢性非特异性炎症伴腹膜后腔纤维硬化组织增生为特点的一组疾病。增生的纤维组织通常累及肾动脉水平以远的腹主动脉及髂动脉,进而影响周围脏器功能,其中以包绕输尿管而引起肾盂积水最为常见。RPF发生率较低,有文献报道其患病率约为十万分之1.38[1]。其起病隐匿,疾病早期可有腰背部疼痛、下腹痛、全身乏力等非特异性的临床表现,临床诊治过程中常被误诊为腹膜后肿瘤性病变。随着疾病的进展,患者可能出现阴囊水肿、下肢肿胀、肾盂积水以及梗阻性的肾功能不全等相关临床表现,对患者的身体健康危害极大。
近年来,随着研究的不断进展,RPF的免疫学特征逐渐被人们所认识。2011年发表在《柳叶刀》上的临床对照研究奠定了激素治疗在该疾病中的核心地位,大大改善了患病人群的预后[2]。而肾盂积水作为最常见且最早出现的并发症,在疾病治疗的过程中积极解除输尿管梗阻,保护肾脏功能十分重要。因此,以激素及免疫抑制剂治疗为主体,并根据患者并发症状的严重程度,选择联合外科手术治疗的综合治疗方案逐渐被大家所认同。本研究通过对北京大学国际医院收治的17例已合并有肾盂积水的RPF患者的临床资料进行分析,了解RPF的临床特点以及诊治方法,总结诊治经验。
1 资料与方法
1.1 研究对象
选取北京大学国际医院2016年5月至2019年12月就诊的17例RPF合并肾盂积水患者,男性12例,女性5例,男女比例为2.4 ∶1,年龄38~71岁,中位年龄56(53,65)岁,病程为0.25~24个月,中位病程4.00(0.83,8.00)个月。其中8例患者为未经任何治疗的初诊病例,6例患者入选时仅接受过外科治疗(输尿管支架置入术5例、输尿管支架置入+输尿管松解术1例),1例患者入选时正在接受规范的激素治疗,1例患者为治愈停药后复发病例,1例患者曾自行服用错误剂量的激素治疗。所有患者均经病理、影像及临床特征等明确诊断为特发性RPF,且既往无恶性肿瘤及腹腔大手术病史。
1.2 研究方法
观察患者治疗前后的临床表现,收集患者血C反应蛋白(C-reactive protein,CRP)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、免疫球蛋白(immunoglobin,Ig)G4、IgG、IgM、IgE、IgA、补体C3、补体C4等指标的变化,并对患者的影像学检查结果进行总结和分析。依据文献报道的通用影像学分期标准进行分期:Ⅰ期,肿物包绕肾门水平以下的主动脉和/或髂动脉;Ⅱ期,Ⅰ期的基础上,同时累及肾门水平以下的静脉(主要是下腔静脉);Ⅲ期,Ⅰ期的基础上,肿物包绕单侧或者双侧输尿管;Ⅳ期,Ⅰ期的基础上,肿物包绕肾门及肾动静脉[3]。影像学图像测量的主要指标为:(1)病变的上下径线,即从病变起始层面至结束层面的垂直长径;(2)病变的左右径线,病变横截面的最大左右长径;(3)病变的前后径线,病变横截面的最大前后长径。收集其中12例患者的病理活检结果,分析组织中IgG4的表达量,IgG4+/IgG+浆细胞比率,有无席纹状纤维化及闭塞性静脉炎等病理特点。
1.3 治疗方案
15例RPF患者接受了激素治疗。醋酸泼尼松初始剂量为0.8 mg/kg(最大剂量为60 mg/d), 2~4周后开始减量,每周减量5 mg,减至40 mg/d后每周减量2.5 mg,至30 mg/d后每2周减量2.5 mg,至15 mg/d后每月减量2.5 mg,至7.5~10 mg/d时维持或酌情减停。其中11例患者联合应用了免疫抑制剂治疗,4例为单独应用激素治疗。13例患者在接受药物治疗前放置输尿管支架,其中3例因肿物对输尿管侵犯严重,放置支架后梗阻难以解除,故在拟行药物治疗前行输尿管松解术。
1.4 统计学方法
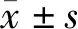
2 结果
2.1 临床表现
17例RPF患者的临床特点如表1所示,其中,主要临床表现为腰痛9例(52.9%)、腹痛6例(35.3%)、少尿2例(11.8%)、下肢水肿3例(17.6%)、腹泻1例(5.9%)、便秘1例(5.9%)。
2.2 实验室、影像学检查结果
所有患者均进行影像学及相关实验室检查。17例患者中,CRP升高13例(76.5%),ESR升高13例(76.5%),IgG4升高5例(29.4%)。其中13例患者进行了血免疫球蛋白亚型分析,IgG升高4例(30.8%),IgM升高0例,IgE升高4例(30.8%),IgA升高1例(7.7%),补体C3下降1例(7.7%),补体C4下降1例(7.7%)。所有患者均经影像学检查提示存在肾盂积水,其中左侧8例,右侧1例,双侧8例。通过患者的腹部电子计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)资料进行分析,14例分期为Ⅰ+Ⅱ+Ⅲ,3例为Ⅰ+Ⅱ+Ⅲ+Ⅳ。
2.3 病理学特征
有12例患者接受了病变组织病理活检,这些患者的病理组织中均可见大量淋巴细胞及浆细胞浸润。其中的IgG4表达量高低不一,6例表达量小于10/高倍视野(high power field,HPF)或不表达(50.0%), 2例表达量为10~30/HPF(16.7%), 4例表达量大于30/HPF(33.3%)。4例患者IgG4+/IgG+浆细胞比率>40%。3例病理组织中可见席纹状纤维化,4例病理组织中可见闭塞性静脉炎。根据2012年发表的IgG4相关性疾病病理表现的诊断共识,3例患者可明确诊断为IgG4相关性RPF[4]。

表1 17例RPF患者临床特点Table 1 Clinical features at presentation in 17 patients with RPF
2.4 随访分析
17例患者中,13例患者在接受药物治疗前放置输尿管支架,其中4例因药物治疗时间尚短,未到评估拔管时机,仍需继续随访,余9例中6例在随访期间因药物治疗梗阻好转拔除支架,3例患者则因梗阻难以解除,在拟行药物治疗前行输尿管松解术,术后顺利拔除支架,该9例平均置管时间(6.7±3.0)个月。其余4例患者虽然存在单侧肾盂积水,但由于病变较小,梗阻轻,未放置输尿管支架,其中2例仅进行药物治疗后输尿管梗阻便得以解除,另外2例患者在接受药物治疗后失访。
10例患者具有完整的随访资料,中位随访时间为5(3,13)个月。ESR治疗前54.0(36.3,98.5) mm/h,治疗后8.5(5.8,37.8) mm/h,下降38.5(23.5,54.3) mm/h(P<0.01,图1A)。CRP治疗前26.8(8.7,53.0) mg/L,治疗后2.8(1.4,10.4) mg/L,下降23.0(5.5,52.0) mg/L(P<0.05,图1B)。IgG4治疗前1.34(0.55,3.36) g/L,治疗后0.31(0.12,0.58) g/L,下降0.92(0.40,2.85) g/L(P<0.01,图1C)。其中8例患者进行了血Ig亚型分析,IgG治疗前16.3(13.0,21.1) g/L,治疗后9.7(8.8,13.3) g/L,下降6.5(1.7,9.1) g/L(P<0.05,图1D);IgE治疗前40.5(31.4,203.0) IU/mL,治疗后23.0(15.5,54.5) IU/mL,下降 23.7(4.8,162.0) IU/mL(P<0.05,图1E);IgA治疗前2.51(1.82,3.25) g/L,治疗后2.02(0.97,2.29) g/L,下降0.77(0.32,1.26) g/L(P<0.05,图1F);IgM、补体C3、补体C4治疗前后变化差异无统计学意义(P>0.05)。
我们通过对该10例患者治疗前后的CT结果进行比较,治疗前后患者腹膜后肿物的上下径线[(107.0±25.3) mmvs. (66.0±45.7) mm]、左右径线[(47.6±16.0)mmvs. (24.5±19.4) mm]、前后径线[(29.3±9.7)mmvs. (15.9±10.1)mm]差异均有统计学意义,治疗后各项测量指标均较前显著缩小(P<0.01,图2和3)。
3 讨论
RPF最早由Albarran于1905年首次报道,1948年Ormond对该疾病进行了详尽的描述,并于1960年将其确立为一个独立的疾病,称之为Ormond氏病[5]。随着研究的不断深入,2009年Zen等[6]发现部分RPF患者血清IgG4水平升高且组织样本中可见大量IgG4阳性细胞浸润,因此,认为此类患者属于IgG4相关性疾病。不同研究提示IgG4相关RPF占RPF的比例约为30%~59%[7],这对该疾病的治疗提供了新的方向。但仍有部分患者其血清及病理结果中的IgG4表达为正常水平,且IgG4高表达与低表达的患者在临床特征上并无显著不同[8]。本组12例接受病理活检的病例中,3例患者可诊断为IgG4相关性RPF,占25.0%,以上患者的病理样本中同时可见典型的席纹状纤维化及闭塞性静脉炎病理特征,这也说明以上病理特征对IgG4相关性RPF的诊断有着重要价值。但由于本研究IgG4高表达病例数较少,无法对IgG4高表达及低表达组的临床特点进行统计学分析,仍需多中心大样本的研究进行深入探讨。
RPF发病率低,有文献报道其患病率约为 1.38/10万,好发于50~60岁的人群,男性发病率约为女性的2~3倍[1, 9],常见的首发症状为腰背部疼痛、腹痛。本组17例患者中,8例以腰痛主诉首诊,5例以腹痛主诉首诊。由于该病起病隐匿,早期缺乏特异性临床表现,通常未能引起患者的足够重视,很多患者就诊时已存在肾盂积水甚至肾功能不全。本组病例合并双侧肾盂积水8例,左侧肾盂积水8例,右侧肾盂积水1例,左侧肾盂积水患者明显多于右侧。国内外有多篇文献对单侧及双侧肾盂积水患者数量进行统计,但未见有研究关注RPF导致输尿管梗阻是否存在左右侧的差异。由此,我们推测,RPF病变多以腹主动脉为中心向四周包绕相邻组织及脏器,而右侧输尿管与腹主动脉间间隔下腔静脉,影响了病变向右侧的进展速度,在一定程度上保护了右侧输尿管,但由于本研究病例数较少,不能排除统计误差,我们也将继续关注这一疾病特点,进行针对该疾病的多中心研究,进一步证实假设。
腹部增强CT对于RPF的诊断具有重要价值,主要表现为主动脉旁的不规则软组织影,病变范围可由肾动脉水平一直延伸至单侧或双侧髂动脉,病变沿腹膜后生长,通常包裹下腔静脉甚至输尿管。病变的强化程度也有助于判断其病情活动程度[10-11]。对于合并有严重肾功能不全的患者,由于无法耐受造影剂,也可通过腹部MRI或平扫CT来协助诊断,评价病变范围。此外,腹部CT也可评估输尿管受压及肾盂积水程度。RPF的主要病理特点为慢性炎性组织沉积,其中包含有淋巴细胞、巨噬细胞、浆细胞及嗜酸性粒细胞等,部分患者的浆细胞表现为IgG4阳性。由于RPF缺乏典型的病理学特征,因而病理诊断的主要价值在于排除其他可疑的腹膜后恶性占位性病变。在实际临床工作中,由于病变通常包绕腹膜后大血管,穿刺活检风险很高,实施困难。对于影像学检查高度怀疑RPF,且无其他任何罹患肿瘤疾病证据的患者,可给予诊断性治疗,并密切随访观察治疗过程中病变的大小变化。此外,血清中的IgG4水平对诊断及疗效判断有着一定价值,ESR及CRP可作为病情活动的评价指标,但急性期炎症指标通常与患者的临床症状密切相关,本研究中的8例初治患者,ESR及CRP水平均高于正常,随访过程中观察到部分患者在仅进行外科解除梗阻治疗后ESR及CRP指标即可降至正常水平。而ESR及CRP的水平也容易受到感染等多种因素影响,本研究中1例患者在治疗后出现ESR及CRP升高,结合患者随访时的尿常规检查及相关症状,考虑可能为泌尿系感染导致。因此,在疾病的诊治过程中,需结合影像学检查中病变的大小变化来评价疗效,判断预后[12]。
目前,针对RPF的治疗主要从控制疾病进展以及保护肾脏功能两个方面进行,其治疗效果与疾病活动程度、发展程度及相应器官的累及程度有关。RPF的免疫学特征在近10年来才逐渐得到认识,缺乏设计良好的临床研究,Vaglio等[2]于2011年发表在《柳叶刀》上的临床对照研究奠定了激素治疗在该疾病中的地位,但数据表明停药后的复发率高达72%[13]。目前普遍认为,联合使用一种免疫抑制剂可协助控制病情[14],已有文献报道甲氨蝶呤、他莫昔芬、吗替麦考酚酯、环磷酰胺等多种免疫抑制剂对RPF治疗有效,但由于缺乏大样本的随机对照研究,目前尚无首选治疗药物[2, 15-17]。也有研究发现,单独应用激素和激素联合免疫抑制剂两组间的疗效差异无统计学意义[18],对于轻型RPF患者,可进行单独激素治疗,激素治疗效果不佳或治疗后复发患者建议联合免疫抑制剂治疗[19]。本组患者多数就诊时病情进展严重,给予激素及免疫抑制剂的联合治疗,治疗效果明显,多数患者治疗后肿物明显缩小。除了药物治疗外,当患者存在严重的泌尿系梗阻时,需通过放置输尿管支架,解除梗阻,保护肾脏功能[20]。如梗阻严重,输尿管支架放置困难,则应考虑行双侧输尿管松解术并将输尿管放置于腹腔内[21]。本组患者在治疗过程中有13例因输尿管梗阻而放置输尿管支架,其中6例在随访期间因病情控制满意、梗阻好转而拔除支架,3例患者则因梗阻难以解除,在拟行药物治疗前行输尿管松解术,术后顺利拔除支架,平均置管时间(6.7±3.0)个月。所有患者拔除输尿管支架后均未再次置管。我们观察到,有2例患者虽然存在单侧肾盂积水,但由于病变较小,未放置输尿管支架,仅进行药物治疗后输尿管梗阻即得以解除。由于输尿管支架置入后疼痛、泌尿系感染发生概率较高,因此,对于病情较轻,病变仅累及单侧输尿管的患者,可在密切监测肾功能及肾盂积水变化的情况下单纯进行药物治疗。
综上所述,RPF起病隐匿,早期无特异性临床表现,通过腹部增强CT检查及定位下的肿物穿刺活检病理可明确诊断。本病以激素治疗为主,并根据疾病的严重程度选择联合应用免疫抑制剂为该疾病治疗的主要方案。如患者已经出现严重的输尿管梗阻症状,则需要外科干预,积极保护肾脏功能。正确的诊断、合理的治疗方案及治疗后的密切随访对改善患者预后至关重要。

