腹腔镜下远端胃癌根治术后胃瘫综合征的危险因素分析
陈 蓉 颜优贞 刘 颖 林振孟
福建省肿瘤医院 福建医科大学附属肿瘤医院胃肠肿瘤外科,福建省福州市 350014
目前,手术是治愈胃癌的唯一方式。当前微创理念得到广泛的认可,腹腔镜技术作为微创手术的核心,具有创伤小、恢复快、并发症少等优点[1]。随着手术器械和外科技术水平的提高,使腹腔镜下胃癌根治术在世界范围内广泛开展。然而胃的解剖层次复杂、血供丰富、清扫淋巴结范围广,使得胃的手术难度大,技术要求高,术后容易出现肺炎、吻合口漏、胃瘫综合征等并发症[2]。术后胃瘫综合征 (Postsurgical gastroparesis syndrome,PGS) 是常见的一种手术后继发以胃排空障碍为主要征象的非机械性功能性疾病 ,常见于胃肠、胰腺手术,其主要表现为恶心、呕吐、上腹部饱腹感、腹胀和上腹痛等上消化道症状[3]。PGS的病因复杂,延长住院时间、增加患者痛苦,容易引起医患矛盾,本文分析PGS的高危因素,为临床护理实践提供依据。
1 资料与方法
1.1 一般资料 回顾性分析2008年8月—2019年5月1 105例于福建省肿瘤医院行腹腔镜下远端胃癌根治术患者的临床病理资料,其中男743例,女362例,平均年龄(59.1±11.2)岁。
1.2 纳入及排除标准 纳入标准:腹腔镜手术;根治性远端胃癌切除术;术后病理明确的腺癌;随访可靠,临床病理资料完整。排除标准:因出血、梗阻急诊行手术治疗;合并心、肝、肺等严重基础疾病;合并其他恶性肿瘤;联合多脏器切除术。
1.3 PGS的诊断标准 目前,国内外PGS的诊断标准尚未统一,国外部分学者认为PGS的金标准是胃排空闪烁扫描术,但仍未形成共识。国内PGS的诊断标准为:(1)检查明确无胃液流出道机械性梗阻,但上消化道提示胃蠕动功能降低,胃内胃液潴留;(2)术后早期出现上腹饱胀感,反复呕吐,胃管引流量>800ml/d,持续时间>10d;(3)未见明显水、电解质平衡紊乱;(4)无引起胃瘫的基础性疾病,如甲状腺功能减退等;(5)围手术期未应用影响平滑肌收缩的药物。
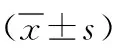
2 结果
本组共有5.8%(64/1 105)患者术后出现PGS,平均术后第7.4天出现PGS,所有患者均经保守治疗后好转。PGS患者术后住院时间为(18.4±3.2)d,明显高于非PGS患者的(7.1±2.0)d(P<0.05)。单因素分析表明PGS与年龄、术前合并焦虑症、术前低白蛋白血症、术前合并幽门梗阻、糖尿病、术后阿片类镇痛药物和术中吻合方式有关(P<0.05)。多因素分析显示术前合并焦虑症、术前白蛋白、糖尿病、术前幽门梗阻、术后镇痛方式、手术吻合方式是发生PGS的独立危险因素(P<0.05)。性别、吸烟史、肿瘤大小、术前新辅助化疗、病理分型、Borrmann分型、手术时间、术中出血量与PGS无关(P>0.05),见表1、表2。
3 讨论
腹腔镜技术应用于胃癌手术已经超过20年,随着设备的发展以及医生技术的提升,已由治疗早期胃癌拓展到进展期胃癌,并取得良好的效果。与开放手术相比,其远期效果相当,但具有手术应激反应小、恢复快等优势[4]。
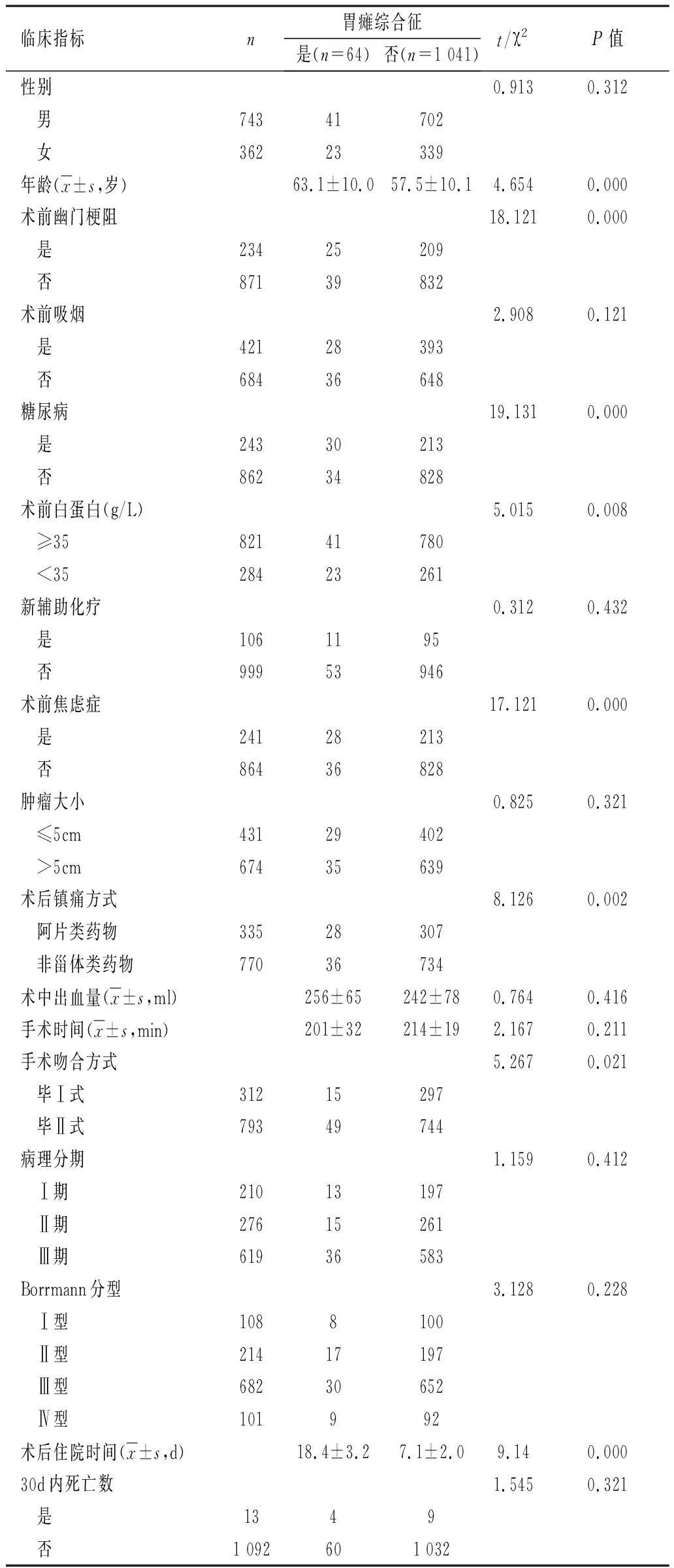
表1 PGS与临床病理特征的关系

表2 术后发生PGS的多因素分析
本文中PGS的发生率为5.8%,严重延长患者的住院时间、增加患者的心理负担。目前PGS的发生机制尚未明确,主要考虑以下几点原因:(1)手术后胃解剖改变,特别是迷走神经切除后胃正常蠕动功能下降。(2)胃窦部可分泌胃泌素、胃动素等兴奋性激素,手术切除后导致该类激素分泌减少,影响残胃的排空。(3)胃大部切除术后大量胆汁、胰液反流,导致胃内环境改变,进而使胃顺应性和动力降低。(4)手术应激、精神紧张、焦虑等加重自主神经功能紊乱,也是导致PGS的重要原因。因此,本文中术前合并焦虑症患者更容易发生PGS。
老年患者生理功能减退和重要脏器储备能力下降,胃肠蠕动功能、免疫力减弱,对手术应激能力下降,所以年龄是影响胃瘫重要因素。术前低白蛋白血症与PGS有关,白蛋白是患者营养状态重要指标,低白蛋白血症提示营养不良,术后容易出现吻合口水肿,造成胃肠运动障碍。术前合并幽门梗阻也容易造成PGS,一方面幽门梗阻后导致呕吐、负氮平衡,不利于术后恢复。另一方面,梗阻后引起胃肠运动节律紊乱,术后更易发生PGS。相对于毕Ⅱ式吻合,毕Ⅰ式吻合是术后胃肠恢复正常蠕动的保护因素,因为毕Ⅰ式更符合胃肠生理构造,减少胆汁、小肠液反流,更有利于胃肠动力的恢复。糖尿病也是PGS的高危因素,由于糖尿病患者导致周围神经发生不同程度病变后胃电节律紊乱,胃排空延迟。另外,术后应激状态引发高血糖也具有抑制胃肠排空的作用[5]。术后阿片类药物作为术后镇痛的常见药物,具有抑制胃肠蠕动的副作用,过度的使用阿片类药物容易发生PGS。
总之,PGS是胃癌术后常见并发症,严重影响患者术后恢复,可以经保守治疗后好转,但医护人员需全面细致护理、加强心理指导等措施,密切观察病人病情,使患者早日康复。

