黄秋葵发酵酒渣果胶多糖的流变学性质
陈发河,周彦强,吴光斌
(集美大学食品与生物工程学院,福建 厦门 361000)
黄秋葵(Abelmoschus esculentusL. Moench),也称秋葵、羊角菜,起源于非洲,目前在我国南北方广泛种植[1-2]。黄秋葵嫩荚中含有大量的黏性多糖物质,其主要成分包括果胶多糖、阿拉伯聚糖、半乳聚糖及少量糖蛋白[3],黄秋葵荚果中含有的黏性多糖物质具有抗疲劳[4-5]、增强免疫力[6]、降低血脂[7]等功能。
果胶作为一种亲水性植物胶,常存在于高等植物的根、茎、叶和果实中。果胶具有良好的增稠性、凝胶性、稳定性、乳化性等,常作为天然食品添加剂应用于果汁饮料、果冻、果酱、乳酸等食品的加工中。研究表明,黄秋葵嫩果中含蛋白质约2.5%,含果胶多糖约24.8%[8],可用作食品乳化剂、增稠剂、稳定剂[9-10]以及用作药片缓释膜[11]。黄秋葵果实的利用方式主要是嫩荚用作烹饪,有学者研究了黄秋葵酒的发酵工艺[12],亦有企业研发出黄秋葵酒投放市场,但黄秋葵酒发酵过程中产生的大量酒渣尚未得到充分利用。国内关于黄秋葵的研究主要集中在果胶多糖、黄酮等活性成分的提取工艺及理化性质方面[2,13],对黄秋葵发酵酒渣制备的果胶多糖的流变学特性鲜有报道。黄秋葵果胶多糖的溶液是一种非牛顿流体,具有很明显的剪切稀化现象,黄秋葵果胶多糖的这种特殊性质可能具有进一步利用的潜力。本实验研究了黄秋葵果胶多糖和黄秋葵发酵酒渣果胶多糖的流变学性质,以期为黄秋葵发酵酒渣的综合利用和黄秋葵果胶的应用提供理论指导。
1 材料与方法
1.1 材料与试剂
新鲜黄秋葵果荚、黄秋葵发酵酒渣 厦门市如意情有限公司。将发酵后的酒渣晒干,然后粉碎过40 目筛后冰箱保存备用。将新鲜黄秋葵果荚烘干,然后粉碎过40 目筛后冰箱保存备用。
葡萄糖、半乳糖、甘露糖、阿拉伯糖、纤维素酶、聚二甲基硅氧烷、咔唑(均为分析纯) 中国医药集团;鼠李糖、葡萄糖醛酸(均为色谱纯) 北京索莱宝科技有限公司;半乳糖醛酸(色谱纯) 上海麦克林生化科技有限公司;1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP,纯度≥99.9%)、乙腈(均为色谱纯) 美国Sigma公司;无水乙醇、浓硫酸、氢氧化钠、盐酸、磷酸氢二钠、磷酸二氢钠均为分析纯。
1.2 仪器与设备
2695高效液相色谱(high performance liquid chromatography,HPLC)仪(配2489紫外检测器) 美国Waters公司;Discover HD2流变仪 美国TA公司;高速冷冻离心机 德国Eppendorf公司;Cary50紫外-可见分光光度计 美国Varian公司;WM1乌氏黏度仪上海玻璃仪器公司;RIOS 8超纯水系统 美国Millipore公司;PE20K型pH计、LE204E电子天平 瑞士Mettler Toledo公司;WB-14恒温水浴锅 德国Memmert公司;ULT1386 -80 ℃超低温冰箱 美国Thermo Fisher公司;MA35快速水分测定仪 德国赛多利斯公司;FD-1D-50冷冻干燥机 北京博医康实验仪器有限公司。
1.3 方法
1.3.1 黄秋葵黄秋葵发酵酒渣和黄秋葵果胶多糖提取
分别称取一定量的黄秋葵发酵酒渣和黄秋葵粉,用20 倍70%的乙醇溶液浸提2 次(室温,1 h),然后使用5 倍氯仿和甲醇的混合溶剂(1∶1,V/V)提取1 h除去色素等杂质,最后使用丙酮洗涤后烘干,得到醇不溶固形物(alcohol-insoluble solid,AIS)备用。精确称取2.00 g AIS,加入一定量的超纯水和纤维素酶,使用盐酸和氢氧化钠溶液调节pH值;在一定温度下水浴振荡提取一定时间后,8 000×g离心10 min收集滤液;滤液于45 ℃旋蒸浓缩;冷却后加入3 倍体积的95%乙醇,4 ℃放置过夜,4 000×g离心10 min。最后得到的沉淀分别用75%乙醇溶液和无水乙醇溶液洗涤,复水溶解后冷冻干燥,分别得到黄秋葵发酵酒渣果胶多糖和黄秋葵果胶多糖,备用。黄秋葵发酵酒渣果胶多糖和黄秋葵果胶多糖得率分别为(6.85±0.21)%和(7.23±0.66)%。
1.3.2 黄秋葵酒渣果胶多糖的流变学特性的测定
1.3.2.1 特性黏度和黏均分子质量的测定
特性黏度反映了高聚物分子与溶剂分子的内摩擦。大分子聚物的分子质量愈大,则它与溶剂间的接触表面也愈大,摩擦也大,表现出的特性黏度也大。使用乌氏黏度仪(0.010 13 mm2/s2,ID:0.5~0.6 mm)测定黄秋葵发酵酒渣果胶多糖的特性黏度。根据式(1)计算:

对于某一个指定的黏度计,省略相关值,同时引入比黏度ηr(溶质的黏度与溶剂的黏度之比),则上述公式可以转化为:

式中:η0为纯溶剂的黏度;η为同温度下聚合物溶液的黏度;t为溶液的流出时间;t0为溶剂的流出时间。根据公式,只需测定果胶多糖溶液和溶剂的流出时间即可计算溶液的比黏度ηr。配制果胶多糖的溶液的质量浓度为0.01~0.15 g/dL,在30 ℃的条件下进行测定,每个质量浓度做3 次平行并取平均值。
特性黏度的外推通常有2 种方法,分别是使用Huggins方程或是Kraemer方程外推无限稀浓度得到。其公式分别如下:

式中:ηsp为增比黏度,其数值等于ηr-1;K和β分别为Huggins和Kraemer常数。特性黏度与分子质量之间的经验关系式为:

式中:M为黏均分子质量;K为比例常数;α为与分子形状有关的经验参数。K和α值在一定条件下恒定,其数值可通过其他方法确定。
当溶液的黏度在中间呈现剪切变稀现象而在低、高剪切下则均为几乎不依赖于剪切速率的常数,此轮廓特征与Cross model较为符合[14],其公式如下:

式中:η0和η∞分别为零剪切黏度和无穷大黏度;λcr为Cross松弛时间;n为Cross指数。使用TA analysis软件将数据与此模型拟合,可以得到零剪切黏度,无穷大剪切黏度、Cross松弛时间和Cross指数。
Cox-Merz作为一个跨体系的普适性经验公式,联系着2 类性质完全不同的流变测量[15]。一个是大形变的稳态剪切实验测得到的量高分子材料典型的非线性黏性,或称“结构黏性”,在微观尺度上,测量了分子链的滑行、定向,解缠绕或弱相互作用键的破坏;另一个是小幅度振幅动态实验,测量了材料的线性黏弹性,在微观尺度上表示大分子链的柔顺性。熔体和均一溶液的稳态剪切黏度η(η=τ/γ)和小振幅动态剪切的复合黏度η*(η*=σ/γω=(G’2+G’’2)1/2/ω)分别对角频率和剪切速率的数值作图所得的曲线基本重合,即Cox-Merz关系式:

1.3.2.2 流变学实验设计
使用TA Discover DH-2旋转流变仪,实验温度由循环水浴及帕尔贴系统控制,精度为±0.1 ℃。
流动阶梯实验:使用TA Discover DH-2旋转流变仪,配合60 mm 2°的锥形铝板,设定温度25 ℃,剪切速率扫描范围0.001~1 000 s-1进行测定。设定的稳态条件为:在3 个连续的数据采集周期内扭矩的变化均小于前一周期的5%,但每一数据点的最长采样时间为2 min。探究Flow Sweep模式下剪切速率黏度随着剪切速率的变化情况。
线性黏弹区域的确定:使用60 mm 2°的锥形铝板,固定振荡频率1 Hz,应力范围0.1%~100%,设定温度25 ℃,使用Oscillation Amplitude模式,探究不同样品的线性黏弹范围。
振荡扫描实验:频率扫描实验使用60 mm 2°的锥形铝板,设定应力在线性黏弹区域内,温度25 ℃,频率范围0.01~100 rad/s,使用Oscillation Frequency模式,探究不同角频率下储能模量(G’)和耗能模量(G’’)的变化。
温度斜坡的振荡实验使用60 mm的平行铝板,设定应力在线性黏弹区域内,角频率10 rad/s,斜坡速率5 ℃/min,温度范围10~95 ℃,间隙800 μm。为了避免高温度溶剂的挥发,采用轻质硅油(聚二甲基硅氧烷,25 ℃黏度为10 mPa·s)覆盖其暴露的边缘。使用Oscillation Temperature Ramp探究温度变化对模量的影响。
1.3.3 黄秋葵发酵酒渣果胶多糖及其理化性质的测定
1.3.3.1 果胶多糖含量的测定
对复水溶解后的果胶多糖溶液,使用苯酚-硫酸比色法[16]测定。标准曲线的制作方法:配制0.01~0.08 mg/mL的8 个质量浓度的半乳糖溶液,各取1 mL加入具塞玻璃试管中,再加入1 mL 6%的苯酚溶液,混匀后加入5 mL浓硫酸,沸水浴20 min。使用蒸馏水作对照,测定490 nm波长处的吸光度。
1.3.3.2 水分含量的测定
采用快速水分测定仪进行测定。
1.3.3.3 pH值的测定
参照QB 2484—2000《食品添加剂 果胶》中的方法,用pH计进行测定。
1.3.3.4 半乳糖醛酸含量的测定
采用咔唑硫酸法测定其半乳糖醛酸的含量[17]。
标准曲线的制作:称取咔唑0.150 g定容至100 mL乙醇溶液中,得到1.5 g/L的咔唑溶液。配制10、20、30、40、50、60、70 μg/mL半乳糖醛酸溶液,各取1 mL于试管中,然后各加入浓硫酸6 mL,混合均匀;沸水浴15 min,冷却至室温后加入1.5 g/L咔唑溶液1 mL,混合均匀,室温下避光放置1 h;以超纯水为空白测定526 nm波长处的吸光度。以测得的吸光度为纵坐标,半乳糖醛酸含量为横坐标,绘制标准曲线,得到标准曲线回归方程为:Y=0.005 1X-0.011 0(R2=0.995 5)。
1.3.3.5 蛋白质含量的测定
采用福林-酚法[18-19]略作修改测定果胶多糖中的蛋白质含量。
溶液的配制:A液:1 g Na2CO3溶于50mL0.1mol/LNaOH溶液中;B液 :0.5gCuSO4· 5 H2O 溶 于100 mL 1 g/100 mL的酒石酸钾钠溶液。甲液:取50 mL A液与1 mL B液混合。乙液:福林-酚溶液。
标准曲线的制作:使用牛血清白蛋白作为标准品,配制质量浓度为50、100、150、200、250 μg/mL的牛血清白蛋白标准溶液。取 1 mL标准溶液,加入甲液5 mL,振荡均匀后静置10 min;再加入0.5 mL乙液,振荡均匀后静置30 min。以超纯水为空白测定其650 nm波长处的吸光度。以吸光度(A)为纵坐标,牛血清白蛋白标准溶液质量浓度为横坐标,制作标准曲线。
样品的测定:配制一定浓度的果胶多糖溶液,取1 mL待测溶液,按照制标准曲线制作的操作方法进行测定。
1.3.3.6 酯化度的测定
参照GB 25533—2010《食品添加剂 果胶》等方法[20]测定,并稍作修改。
称取2 g果胶多糖于烧杯中,加入50 mL盐酸-乙醇溶液(浓盐酸-75%乙醇(1∶100,V/V)),搅拌10 min;过滤,真空抽吸滤干后用盐酸-乙醇溶液洗涤6 次,每次用10 mL,再用乙醇溶液冲洗至滤出物不含氯离子,最后用20 mL无水乙醇冲洗滤干,在105 ℃干燥2 h,冷却后称质量。
称取0.5 g干燥后的果胶样品于250 mL具塞锥形瓶,滴加少量无水乙醇润湿。加入100 mL超纯水振荡至完全溶解。以酚酞为指示剂,用0.1 mol/L氢氧化钠溶液滴定,记录下所消耗的氢氧化钠标准滴定溶液的体积V1。加入20.0 mL 0.5 mol/L氢氧化钠溶液,振摇后静置15 min,加入20.0 mL 0.5 mol/L盐酸标准滴定溶液进行中和,振摇至粉红色消失。最后使用0.1 mol/L氢氧化钠溶液滴定,记录此步骤所消耗的0.1 mol/L氢氧化钠标准滴定溶液的体积为V2。酯化度按照式(8)计算[21-22]:

1.3.3.7 色差分析
黄秋葵酒渣果胶多糖的色差,使用指标L*、a*、b*和ΔE表示,在Brookfield SC-80C型自动色差仪上进行测定,平行3 份,结果取平均值。其中L*代表明度;a*代表红绿色度,a*>0代表红色,a*<0表示绿色;b*代表黄蓝色度,b*>0表示黄色,b*<0表示蓝色;ΔE表示色差。
1.3.3.8 单糖组成的分析
采用PMP柱前衍生化HPLC法测定黄秋葵果胶多糖的单糖组成[23]。
Nour[24]和Ferreira[25]等认为可以根据鼠李糖与半乳糖醛酸的比值确定果胶多糖分子中半乳糖醛酸聚糖(homogalacturonan,HG)和鼠李半乳糖醛酸聚糖(rhamnogalacturonan,RG)I的比例。Houben等[26]也根据这个原理,按照式(9)式(10)计算HG和RG I物质的量分数:

1.4 数据处理
使用Microsoft Excel 2010软件对数据进行处理,使用Adobe Photoshop软件对图像进行处理。
2 结果与分析
2.1 黄秋葵酒渣果胶多糖的流变学特性
2.1.1 特性黏度和黏均分子质量
分别将图1和图2曲线外推可以得到特性黏度。对黄秋葵酒渣果胶多糖,通过Huggins和Kraemer计算得到的[η]分别为41.89 dL/g和41.28 dL/g;而对于黄秋葵酒渣果胶多糖,[η]分别为5.15 dL/g和4.71dL/g。使用乌氏黏度仪测得的此黄秋葵果胶多糖和黄秋葵酒渣果胶多糖的特性黏度分别为41.12 dL/g和4.66 dL/g。
多糖溶液的流变学特性很大程度上取决于水和大分子对水溶液的空间占据量。特性黏度的数值用来表示相互分散的单个大分子聚合物所占有的溶液体积,并非传统意义上的动力黏度[27]。酒渣中提取的黄秋葵果胶多糖的特性黏度明显低于原始黄秋葵果胶多糖较低的特性黏度可能是由于分子质量的降低,亦或是分子内相互作用导致的分子收缩或分子链的随机缠绕使其在水溶液中的空间占有量减小。本实验中黄秋葵经过发酵后的酒渣果胶多糖特性黏度的降低,可能是由于发酵过程中果胶多糖分子链的破坏导致其分子质量的下降,从而导致单个分子占据的溶液体积的下降,使得特性黏度下降。
此外,Huggies常数K还可以提供分子链柔性的近似信息。在不同的分子链柔性和分子链之间不同的相互作用下,导致K值的大小不同。K值在0.2~0.8之间通常表示较为柔性的分子链,K值大于2则表示其分子可能为不带电的球型分子[28-29]。本实验中黄秋葵发酵酒渣果胶多糖和黄秋葵果胶多糖的Huggies常数分别为和0.55和0.59,说明2 种分子链都具有较好的柔性,同时也可以说明黄秋葵酒渣果胶多糖分子质量的降低并没有对分子链的柔性造成太大影响。
将Huggies方程和Kramer方程得到的特性黏度取平均值计算黏均分子质量,得到黄秋葵酒渣果胶多糖和黄秋葵果胶多糖的黏均分子质量分别为2.47×105g/mol和1.466×106g/mol。

图1 黄秋葵果胶多糖溶液的uggins和Kraemer曲线Fig. 1 Huggins and Kraemer plots of aqueous pectic polysaccharide solutions from okra

图2 黄秋葵发酵酒渣果胶多糖溶液的uggins和Kraemer曲线Fig. 2 Huggins and Kraemer plots of aqueous pectic polysaccharide solutions from okra wine pomace
2.1.2 流动阶梯实验
由图3、4可知,在0.01~2 000 s-1剪切速率范围内,2 种溶液的黏度都随溶液质量浓度的加大而增大,而对每种质量浓度的溶液,其黏度随着剪切速率的增加而减小,其变化趋势为非牛顿流体中的假塑性流体,具有明显的剪切稀化现象。剪切稀化现象产生的原因主要有[30]:1)各向异性的粒子随着流体流向的定向排列导致了流体动力学的交联程度的减少;2)聚合的分子在剪切力的作用下分解,减少了流体动力的干扰;3)以随机线圈的形式存在的聚合物分子在流动过程中被拉伸;4)乳状的液滴在流动状态下变为流线形状。果胶多糖是一种大分子聚合物,在水溶液中以随机线圈的形式存在,同时也有团聚现象。在高速剪切力下分子在剪切流场中逐渐解缠并取向,这使得其具有明显的剪切稀化现象。
相比于黄秋葵果胶多糖溶液,黄秋葵发酵酒渣果胶多糖溶液的黏度要明显降低,0.1 g/dL的黄秋葵果胶多糖溶液在低剪切速率的黏度,与质量浓度为5 g/dL黄秋葵发酵酒渣果胶多糖溶液的黏度大致相等。黄秋葵酒渣经过了较长时间的发酵过程,可能会造成果胶多糖分子链的断裂,使得其分子质量变小,从而减少了水溶液中分子间的相互缠绕,具有明显的剪切稀化。黄秋葵酒渣果胶多糖这种假塑性特性在实际应用中具有一定的实际意义,其黏度范围表明黄秋葵酒渣果胶多糖非常适合用作食品的增稠剂;又因为其具有的剪切稀化现象和不成凝胶的特性,也可以用作工业中需要泵送或者搅拌的物料。

图3 不同质量浓度的黄秋葵酒渣果胶多糖的稳态流动扫描曲线Fig. 3 Steady-state flow curves of different concentrations of pectic polysaccharides from okra wine pomace
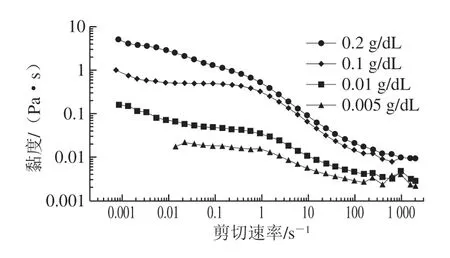
图4 不同质量浓度的黄秋葵果胶多糖的稳态流动扫描曲线Fig. 4 Steady-state flow curves of different concentrations of pectic polysaccharides from okra
在图3和图4的双对数曲线上,溶液的黏度在中间呈现剪切变稀现象而在低、高剪切速率下则均为几乎不依赖于剪切速率的常数。
根据不同的质量浓度下的零剪切黏度,计算比浓黏度ηsp。特性黏度与溶液的质量浓度之积表示大分子占据的空间大小,将其作为横坐标,再将比浓黏度ηsp为纵坐标,绘制双对数曲线。通常可以用来探究随机缠绕分子的临界质量浓度c*,其结果如图5所示。临界质量浓度c*的数值可作为增稠剂添加量的参考,当其质量浓度大于临界质量浓度c*时,黏度的增加变得更快;而小于临界质量浓度时,黏度的变化缓慢。
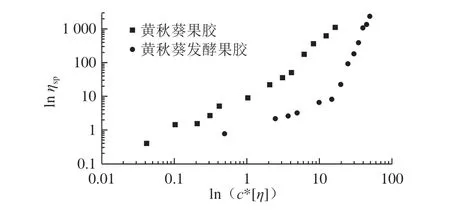
图5 黄秋葵酒渣果胶多糖溶液增比黏度对c*[η]做双对数曲线Fig. 5 Zero shear specific viscosity versus reduced concentration c*[η]for pectin from okra wine pomace
从图5可以看出,黄秋葵果胶多糖并没有临界质量浓度c*;而黄秋葵发酵果胶多糖的临界质量浓度c*在4 g/dL附近,此时的分子空间占据量在20附近。在果胶多糖质量浓度小于c*时,可以认为溶液中的分子还是相互独立,彼此的距离较远;而当质量浓度大于c*时,溶液的体积不足以提供每个分子需要的占据的空间,分子间的挤压、穿插开始出现,使得此时的图像斜率明显上升。通常,无序的大分子链的双对数曲线都可以部分叠加。本实验中黄秋葵酒渣果胶多糖的双对数曲线与Ndjouenkeu等[31]报道的Dika nut多糖结果相类似。
2.1.3 线性黏弹区域的确定
线性黏弹性区域是指样品的黏弹性与施加应力或应变的水平都相互独立的应变区域,即改变应变的大小不影响G’和G’’的变化。线性黏弹区域是振荡实验的基础,所有的振荡实验都必须在线性黏弹区域内进行。黄秋葵酒渣果胶多糖和黄秋葵果胶多糖溶液的模量与施加应变的关系如图6和图7所示。可以看出,两者的线性黏弹区域都较宽,并且都随着溶液质量浓度的降低线性范围收窄。较窄的线性范围通常意味着溶液体系的不稳定型增加或是溶液中有效分子质量的减少。可以看出当振荡应变大于10%或是小于2%时,溶液的模量不再是线形的,所以后续的实验选择5%作为振荡实验的应变。

图6 黄秋葵酒渣果胶多糖溶液在不同质量浓度下G’和G’’与振荡应变之间的关系Fig. 6 G’ and G’’ versus oscillation strain curves of pectin solutions from okra wine pomace at different concentrations
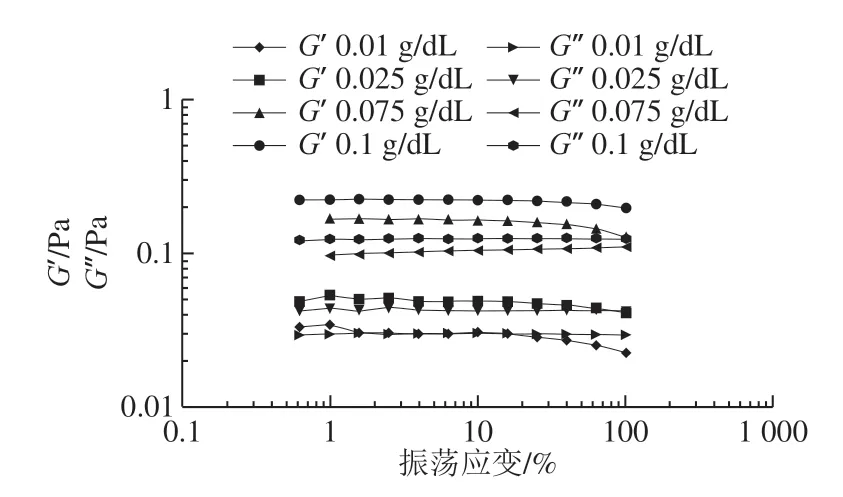
图7 黄秋葵果胶多糖溶液在不同质量浓度下G’和G’’与振荡应变之间的关系Fig. 7 G’ and G’’ versus oscillation strain curves of pectin solutions from okra at different concentrations
2.1.4 振荡扫描实验
果胶多糖溶液属于黏弹性物质,其同时表现出固体和液体的特性,因此在线性黏弹区域内,改变振荡频率或是改变固定频率下的温度,可以得到样品的G’和G’’的变化,从而推断其结构性质。图8显出了10 g/dL的黄秋葵酒渣果胶多糖溶液的黏度与温度的关系。在10~90 ℃的温度变化范围内,溶液的模量随着温度的升高而逐渐降低,且没有明显的G’和G’’急剧变化。这说明了在较广的温度范围内,黄秋葵酒渣果胶多糖没有明显凝胶化的性质。当溶液的温度升高时,水分活度上升,果胶多糖分子链变得更为柔软同时更加延展,这会增加分子流体力学体积,而且果胶多糖分子链之间相互作用的水平也会提高。同时,温度上升也补偿了分子之间摩擦所造成的能量损失。果胶多糖溶液的模量随温度增加而呈现出线性地降低,这可能是由于加热影响了诸如弱范德华力的相互作用维持着的相对松散的网络区域的剪切变形。
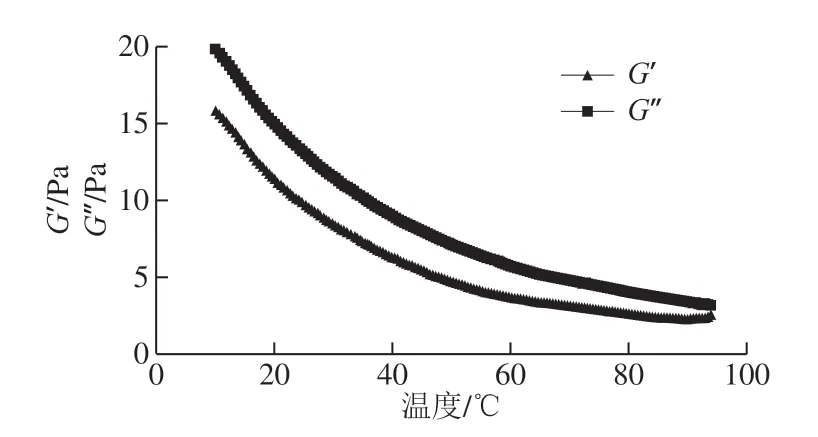
图8 黄秋葵酒渣果胶多糖溶液G’和G’’随温度升高的变化Fig. 8 Effects of temperature on storage model and loss model of pectin from okra wine pomace
图9 和图10显示了G’和G’’随着角频率的变化。在本实验的角频率范围内,G’和G’’没有显示出交点;同时黄秋葵果胶多糖溶液的G’大于G’’,这说明原始黄秋葵果胶多糖溶液更多的表现出弹性而非黏性。G’和G’’都随着角频率的减小而减小。根据Schorsch等[32]的理论,G’与G’’的比例大于3时可认为此溶液是一种强的凝胶,当小于3且大于1时认为此溶液是一种弱凝胶。所以黄秋葵果胶多糖溶液在实验的角频率范围内是一种弱凝胶。从图10可以看出,黄秋葵发酵酒渣果胶多糖的G’’要略大于G’,表明发酵酒渣果胶多糖溶液更多表现出黏性而非弹性,这表明可在某些加热的物料中用作添加剂。

图9 黄秋葵果胶多糖溶液G’和G’’与频率之间的关系Fig. 9 G’ and G’’ as a function of angular frequency for pectin solutions from okra at different concentrations
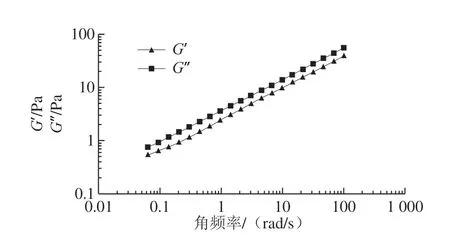
图10 黄秋葵酒渣果胶多糖溶液G’和G’’与频率之间的关系Fig. 10 G’ and G’’ as a function of angular frequency for pectin solutions from okra wine pomace at different concentrations
黄秋葵发酵酒渣果胶多糖3 种质量浓度的水溶液的测定结果基本符合Cox-Merz公式(图11)。但是在低剪切速率的时候出现了偏离,其复合黏度要大于稳态剪切黏度,而在高剪切速率时并未出现此现象。所以,在使用Cox-Merz规则进行非线性模型黏度预测的时候,高频下的溶液可以使用此规则进行预测,而低频下会出现偏离,不适用此规则。可能原因是黄秋葵发酵酒渣果胶多糖在水溶液中会形成大分子缠结或聚集,同时这些新形成的结构对稳态剪切作用更为敏感,容易使其发生解团聚或是分子链定向从而将其新形成的结构破坏;而这些新形成的结构对低频率的小幅度振荡剪切并不敏感,依然有足够的时间可以维持或去重建这类的结构,这就造成了低频率的振荡剪切得到的复合黏度大于稳态剪切黏度的情况。这一结果与Kontogiorgos等[27]有关研究报道一致。

图11 黄秋葵酒渣果胶多糖的Cox-Merz经验关系式Fig. 11 Cox-Merz relationship of pectin from okra wine pomace
2.2 黄秋葵酒渣果胶多糖主要理化性质

表1 黄秋葵酒渣果胶多糖的主要理化性质Table 1 Physicochemical properties of pectic polysaccharide from okra wine pomace
从黄秋葵发酵酒酒渣中提取的黄秋葵酒渣果胶多糖和从黄秋葵果荚中提取的黄秋葵果胶多糖的主要理化性质如表1所示。黄秋葵酒渣果胶多糖和黄秋葵果胶多糖两者半乳糖醛酸含量相近,前者的酯化度明显高于后者,两者均为高酯果胶且高于QB 2484—2000《食品添加剂果胶》的标准。相比从黄秋葵酒渣中提取得到果胶多糖的半乳糖酸酸含量和蛋白质含量较低,灰分较高,具有较高的酯化度。高脂果胶在食品加工中应用较广,相对于低酯果胶,高脂果胶凝胶速率快,凝胶温度高,一般用可作为食品的增稠剂、胶凝剂、稳定剂、乳化剂等。黄秋葵原料经过了发酵,可能导致酯化度改变、灰分增加等性质的变化。
2.3 黄秋葵酒渣果胶多糖的单糖组成
采用PMP柱前衍生HPLC法检测黄秋葵酒渣果胶多糖和黄秋葵果胶多糖的单糖组成,7 种单糖组分的含量如表2所示。从其单糖组成可以看出,黄秋葵果胶多糖和黄秋葵酒渣果胶多糖均含有甘露糖、葡萄糖、鼠李糖、半乳糖醛酸、葡萄糖醛酸、半乳糖和阿拉伯糖,这表明这两种果胶多糖均属于酸性杂多糖,7 种单糖组分分别占这2 种来源的果胶多糖的54.7%和52.3%。
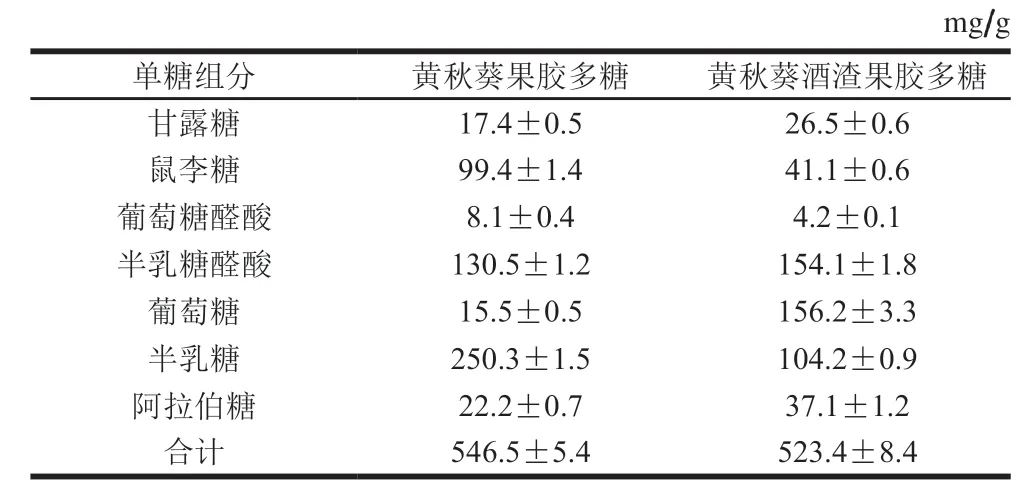
表2 黄秋葵果胶多糖和黄秋葵酒渣果胶多糖的单糖组成(n=3)Table 2 Monosaccharides composition of okra pectin and pectin from okra wine pomace (n= 3)
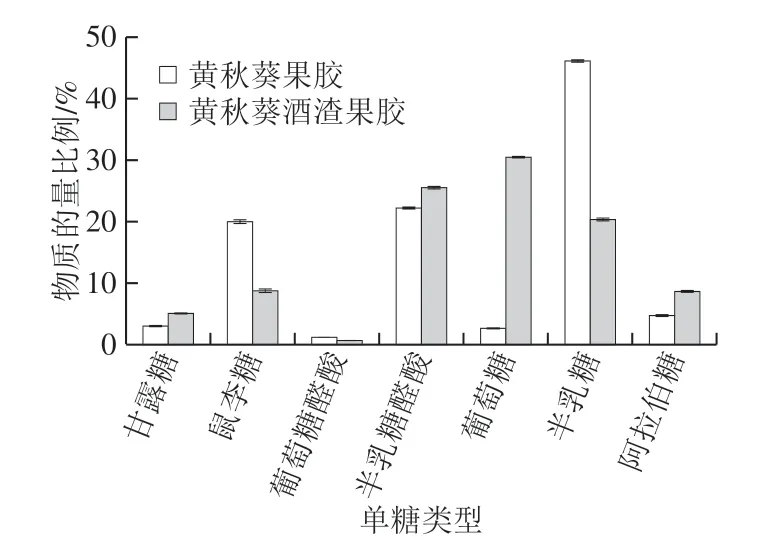
图12 黄秋葵果胶多糖和黄秋葵酒渣果胶多糖的单糖物质的量比例(n=3)Fig. 12 Molar ratios of monosaccharides of okra pectin and pectin from okra wine pomace (n = 3)
由图12可知,发酵后黄秋葵酒渣果胶多糖的单糖组分发生了部分变化。其中变化较为明显的有鼠李糖的含量由20.0%减少到8.8%,半乳糖由22.3%增加到25.6%,葡萄糖由2.7%增加到30.6%,半乳糖由46.2%减少到20.4%,阿拉伯糖由4.8%增加到8.7%。在果胶多糖的结构中,葡萄糖不常见[33-34]。细胞壁中的葡萄糖通常以纤维素的形式存在,而纤维素结构较为稳定且不溶于水。发酵后的酒渣果胶多糖中葡萄糖比例的大幅度增加可能与发酵过程中部分蔗糖添加有关。鼠李糖、半乳糖醛酸、半乳糖、葡萄糖醛酸和半乳糖醛酸含量的变化可能与黄秋葵的成熟度以及不同的品种有关,植物成熟度的增加会使得原果胶多糖向水溶性果胶多糖转化。而阿拉伯糖的增加可能与纤维素酶对细胞壁的破坏有关。在Sengkhamparn等[35-36]的研究中,使用水或者螯合剂作为溶剂提取得到的果胶多糖均未发现大量的阿拉伯糖,而当继续使用碱溶液和还原剂对其继续处理时,阿拉伯糖的含量显著提高。同时,阿拉伯糖通常存在于RG I和RG II上支链的末端,其含量的变化也可以作为果胶多糖分子的分支程度的参考。黄秋葵酒渣果胶多糖中阿拉伯糖含量的增加可能表明其RG I或RG II结构上的支链的增加。
果胶多糖中含量较高的结构是HG、RG I和RG II。其中RG II的分子链较小,并且通常连接于HG的末端,所以在果胶多糖中的含量也较少。

表3 黄秋葵果胶多糖和黄秋葵酒渣果胶多糖的单糖物质的量比例Table 3 Molar ratios between selected monosaccharide components in okra pectin and pectin from wine pomace
如表3所示,单糖的物质的量比例可以反映果胶多糖分子结构包括支链上的差异,黄秋葵果胶多糖具有很高比例的RG I组分,这可以从HG、RG I的比例或是Rha/GalA的比值(0.90)得出结论。本实验中黄秋葵果胶多糖的RG I比例为91%,这与Sengkhamparn等[36]的研究结果(85%)基本一致。不同来源的果胶多糖其HG和RG I的比例不相同。黄秋葵果胶多糖的RG I比例要比其他植物的果胶多糖高很多,例如甜菜浆果胶多糖中RG I为22%[37],苹果为31.9%,大豆为43%[38]。黄秋葵酒渣果胶多糖的RG I组分为46.74%,低于黄秋葵果胶多糖的90%;其HG组分为16.76%,高于黄秋葵果胶多糖的2.21%。(Ara+Gal)/Rha的比例可以反映RGI组分侧链上的多糖数量,两者的比值分别为2.54和3.29,这表明黄秋葵酒渣果胶多糖RG I的侧链长度或侧链数量要大于黄秋葵果胶多糖RG I的侧链。
3 结 论
黄秋葵发酵酒渣果胶多糖的流变学性质研究表明,黄秋葵果胶多糖和黄秋葵酒渣果胶多糖的特性黏度分别为41.12 dL/g和4.66 dL/g,黏均分子质量分别为1.466×106g/mol和2.470×105g/mol,黄秋葵经过发酵后的酒渣果胶多糖特性黏度的降低,但两者的Huggies常数相差不大,分别为0.59和0.55,说明2 种分子链都具有较好的柔性,同时也可以说明黄秋葵酒渣果胶多糖分子质量的降低并没有对分子链的柔性造成太大影响。流动阶梯实验显示,黄秋葵发酵酒渣果胶多糖属于非牛顿流体中的假塑性流体,具有剪切稀化现象,但没有黄秋葵果胶多糖的剪切稀化现象明显,黄秋葵酒渣果胶多糖这一特性使其非常适合用作食品的增稠剂。将流动曲线拟合Cross模型,结合双对数曲线得到黄秋葵发酵酒渣果胶多糖的临界质量浓度c*约为4 g/dL,此时的分子空间占据量约为20,而黄秋葵果胶多糖并没有临界质量浓度c*。振荡实验显示其线性黏弹区域在2%~10%内均为线性。在振荡实验的温度范围内黄秋葵发酵酒渣果胶多糖是一种弱凝胶,没有明显的凝胶点。频率扫描实验表明黄秋葵果胶多糖溶液的G’大于G’’,说明其更多的表现出弹性而非黏性;黄秋葵发酵酒渣果胶多糖的G’’大于G’,其更多的表现出液体的黏性特征。Cox-Merz公式的拟合表明,黄秋葵发酵酒渣果胶多糖在低剪切速率下的复合黏度要大于稳态剪切黏度,表明其分子之间可能有新的结构生成,同时此结构对稳态剪切更为敏感。
黄秋葵发酵酒渣果胶多糖的主要理化性质研究表明:黄秋葵酒渣果胶多糖和黄秋葵果胶多糖酯化度分别为74.45%和55.817%,两者均为高酯果胶,前者的酯化度明显高于后者;从单糖组成可以看出,黄秋葵酒渣果胶多糖和黄秋葵果胶多糖均含有甘露糖、葡萄糖、鼠李糖、半乳糖醛酸、葡萄糖醛酸、半乳糖和阿拉伯糖,这表明这2 种果胶多糖均属于酸性杂多糖,7 种单糖组分分别占这两种来源的果胶多糖的52.3%和54.7%。根据单糖组分计算得到黄秋葵酒渣果胶多糖和黄秋葵果胶多糖的RG I组分分别为46.74%和90.00%,HG组分分别为16.76%和2.21%;两者的(Ara+Gal)/Rha比值分别为3.29和2.54,表明黄秋葵酒渣果胶多糖RG I的侧链长度或侧链数量要大于黄秋葵果胶多糖RG I的侧链。本研究结果可为黄秋葵发酵酒渣果胶多糖应用提供理论指导。

