响应面法优化[Cnmim]Cl(n=2,4,6)-K2HPO4双水相法萃取无花果蛋白酶
曾 杰,房海灵*,梁呈元*,亓希武,郭 强,于 盱
(1.江苏省中国科学院植物研究所,江苏 南京 210014;2.句容市虎耳山无花果专业合作社,江苏 镇江 212013)
无花果(Ficuscarica)为桑科(Moraceae)榕属植物,因其树体及果实分布乳汁管而具有分泌白色乳汁的功能[1]。前期研究者对无花果分泌乳汁进行研究,发现其富含的巯基蛋白水解酶,稳定性好,耐高温,催化活性强,作用范围广,被广泛应用于蛋白水解、活性肽生成、乳制品凝固等医药和食品等行业[2-4]。
传统提取无花果蛋白酶的方法有盐析法、有机溶剂法、柱层析法以及超滤法等,然而以上方法所得的酶存在活性低、易变性、纯度低及专一性差等缺点[5],寻找一种高效、绿色的无花果蛋白酶提取纯化技术迫在眉睫。
双水相萃取技术(ATPS)利用组分在两水相间选择性分配而达到组分的分离提纯,具有条件温和、易于放大、不存在有机试剂残留等优点,被广泛应用于蛋白酶的提取纯化中[6-7]。目前,仅见利用PEG/盐双水相系统提纯无花果蛋白酶,分配系数可达3.6[8]。离子液体/盐双水相系统是近年来发展的新型双水相体系,其中离子液体是一种由特定的阴阳离子组成的室温下呈液态的低温熔融盐,为近年来新兴的绿色溶剂,形成的双水相体系具有分相快、黏度低、萃取率高及两相界面清晰等优点[9],可有效萃取植物蛋白酶。王伟涛等[10]运用离子液体双水相萃取木瓜蛋白酶,结果表明木瓜蛋白酶酶活回收率为91.2%,纯化倍数为1.73。
本研究采用[Cnmim]Cl(n=2,4,6)-K2HPO4双水相法萃取无花果蛋白酶,通过优化双水相体系中关键因子,分析其对无花果蛋白酶的分配行为及活力影响,确定最优萃取体系,为后期无花果蛋白酶的提纯及应用提供参考。
1 材料和方法
1.1 材料与试剂
无花果青果采自句容市虎耳山无花果专业合作社;([C2mim]Cl、[C4mim]Cl、[C6mim]Cl)购自上海成捷有限公司;K2HPO4(AR)购自国药集团化学试剂有限公司,酪氨酸标准品,L-半胱氨酸,干酪素购自生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 无花果粗蛋白酶的制备 利用物理挤压法收集无花果未成熟果实中白色乳汁,参考Mostafaie等[11]的方法,采用盐析法提取无花果蛋白粗酶,备用于下一步试验。
1.2.2 [Cnmin]Cl(n=2,4,6)-K2HPO4离子液体双水相萃取无花果蛋白酶 (1)在离子液体([C2mim]Cl、[C4mim]Cl和[C6mim]Cl)质量浓度分别设定为0.30 g/mL、体系pH 7.0、30 ℃、酶添加量为3.0 mg/mL的条件下,体系K2HPO4质量浓度分别为0.25,0.30,0.35,0.40,0.45 g/mL时,考察离子液体侧链烷基长度及K2HPO4质量浓度对无花果蛋白酶的萃取效果;(2)在双水相体系K2HPO4质量浓度为0.30 g/mL、体系pH 7.0、30 ℃、酶添加量3.0 mg/mL条件下,设定离子液体[C4mim]Cl质量浓度分别为0.20,0.25,0.30,0.35,0.40 g/mL,考察离子液体质量浓度对无花果蛋白酶的萃取效果;(3)在0.30 g/mL [C4mim]Cl,0.30 g/mL K2HPO4,pH 7.0,30 ℃双水相体系中,设定无花果粗酶粉添加量分别为2.0,2.5,3.0,3.5,4.0 mg/mL,考察酶添加量对无花果蛋白酶的萃取效果;(4)在0.30 g/mL [C4mim]Cl、0.30 g/mL K2HPO4、酶添加量3.0 mg/mL、30 ℃条件下,设定体系pH分别为5.0,6.0,7.0,8.0,9.0,10.0,11.0,考察体系pH值对无花果蛋白酶的萃取效果。
根据单因素试验结果,对离子液体质量浓度(A)、K2HPO4质量浓度(B)、酶添加量(C)和pH值(D)这4个因素进行优化,根据Box-Benhnken中心区组试验法进行试验设计,以酶回收率和纯化倍数作为考察指标,获得无花果蛋白酶的最佳萃取参数。试验因素及水平见表1。
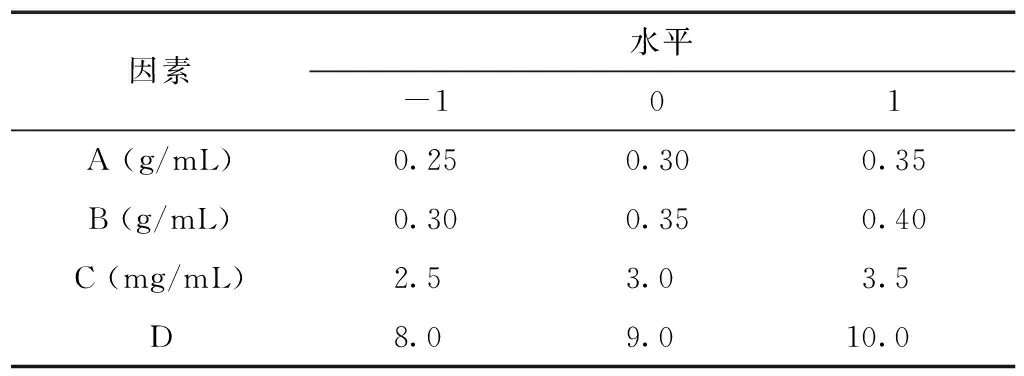
表1 因素水平
1.2.3 蛋白酶活性测定及酶活回收率计算 参考王伟涛等[10]的方法,无花果蛋白酶活性测定以酪蛋白为底物。酶活回收率(Ye)=(EtopVtop/Me)×100。其中,Etop为上相酶活性浓度(U/mL),Vtop为上相体积(mL),Me为初始总酶活性(U)。
1.2. 4 蛋白含量测定及纯化倍数计算 采用Bradford法来测定蛋白质含量[10],牛血清蛋白为标准品。PF(纯化倍数)=SAtop/SAI,其中,SAtop为上相酶比活力,SAI为初始酶比活力。
1.2.5 数据分析 采用Design Expert 8.0.5和Microsoft Excel 2010软件对数据进行分析与作图,P<0.05,表示具有处理间显著性差异。
2 结果与分析
2.1 K2HPO4质量浓度与[Cnmim]Cl(n=2,4,6)对无花果蛋白酶的萃取效果
如图1所示,[C4mim]Cl体系中酶活回收率在K2HPO4质量浓度为0.25—0.45 g/mL 范围内均高于[C2mim]Cl和[C6mim]Cl体系。从理论方面来讲,延长离子液体侧烷基链,可提高其疏水性,有利于蛋白质选择性分配至其中[13]。然而研究发现,侧烷基链过长在一定程度上破坏了无花果蛋白酶的活性[12],故舍去[C6mim]Cl体系。

图1 离子液体类型和K2HPO4质量浓度对无花果蛋白酶萃取效果的影响
比较[C2mim]Cl和[C4mim]Cl体系发现,同等盐质量浓度下,[C4mim] Cl体系中无花果蛋白酶酶活回收率和纯化倍数均较高,表明该体系对无花果蛋白酶的选择性较好。分析[C4mim]Cl体系中盐质量浓度对蛋白酶萃取效果,可看出K2HPO4质量浓度低于0.25 g/mL时,未形成双水相,之后随着K2HPO4的增加,酶活回收率和纯化倍数也随之升高,当质量浓度达0.35 g/mL时,酶活回收率和纯化倍数达到最高,分别为93.11%和1.56。因此,选择[C4mim]Cl体系、0.35 g/mL K2HPO4为中心实验值。
2.2 离子液体[C4mim]Cl质量浓度对无花果蛋白酶萃取效果的影响
由图2所示,双水相体系中在相同K2HPO4质量浓度条件下,无花果蛋白酶活回收率和纯化倍数随着[C4mim]Cl质量浓度增加表现为上升趋势。当[C4mim]Cl质量浓度为0.30 g/mL时,酶活回收率和纯化因子均达到最大,分别为91.4%和1.70,此后继续添加[C4mim]Cl,酶活回收率和纯化倍数逐渐下降。因此,选取质量浓度为0.30 g/mL[C4mim]Cl为中心实验值。

图2 [C4mim]Cl质量浓度对无花果蛋白酶萃取效果的影响
2.3 酶添加量对无花果蛋白酶分配行为的影响
如图3所示,在无花果蛋白酶添加量为2.0 mg/mL时,由于体系需分配的蛋白质未达到体系最大分配值,故酶活回收率和纯化倍数均较低;随着无花果蛋白酶添加量的继续增加,酶活回收率和纯化倍数也随之不断升高,在酶添加量为3.0 mg/mL,酶活回收率达到最大为91.28%;因此,酶添加量3.0 mg/mL为中心实验值。
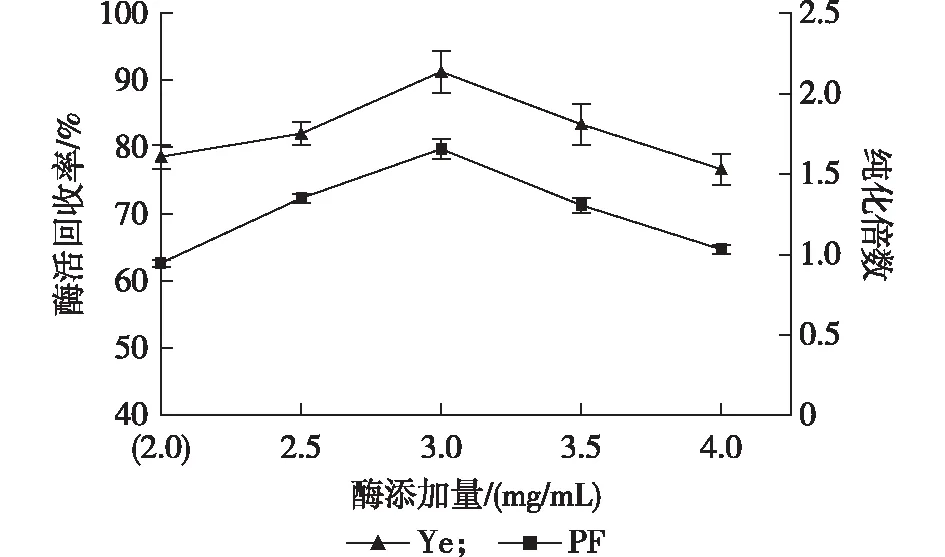
图3 酶添加量对无花果蛋白酶萃取效果的影响
2.4 pH值对无花果蛋白酶分配行为的影响
由图4所示,在选取的pH范围内,酶活回收率和纯化倍数变化趋势一致,均为先增加后减少。当pH 9.0时,两者达到最大分别为92.19%和1.72。综合考虑,选择pH值9.0为中心实验值。
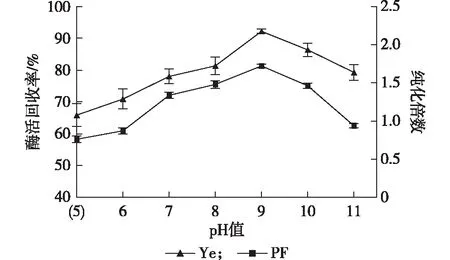
图4 pH值对无花果蛋白酶萃取效果的影响
2.5 响应面试验优化结果
通过Design expert软件中Box-Behnken模块对单因素试验结果中影响无花果蛋白酶纯化效果较为显著的离子液体质量浓度、K2HPO4质量浓度、酶添加量及pH值进行试验,以酶回收率和纯化倍数为响应值,试验设计及结果分析见表2。
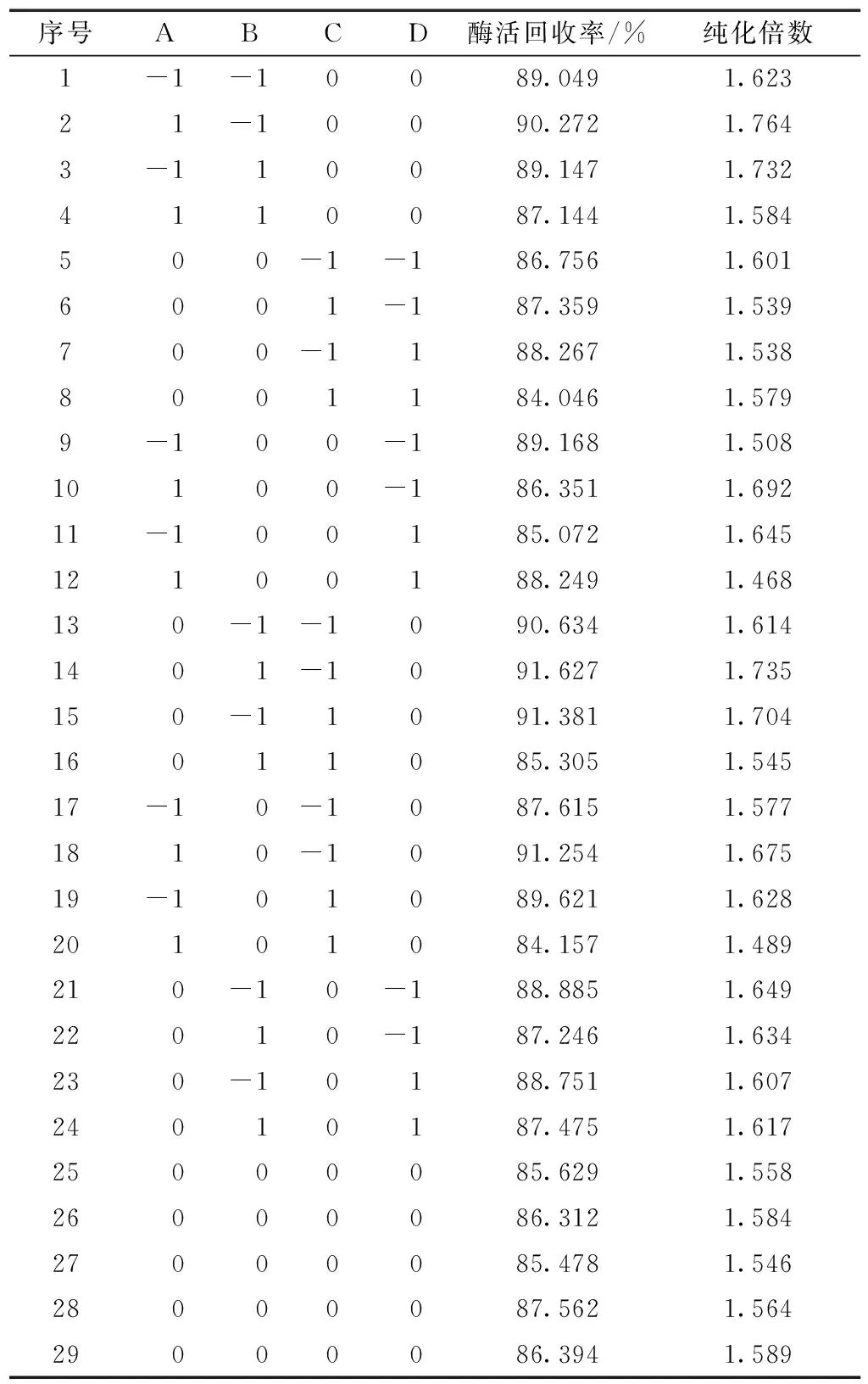
表2 响应面试验方案与结果
对表2所示数据进行二次多元回归分析,分别得到酶活回收率(Ye)和纯化倍数(PF)对离子液体质量浓度(A)、K2HPO4质量浓度(B)、酶添加量(C)及pH值(D)的二次多元回归方程:
Ye=86.27-0.19A-0.92B-1.19C-0.33D-0.81
AB-2.28AC+1.50AD-1.77BC+0.091BD-
1.21CD+0.88A2+2.11B2+1.00C2-0.30D2
(1)
PF=1.57-0.003 4A-0.009 5B-0.02 1C-
0.014D-0.072AB-0.059AC-0.090AD-
0.070BC+0.006 25BD+0.026CD+0.025A2+
0.077B2+0.004 4C2-0.014D2
(2)
方程(1)和(2)的相关系数(R2)分别为94.04%和96.79%,表明模型拟合度良好。对所得响应值数据进行方差分析,结果见表3,4。以酶活回收率(Ye)和纯化倍数(PF)为响应值的2个模型P值<0.000 1,表明所得回归方程的F检验极显著;失拟项均表现为不显著(PYe=0.713 8;PPF=0.066 1。P>0.05),表明方程拟合度很好。通过比较回归方程中一次项系数的绝对值,判定试验因素的影响主次性,各因素对无花果蛋白酶活回收率的影响顺序为:酶添加量、K2HPO4质量浓度、pH值及离子液体质量浓度;对蛋白酶纯化倍数的影响顺序:酶添加量、pH值、K2HPO4质量浓度和离子液体质量浓度。从表3,4分析结果看出,所选因素水平中,B,C,AB,AC,AD,BC,BD,CD,A2,B2和C2对Ye值影响显著,C,D,AB,AC,AD,CD,A2和B2对PF值影响显著。通过已建立的模型设定目标响应值Ye值和PF值最大,得到模型预测的最优条件是:[C4mim]Cl 为 0.35 g/mL,K2HPO4质量浓度为 0.3 g/mL,酶添加量为 2.5 mg/mL,pH为 8.5。为检验模型预测条件的可靠性,以预测条件进行3次平行验证试验,得到实验值Ye为 92.64%,PF为1.81,与预测值(Ye为92.29%,PF为1.83),偏差分别为0.38%和1.09%,表明预测值与实验值一致性较好。
3 讨论与结论
无花果蛋白酶是广泛存在于无花果茎、叶和果实中的一类活性中心为半胱氨酸的肽链内切酶,具有活性高、稳定性好等优点,被应用于食品和医疗卫生等领域[8]。目前已报道的分离纯化无花果蛋白酶的方法有盐析法、乙醇法、单宁法和柱层析法等,然而这些方法存在诸如提取效率低、纯度低等局限性[8,12]。离子液体双水相法是利用新型绿色溶剂、无机盐和水形成分离效果好且温和的分离体系,近年来被用于蛋白质、酶等活性物质的分离纯化[13]。本研究分析[Cnmim]Cl(n=2,4,6)-K2HPO4离子液体双水相法萃取无花果蛋白酶效果,结果显示在[Cnmim]Cl(n=2,4,6)体系中,无花果酶活回收率和纯化倍数均随盐浓度的增加呈先上升后下降的趋势,这与王伟涛等[10]在利用离子液体双水相纯化木瓜蛋白酶所得结果一致,分析原因可能是盐析作用是形成双水相的主要原因,随着盐浓度的增加促进了盐析作用的增强,有利于无花果蛋白酶分配于上相,然而盐浓度的增加同时会与上相竞争水分,导致上相黏度增加,不利于无花果蛋白酶的转移。离子液体是双水相体系组成的一部分,其浓度的大小影响提取效率,本研究显示当离子液体质量浓度<0.3 g/mL时,随着离子液体质量浓度的增大,蛋白酶提取率也逐渐增大;然而离子液体质量浓度超过0.3 g/mL时,会使蛋白质在相间的传递和扩散受阻,不利于无花果蛋白酶进入离子液体相,进而引起酶活回收率和纯化倍数明显下降[14]。

表3 响应值为酶活回收率(Ye)的方差分析
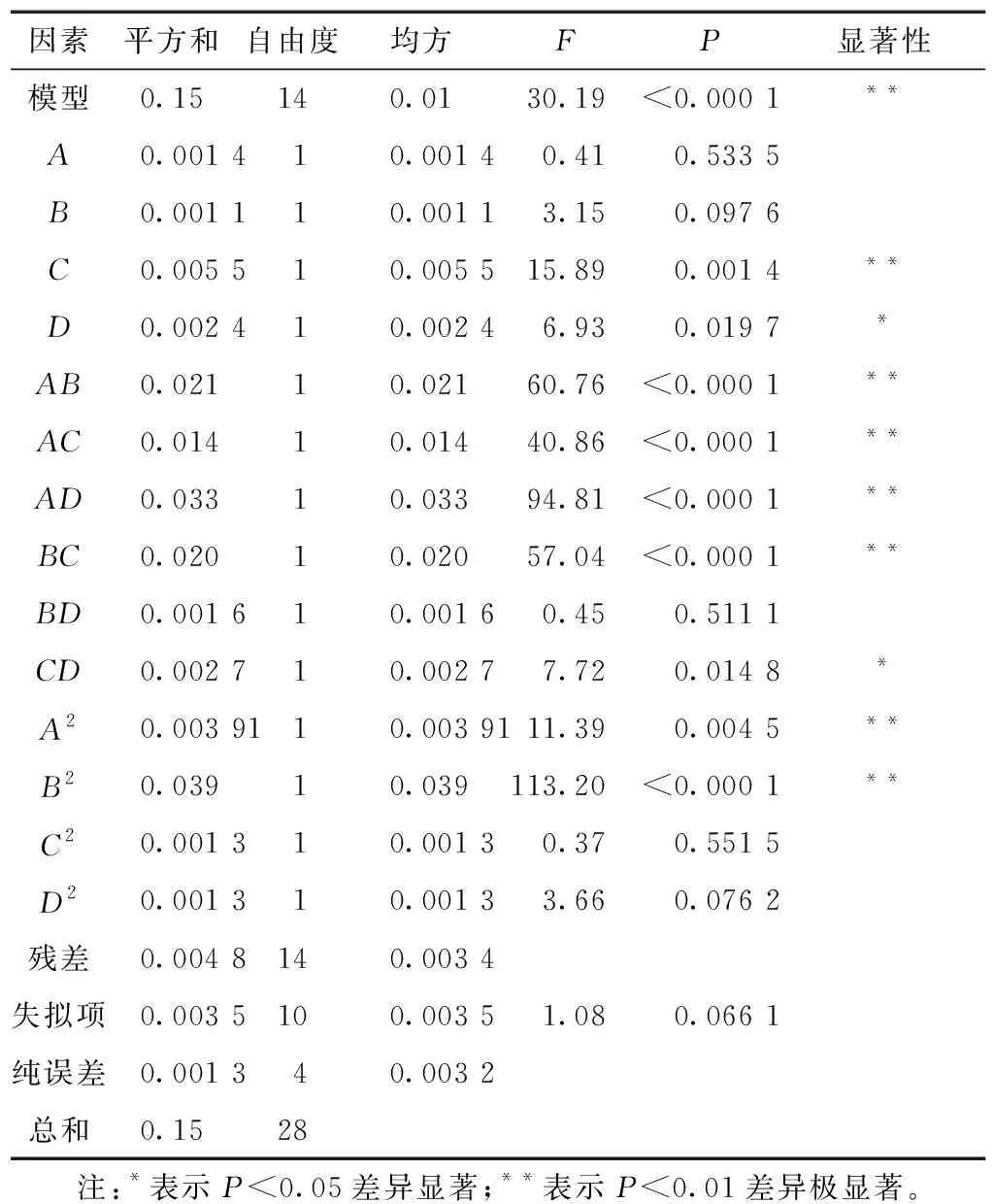
表4 响应值为纯化倍数(PF)的方差分析
无花果蛋白酶在离子液体双水相体系的分配还受酶添加量的影响,施娅楠等[15]利用[C4mim]Br/K2HPO4提取辣木叶凝乳酶时发现,酶添加量超过20 mg/mL时,凝乳蛋白酶活回收率降低。本研究中亦出现相似结果,当酶添加量超过0.3 g/mL时,上相液出现微乳化现象,相界不明显,且酶活回收率和纯化倍数均下降,分析原因,可能是酶加入量超过上相体系承载量后,多余的酶被分配于两相之间,不利于相界面的分离,引起酶活回收率下降。
体系pH值是影响萃取效率的另一重要因子。本研究中当体系pH值在8—10时,分离效果较好。无花果蛋白酶为两性分子,其带电状态受体系pH值和蛋白质本身等电点的影响,无花果蛋白酶的等电点约为9.0,当pH值与等电点接近时对蛋白质的分配行为影响最小,而两者相差过大时,引起离子液体咪唑分子与蛋白质之间的静电作用发生变化,进而影响了蛋白质在两相中分配。
响应面法通过对过程的回归拟合和响应曲面值的绘制寻找最佳组合条件的方法,广泛应用于工艺优化研究,本研究基于单因素试验结果结合响应面法,通过已建立的模型设定目标响应值Ye值和PF值最大,得到无花果蛋白酶纯化最优条件:0.35 g/mL [C4mim]Cl,0.3 g/mL K2HPO4,2.5 mg/mL酶添加量,pH值8.5。在此条件下酶活回收率和纯化倍数分别为92.64%和1.81,与预测值具有较好的一致性。

