含氯消毒剂在2020年高考中的考查
◇ 董 顺 邱 萍
氯及其化合物是中学化学中元素化合物知识的重要组成部分,2020年新冠肺炎疫情期间含氯消毒剂在环境杀菌消毒方面发挥了重要的作用,2020年高考试题中涉及含氯消毒剂的知识较多,本文将2020年高考试题中涉及含氯消毒剂部分知识进行剖析,希望对同学们的复习备考有帮助.
1 以含氯消毒剂的使用原理为载体考查
例1(全国卷Ⅱ)化学工业为疫情防控提供了强有力的物质支撑.氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂.回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图1-甲所示的装置来制取.装置中的离子膜只允许_________离子通过,氯气的逸出口是_________(填标号).

图1
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=,X为HCl O或Cl O-]与pH的关系如图1-乙所示.HCl O的电离常数Ka值为_________.
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的Hg O和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应).上述制备Cl2O的化学方程式为_________.
(4)Cl O2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂.一种有效成分为NaCl O2、Na HSO4、Na HCO3的“二氧化氯泡腾片”,能快速溶于水,逸出大量气泡,得到Cl O2溶液.上述过程中,生成Cl O2的反应属于歧化反应,每生成1 mol Cl O2消耗NaCl O2的量为_________mol;产生“气泡”的化学方程式为________.
(5)“84消毒液”的有效成分为NaCl O,不可与酸性清洁剂混用的原因是________(用离子方程式表示).工业上将氯气通入30%的NaOH溶液中来制备NaCl O溶液,若NaCl O溶液中NaOH的质量分数为1%,则生产1 000 kg该溶液需消耗氯气的质量为______kg(保留整数).

(1)阳极氯离子失电子发生氧化反应生成氯气,氯气从a口逸出,阴极H2O电离产生的H+得到电子发生还原反应生成H2,产生OH-与通过离子膜的Na+在阴极室得到产品NaOH.
(2)由图1-乙可知,pH=7.5时,c(HCl O)=c(Cl O-),此时HCl O的

(3)Cl2可歧化为Cl2O和Cl-,所以HgO和氯气反应的方程式为


(5)“84消毒液”中的NaCl O、NaCl和酸性清洁剂混合后发生归中反应,离子方程式为

设氯气的质量为x,原NaOH溶液的质量为(1 000-x)kg,溶液中剩余NaOH的质量为10 kg,则有

【说明】本题以Cl2、HClO、Cl2O、ClO2等含氯消毒剂的性质和制备原理为载体,考查了电解原理、电离平衡、氧化还原反应等知识的综合应用,内容主要来自课本的基础知识,解答最后一问的关键是要寻找等量关系,给我们的启示是要重视基础,重视回归课本.
将“84消毒液”与洁厕灵混用引起的中毒事件在新闻中常有报道.2020年3月1日,湖北黄梅县22人误食“二氧化氯泡腾片”的新闻再度登上热搜.本题涉及“二氧化氯泡腾片”相关知识及“84消毒液”不可与酸性清洁剂混用等考点,体现了“科学态度与社会责任”化学学科核心素养.
2 以含氯消毒剂的制备为载体考查
例2(全国卷Ⅲ)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域.实验室中利用图2装置(部分装置省略)制备KCl O3和NaCl O并探究其氧化还原性.

图2
回答下列问题:
(1)盛放Mn O2粉末的仪器名称是_________,a中的试剂为________.
(2)b中采用的加热方式是_________,c中化学反应的离子方程式是_____________,采用冰水浴冷却的目的是_________.
(3)d的作用是________,可选用试剂________(填标号).
A.Na2S B.NaCl
C.Ca(OH)2D.H2SO4
(4)反应结束后,取出b中试管,经冷却结晶,________,________,干燥,得到KCl O3晶体.
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液.1号试管溶液颜色不变.2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显_________色.可知该条件下KCl O3的氧化能力____NaCl O(填“大于”或“小于”).

本实验目的是制备KCl O3和NaCl O,并要探究其氧化还原性;首先利用浓盐酸和Mn O2粉末共热制取氯气,生成的氯气中混有HCl气体,可在装置a中盛放饱和食盐水将HCl气体除去;然后使氯气与KOH溶液在水浴加热的条件下发生反应制备KCl O3,再与NaOH溶液在冰水浴中反应制备NaCl O;氯气有毒会污染空气,所以需要d装置吸收未反应的氯气.
(1)根据盛放Mn O2粉末的仪器结构可知该仪器为圆底烧瓶;a中盛放饱和食盐水除去氯气中混有的HCl气体.
(2)由装置图中给出的试剂可知b中得到KCl O3,c中得到NaCl O.将盛有KOH溶液的试管放在盛有水的大烧杯中加热,该加热方式为水浴加热;c中氯气在NaOH溶液中发生歧化反应生成氯化钠和次氯酸钠,离子方程式为Cl2+2OH-=ClO-+Cl-+H2O;根据氯气与KOH溶液的反应可知,加热条件下氯气可以与强碱溶液反应生成氯酸盐,所以采用冰水浴的目的是避免生成NaCl O3.
(3)氯气有毒,所以d装置的作用是吸收尾气.Na2S溶液可以与氯气反应生成氯化钠,可以吸收氯气,选项A可选;氯气在NaCl溶液中溶解度很小,选项B不可选;氯气可与Ca(OH)2悬浊液反应生成氯化钙和次氯酸钙,选项C可选;氯气与硫酸不反应,若为硫酸溶液,大量氢离子的存在会降低氯气的溶解度,选项D不可选.答案为A、C.
(4)b的试管中为KCl O3和KCl的混合溶液,KCl O3的溶解度受温度影响更大,所以将试管b中的混合溶液冷却结晶、过滤、少量(冷)水洗涤、干燥,得到KCl O3晶体.
(5)1号试管溶液颜色不变,2号试管溶液变为棕色,说明1号试管中氯酸钾没有将碘离子氧化,2号试管中次氯酸钠将碘离子氧化成碘单质,即该条件下KCl O3的氧化能力小于NaCl O;碘单质更易溶于CCl4,所以加入CCl4振荡,静置后CCl4层显紫色.
【说明】本题以氯气的制备及氯气与碱在不同温度下发生的反应为载体考查实验仪器的识别、气体的净化、方程式的书写、尾气处理、实验现象的分析等,该试题体现了条件控制对化学反应的重要作用、绿色化学的思想及证据推理与模型认知化学学科核心素养.
解答该类试题应注意以下几点:
1)明确实验目的和实验原理;
2)根据实验原理合理选择试剂;
3)根据实验试剂和原理设计实验步骤和装置;
4)关注绿色化学思想.
3 以含氯消毒剂为原料制备其他物质为载体考查
例3(山东卷,节选)某同学利用Cl2氧化K2Mn O4制备KMn O4的装置如图3所示(夹持装置略).

图3
已知:锰酸钾(K2Mn O4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:

回答下列问题:
(1)装置A中a的作用是________;装置C中的试剂为_________;装置A中制备Cl2的化学方程为_________.
(2)上述装置存在一处缺陷,会导致KMn O4产率降低,改进的方法是_________.
(3)KMn O4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入________(填“酸式”或“碱式”)滴定管中;在规格为50.00 mL的滴定管中,若KMnO4溶液起始读数为15.00 mL,此时滴定管中KMn O4溶液的实际体积为_________(填标号).
A.15.00 mL B.35.00 mL
C.大于35.00 mL D.小于15.00 mL

漂白粉的有效成分为Ca(ClO)2,具有强氧化性,和浓盐酸在A中发生归中反应产生Cl2,Cl2和K2Mn O4在B中反应产生KMn O4,未参与反应的Cl2用装置C吸收.
(1)装置A为恒压分液漏斗,它的作用是平衡气压,使浓盐酸能顺利滴下,装置C的作用是吸收剩余的Cl2(可用NaOH溶液吸收),Ca(ClO)2和浓盐酸在A中发生归中反应产生Cl2,反应的化学方程式为
Ca(Cl O)2+4 HCl=CaCl2+2Cl2↑+2H2O.
(2)锰酸钾在浓强碱溶液中可稳定存在,碱性减弱时容易发生反应Mn O2↓+4OH-,一部分转化为Mn O2,导致最终KMn O4的产率低,而浓盐酸易挥发,直接导致B中NaOH溶液的浓度减小,故改进措施是在装置A、B之间加装盛有饱和食盐水的洗气瓶,用来吸收挥发出来的HCl.
(3)高锰酸钾有强氧化性,强氧化性溶液加入酸式滴定管,滴定管的“0”刻度在上方,规格为50.00 mL的滴定管中实际的体积大于(50.00-15.00)m L,即大于35.00 mL.
【说明】本题以用漂白粉与浓盐酸反应制备氯气,并用氯气氧化K2Mn O4制备KMn O4为载体考查实验分析与推理的基础知识.该方法制备氯气在鲁科版化学2第二章第三节的课后练习题有所涉及的歧化反应在2016年高考中已有涉及,因此课本和高考真题是最好的复习备考资料,要引起广大考生的重视.
4 以含氯消毒剂中有效氯含量的测定为载体考查
例4(江苏卷)次氯酸钠溶液和二氯异氰尿酸钠(C3N3O3Cl2Na)都是常用的杀菌消毒剂.NaClO可用于制备二氯异氰尿酸钠.
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得.制备NaCl O的离子方程式为_________;用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是________.
(2)二氯异氰尿酸钠优质品要求有效氯大于60%.通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准.实验检测原理为

准确称取1.120 0 g样品,用容量瓶配成250.0 mL溶液;取25.00 mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5 min;用0.100 0 mol·L-1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液20.00 mL.
①通过计算判断该样品是否为优质品________.(写出计算过程,该样品有效氯的计算方法为

②若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值_________(填“偏高”或“偏低”).

(1)由题意可知,氯气通入氢氧化钠中产生次氯酸钠和氯化钠,反应的离子方程式为Cl2+2OH-=Cl O-+Cl-+H2O;次氯酸钠溶液长期暴露在空气中会吸收空气中的二氧化碳气体,因为次氯酸酸性比碳酸弱,所以次氯酸钠可以与二氧化碳在水中反应生成HCl O,HCl O不稳定,在受热或见光条件下会发生分解反应,产生HCl和O2,从而使次氯酸钠失效.
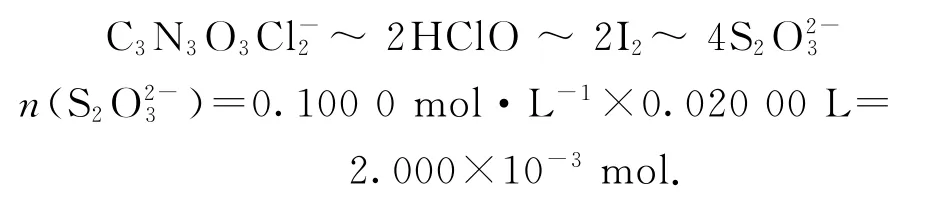
由上述关系式知

氯元素的质量:
该样品中的有效氯为
该样品中的有效氯含量大于60%,故该样品为优质品.
【说明】本题以次氯酸钠的制备及二氯异氰尿酸钠产品中有效氯含量的测定为载体考查次氯酸钠、次氯酸的性质及氧化还原滴定和根据关系式法的计算.滴定分析法是近年高考中的热点,几乎每年高考试题中均有涉及,应加强对往年高考试题的研究,明确备考的针对性和有效性.
含氯消毒剂是2020年高考关注的焦点之一,在高考试题中多处体现,但纵观各高考试题所考查的还是必备知识和关键能力,体现的还是化学学科核心素养.因此,高考备考不仅仅是眼前的知识点,更要关注关键能力和核心素养.

