新高考载体
——4种含硫化合物
◇ 李宏华
目前的高考命题很多试题都是以教材为载体,结合文献和实际需要提出综合性的探究课题,再根据假设提出多种探究方案,评价和优化方案.能用数据、图表、符号等处理实验信息,对实验中的“异常现象”和已有结论提出质疑、反思并提出新的实验设想,并进一步付诸实践,这是对学生学科素养培养的具体体现,另外对知识的迁移的考查也是当前高考考查能力的一种形式.
1 硫代硫酸钠(Na2S2O3)
1)物理性质:Na2S2O3·5H2O俗名大苏打,无色透明的晶体,易溶于水.
2)化学性质:
①与酸反应生成单质硫,放出SO2气体:

②中等强度的还原剂,能被I2、Cl2、KMnO4等氧化剂氧化:2Na2S2O3+I2=Na2S4O6+2NaI(用于定量测定碘);Na2S2O3+4Cl2+5 H2O=Na2SO4+H2SO4+8 HCl(在纺织和造纸工业上作脱氯剂);5Na2S2O3+8KMn O4+7 H2SO4=8MnSO4+5Na2SO4+4K2SO4+7 H2O.
3)制备方法:
①将Na2S和Na2CO3以2∶1的物质的量比配成溶液,然后通入SO2,制得Na2S2O3:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.
将溶液蒸发浓缩后,冷却至293~303 K时即析出Na2S2O3·5 H2O.
②在沸腾的状态下,使Na2SO3溶液与硫粉反应
例1(2020年浙江卷)硫代硫酸钠在纺织业等领域有广泛应用.某兴趣小组用图1所示装置制备Na2S2O3·5 H2O.
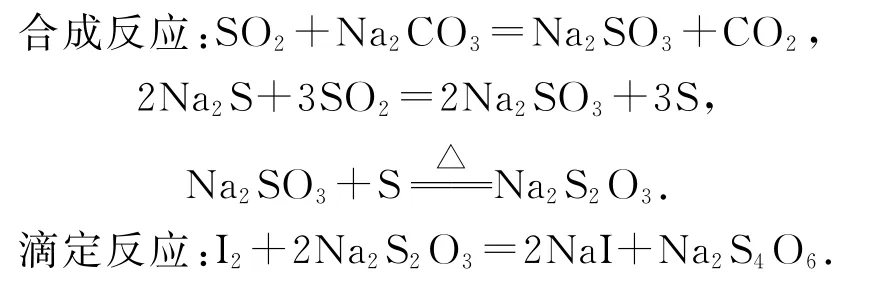

图1
已知:Na2S2O3·5 H2O易溶于水,难溶于乙醇,50℃开始失结晶水.
实验步骤:
Ⅰ.Na2S2O3的制备:装置A制备的SO2经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液pH约为7时,停止通入SO2气体,得混合溶液.
Ⅱ.产品分离提纯:混合溶液经蒸发浓缩、冷却结晶、过滤洗涤、干燥,得到Na2S2O3·5H2O产品.
Ⅲ.产品纯度测定:以淀粉作指示剂,用Na2S2O3·5H2O配制的溶液滴定碘标准溶液至滴定终点,计算Na2S2O3·5H2O含量.
请回答:
(1)步骤Ⅰ:单向阀的作用是_________;装置C中的反应混合溶液pH过高或过低将导致产率降低,原因是_________.
(2)步骤Ⅱ:下列说法正确的是________.
A.快速蒸发溶液中水分,可得较大晶体颗粒
B.蒸发浓缩至溶液表面出现晶膜时,停止加热
C.冷却结晶后的固液混合物中加入乙醇可提高产率
D.可选用冷的Na2CO3溶液作洗涤剂
(3)步骤Ⅲ:
①滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):检漏→蒸馏水洗涤→( )→( )→( )→( )→( )→开始滴定.
A.烘干
B.装入滴定液至零刻度以上
C.调整滴定液液面至零刻度或零刻度以下
D.用洗耳球吹出润洗液
E.排出气泡
F.用滴定液润洗2~3次
G.记录起始读数
②装标准碘溶液的碘量瓶(带瓶塞的锥形瓶)在滴定前应盖上瓶塞,目的是________.
③滴定法测得产品中Na2S2O3·5 H2O含量为100.5%,则Na2S2O3·5H2O产品中可能混有的物质是______.

本实验的目的是制备Na2S2O3·5 H2O,首先装置A中利用浓硫酸和亚硫酸钠固体反应生成二氧化硫,将SO2通入装置C中的混合溶液,加热搅拌,结合题目所给合成反应可知,使用单向阀可以防止倒吸;为了使Na2CO3、Na2S充分反应,同时又不能因酸性过强使Na2S2O3发生歧化反应,因此调节溶液的pH约为7时,停止通入SO2气体,得到产品的混合溶液;之后经蒸发浓缩、冷却结晶、过滤洗涤、干燥得到产品,由于Na2S2O3·5H2O难溶于乙醇,冷却结晶后可以加入适量乙醇降低Na2S2O3的溶解度,析出更多的晶体.
(1)SO2会与装置C中混合溶液发生反应,且导管进入液面以下,需要防倒吸的装置,单向阀可以防止发生倒吸;Na2CO3、Na2S水解都会使溶液显碱性,所以pH过高,说明Na2CO3、Na2S反应不充分;而pH过低,又会导致Na2S2O3发生歧化反应转化为S和SO2,所以pH过高或过低都会导致产率降低.
(2)蒸发结晶时,快速蒸发溶液中的水分,可以得到较小的晶体颗粒,故选项A错误;为防止固体飞溅,蒸发浓缩至溶液表面出现晶膜时,停止加热,选项B正确;Na2S2O3·5H2O难溶于乙醇,所以冷却结晶后的固液混合物中可以加入适量乙醇降低Na2S2O3的溶解度,析出更多的晶体,提高产率,选项C正确;用碳酸钠溶液洗涤会使晶体表面附着碳酸钠杂质,Na2S2O3·5 H2O难溶于乙醇,可以用乙醇作洗涤剂,选项D错误.
(3)①滴定前应检查滴定管是否漏液,之后用蒸馏水洗涤滴定管,为防止稀释滴定液使测定结果不准确,需用滴定液润洗2~3次,之后装入滴定液至零刻度以上,排除装置中的气泡,然后调整滴定液液面至零刻度或零刻度以下,并记录起始读数,开始滴定,所以正确的操作和顺序为:检漏→蒸馏水洗涤→F→B→E→C→G→开始滴定;②碘容易挥发,所以盛有标准碘溶液的碘量瓶在滴定前应盖上瓶塞,防止碘挥发损失;③测定的产品中Na2S2O3·5 H2O的质量分数大于100%,说明产品中混有失去部分结晶水的Na2S2O3·5 H2O.
【变式】(2018年全国卷Ⅲ)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)可用作定影剂、还原剂.回答下列问题:
(1)已 知:Ksp(BaSO4)=1.1×10-10,Ksp(BaS2O3)=4.1×10-5.市售硫代硫酸钠中常含有杂质,选用下列试剂设计实验方案(如表1)进行检验.
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液.
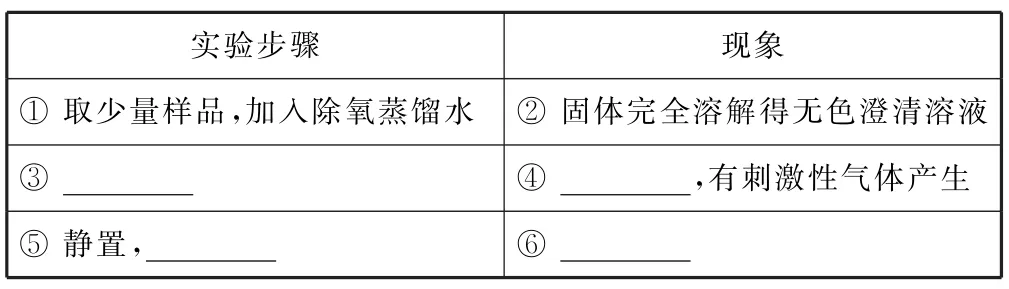
表1
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度.测定步骤如下.
①溶液配制:称取1.200 0 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在_________中溶解,完全溶解后,全部转移至100 mL的________中,加蒸馏水至_________.
②滴定:取0.009 50 mol·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应:.然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+.加入淀粉溶液作为指示剂,继续滴定,当溶液___________,即为终点.平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为___________%(保留1位小数).

(2)①配制一定物质的量浓度的溶液,应先称量固体物质的质量,在烧杯中溶解,再转移至容量瓶,最后定容即可.所以配制过程为:将固体在烧杯中溶解,全部转移至100 mL容量瓶,加蒸馏水至刻度线定容.②淡黄绿色溶液中有单质碘,加入淀粉作为指示剂,溶液显蓝色,用Na2S2O3溶液滴定单质碘,滴定终点时溶液的蓝色褪去.根据题给的离子方程式得到如下关系式,则配制的100 mL样品溶液中Na2S2O3的浓度为含有的Na2S2O3为0.004 597 mol,所以样品纯度为
2 过二硫酸钠(Na2 S2O8)
1)氧化性:Na2S2O8中S元素为+6价,含有1个过氧键,性质与过氧化氢相似.作为氧化剂参与反应时,过氧键断裂,过氧键中的O原子由-1价变为-2价,S原子化合价不变,如

2)不稳定性:Na2S2O8易受热分解生成Na2SO4、SO3和O2.
例2过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的Na OH溶液混合可制得Na2S2O8晶体,同时还会放出氨气.某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体,装置如图2所示.
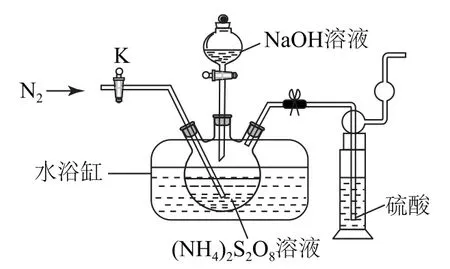
图2
已知:反应过程中发生的副反应为
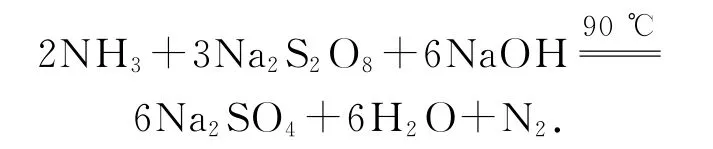
(1)图中装有NaOH溶液的仪器的名称为_________,反应过程中持续通入氮气的目的是_________.
(2)(NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:_________.
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:_________.
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱.将MnSO4·H2O(1.69 g)与过量Na2S2O8(10 g)溶于水中形成的混合溶液煮沸3 min,观察并记录加入试剂时和加热过程中的现象(如表2所示).
①在_________(填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强.
②中性氧化时,会产生大量气泡,其原因为_________.
③若用0.1 mol·L-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为________;达到滴定终点时,消耗H2O2溶液的体积为V1mL.则碱性氧化后的溶液中Na Mn O4的质量为________g(用含V1的代数式表示

表2

(1)图中装有NaOH溶液的仪器的名称为分液漏斗.分析可知,为防止NH3被氧化,应将生成的NH3从反应装置内尽快排出,所以反应过程中持续通入氮气的目的是将三颈烧瓶中产生的NH3及时排出,减少副反应的发生.
(3)另一种常温下为液态且具有强氧化性的物质应为H2O2,则最终仅生成H2SO4、Na2SO4和H2O2,该反应的化学方程式为Na2S2O8+2H2O=H2SO4+Na2SO4+H2O2.
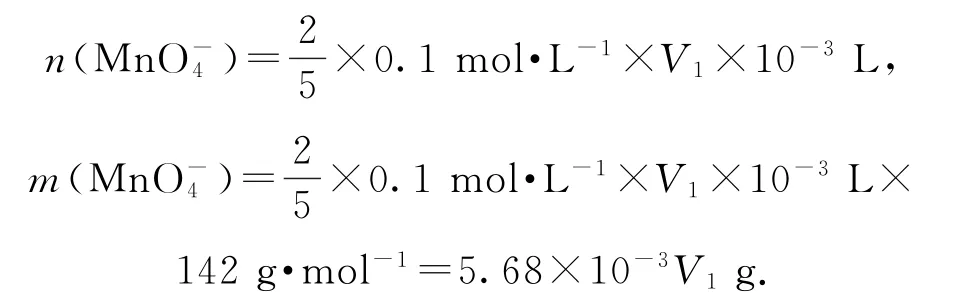
【变式】过二硫酸钠(Na2S2O8)具有强氧化性,在印染、造纸和医学等方面应用广泛.利用电解制备过二硫酸钠的装置如图3所示(a、b均为惰性电极).下列说法正确的是( ).

图3
A.过二硫酸钠中的硫元素呈+7价
B.电极a是电解池的阴极
D.所用离子交换膜为阴离子交换膜

过二硫酸钠中存在一个过氧链,硫元素呈+6价,选项A错误;电解Na2SO4水溶液可以得到Na2S2O8,发生反应为因此电极a是电解池的阳极,选项B错误;电极a的电极反应式为,选项C正确;b电极是阴极,H+放电,右侧产生OH-,所用离子交换膜为阳离子交换膜,选项D错误.答案为C.
3 连二亚硫酸钠(Na2S2O4)
1)加热时分解,能溶于冷水,在热水中易分解,不溶于乙醇.其水溶液性质不稳定,有极强的还原性,属于强还原剂,能将I2、Cu2+、Ag+还原.
2)暴露于空气中易吸收氧气而氧化,同时也易吸潮发热而变质,能夺取空气中的氧而结块并发出刺激性酸味.吸收空气中氧气的反应方程式为2Na2S2O4+O2+2H2O=4Na HSO3或Na2S2O4+O2+H2O=Na HSO3+Na HSO4.
3)在无氧条件下,用锌粉还原亚硫酸氢钠可制得连二亚硫酸钠.
例3(2019年海南卷,节选)连二亚硫酸钠(Na2S2O4·2 H2O),俗称保险粉,易溶于水,常用于印染、纸张漂白等.回答下列问题:
(1)Na2S2O4中S元素的化合价为_________.
(2)向锌粉的悬浮液中通入SO2,制备ZnS2O4,生成1 mol ZnS2O4,反应中转移的电子为_________mol;向ZnS2O4溶液中加入适量Na2CO3,生成Na2S2O4并有沉淀产生,该反应的化学方程式为_____.

(1)根据化合物中正负化合价代数和为0的原则,在Na2S2O4中Na元素为+1价,O元素为-2价,所以S元素化合价为+3.
(2)向锌粉的悬浮液中通入SO2,制备ZnS2O4,反应前Zn为单质中的0价,反应后变为ZnS2O4中的+2价,所以每生成1 mol ZnS2O4,反应中转移2 mol电子;向ZnS2O4溶液中加入适量Na2CO3,生成Na2S2O4并有ZnCO3沉淀产生,则该反应的化学方程式为Na2CO3+ZnS2O4=Na2S2O4+ZnCO3↓.
【变式】广泛用于纺织工业的连二亚硫酸钠(Na2S2O4),俗称保险粉,是一种强还原剂,可溶于水,但不溶于乙醇,在碱性介质中较稳定.
Ⅰ.工业上制备保险粉的流程如图4所示.
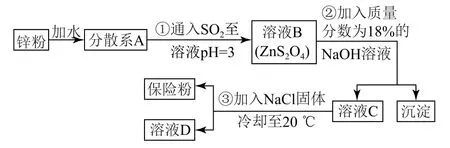
图4
(1)步骤①中发生反应的化学方程式为_________________.
(2)步骤②中生成的沉淀为_________(填化学式).
(3)步骤③中加入NaCl固体的作用是_____________,分离出保险粉的方法为_________、洗涤、干燥,洗涤所用试剂是_________.
Ⅱ.工业上也可用如图5所示装置电解Na HSO3溶液制备Na2S2O4.
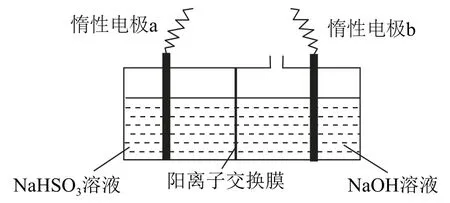
图5
(4)惰性电极a连接电源的_________(填“正极”或“负极”),其电极反应式为________.
(5)若不加阳离子交换膜,则得不到Na2S2O4,其原因是________.

(1)由流程可知,步骤①中,反应物为Zn和SO2,生成物为ZnS2O4,据此可得化学方程式为Zn+2SO2=ZnS2O4.
(2)步骤②中,ZnS2O4和NaOH发生反应生成Zn(OH)2沉淀和Na2S2O4.
(3)溶液C中的溶质为Na2S2O4,步骤③中加入NaCl固体,即得到保险粉(Na2S2O4),NaCl固体的作用是降低Na2S2O4的溶解度,使更多Na2S2O4析出.Na2S2O4析出后,经过滤、洗涤、干燥即可得到保险粉.由于保险粉可溶于水,不溶于乙醇,因此应使用乙醇进行洗涤.
(4)Na HSO3生成Na2S2O4,S元素化合价由+4降低到+3,发生还原反应,故电极a为阴极,连接电源负极,电极反应式为

(5)电极b为阳极,电极反应式为4OH--4e-=O2↑+2 H2O,若不加阳离子交换膜,Na2S2O4具有强还原性,易被阳极生成的O2氧化,因此得不到Na2S2O4.
4 焦亚硫酸钠(Na2S2O5)
1)重要性质
又称二硫五氧酸钠,成品为白色或微黄结晶粉末,溶于水、甘油,微溶于乙醇,露置空气中易氧化成硫酸钠,与强酸接触放出二氧化硫而生成相应的盐类,加热到150℃分解,
2)制备方法
通常用Na HSO3过饱和溶液经结晶脱水制得,其化学方程式为2Na HSO3=Na2S2O5+H2O.
例4(2018年全国卷Ⅰ)焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛.回答下列问题:
(1)生产Na2S2O5,通常是由Na HSO3过饱和溶液经结晶脱水制得.写出该过程的化学方程式______.
(2)利用烟道气中的SO2生产Na2S2O5的工艺如图6所示.
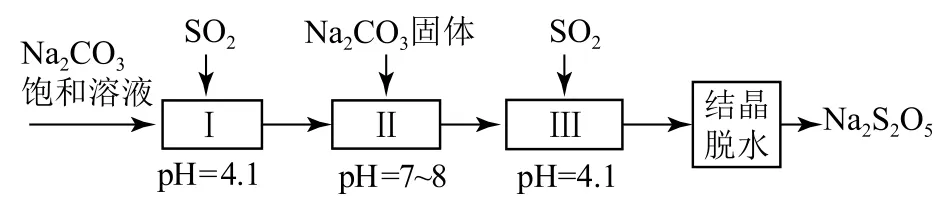
图6
①pH=4.1时,Ⅰ中为______溶液(写化学式).
②工艺中加入Na2CO3固体,并再次充入SO2的目的是_________.
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图7所示,其中SO2碱吸收液中含有Na HSO3和Na2SO3.阳极的电极反应式为_________.电解后,________室的Na HSO3浓度增加.将该室溶液进行结晶脱水,可得到Na2S2O5.
(4)Na2S2O5可用作食品的抗氧化剂.在测定某葡萄酒中Na2S2O5的残留量时,取50.00 mL葡萄酒样品,用0.010 00 mol·L-1的碘标准液滴定至终点,消耗10.00 mL.滴定反应的离子方程式为_________________,该样品中Na2S2O5的残留量为_______g·L-1(以SO2计).
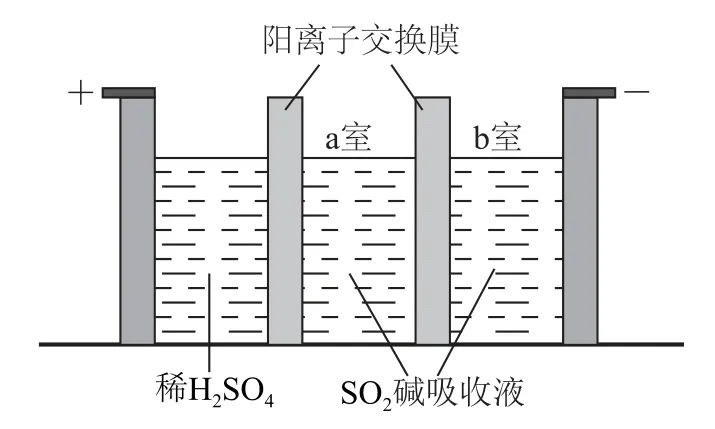
图7

(1)根据题给信息,亚硫酸氢钠过饱和溶液脱水生成焦亚硫酸钠,根据原子守恒可知反应的方程式为2Na HSO3=Na2S2O5+H2O.
(2)①Na2CO3饱和溶液吸收SO2后的溶液显酸性,说明生成物是酸式盐,即Ⅰ中为Na HSO3;②要制备焦亚硫酸钠,需要制备亚硫酸氢钠过饱和溶液,因此工艺中加入碳酸钠固体并再次充入SO2的目的是得到Na HSO3过饱和溶液.
(3)阳极发生失去电子的氧化反应,阳极区是稀硫酸,OH-放电,电极反应式为2 H2O-4e-=4H++O2↑.阳极区H+增大,通过阳离子交换膜进入a室与亚硫酸钠结合生成Na HSO3.阴极是H+放电,OH-浓度增大,与Na HSO3反应生成Na2SO3,所以电解后a室中Na HSO3的浓度增大.
(4)根据电子、电荷及质量守恒,可写出反应的离子方程式为

随着高考改革的不断深入,高考命题会结合生产、生活实际,以氧、硫元素及其化合物之间的转化关系为载体,考查物质的制备、性质的探究等,实验探究题近几年出现频率极高,主要将教材实验进行创新并结合文献及实际需要提出综合性的探究课题,结合实验基本操作、数据分析和处理等知识综合考查.以后的高考也可能会结合绿色化学、环境保护等来命题,以凸显对化学学科核心素养“科学态度与社会责任”和“科学探究与创新意识”的检测.

