纺织品中百菌清残留量的气相色谱/串联质谱法测定
刘彩明 王成云 郭会清 林君峰 邹慧萍 谢堂堂
1. 深圳市检验检疫科学研究院 (中国) 2. 郑州海关 技术中心 (中国) 3. 深圳海关 工业品检测技术中心 (中国)
百菌清与真菌细胞中的甘油醛-3-磷酸脱氢酶(含有L-半胱氨酸的蛋白质)结合,可使该酶失去氧化还原作用,从而破坏真菌细胞的新陈代谢,导致真菌细胞死亡。因此,百菌清具有良好的杀菌性能[1]。在农业上,大量百菌清用作杀菌剂和水果的保鲜剂;在工业上,百菌清广泛用作纸张、皮革、涂料和面料等物品的防霉剂[2-3]。但百菌清本身是一种强致敏物,易引发迟发型变态反应性皮炎[4]。世界卫生组织国际癌症研究机构于2017年10月27日将其列入2B类致癌物清单。欧盟委员会于2019年4月29日签署法规(EU)2019/677,不再批准使用百菌清。已有大量相关文献报道了环境样品、皮革、涂料和食品等试样中百菌清的测定,但迄今为止,纺织品中百菌清残留量的测定法研究尚属空白。气相色谱/串联质谱(GC/MS-MS)具有基底干扰少、基线噪声低和灵敏度高等特点[5-6]。本文采用超声萃取技术提取纺织品中残留的百菌清,对提取液进行GC/MS-MS测定,从而建立了1种测定纺织品中百菌清残留量的气质联用分析方法,可用于市售纺织品中百菌清残留量的检测。
1 试验部分
1.1 仪器与试剂
6890A-7000B型三重四极杆气质联用仪(美国Agilent公司);QYB-3型自动制样机(中山市启元机械科技有限公司);AS5150BD型超声波清洗器(美国Auto Science公司);Buchi/R-215型旋转蒸发仪(瑞士Buchi公司);0.45 mm有机相针式滤器(尼龙)(德国CNW Technologies公司); EVA50氮吹仪(北京普力泰科仪器有限公司)。
百菌清标准样(德国Dr. Ehrenstorfer公司);色谱纯甲醇(美国Fisher Scientific公司);分析纯试剂(深圳市佳铭试剂有限公司)。先用色谱纯甲醇配制质量浓度为428 g/mL的百菌清标准储备液,然后用甲醇将其分别稀释至质量浓度为0.1、0.2、0.5、1.1、2.1、5.4、10.7和21.4 g/mL。
试验选用不含百菌清的白棉衬布、涤纶衬布、尼龙衬布和羊毛衬布为基材,采用浸渍-焙烘法自制了4种含有不同百菌清量的阳性试样,用于优化本研究的试验提取条件。
1.2 试样前处理
用自动制样机将试样裁成5 mm×5 mm的碎片,混匀后称取1.0 g试样,置于35 mL玻璃反应瓶中,加入30 mL乙酸乙酯,45 ℃下超声萃取35 min。用鸡心瓶收集萃取滤液,滤液用旋转蒸发仪在真空下旋蒸至近干燥,再用氮吹仪缓慢吹干。残留物用1 mL甲醇溶解,所得溶液经0.45 μm滤膜过滤后上机测试。
1.3 分析条件
1.3.1 色谱条件
进样口和传输线温度分别为270 ℃和280 ℃;载气为He,载气纯度大于99.999%,载气流速为1 mL/min;色谱柱为DB-5MS Ultra Inert (30 m×0.25 mm×0.25 μm);升温程序:初温90 ℃,恒温1 min后以40 ℃/min的速度升至290 ℃,恒温2 min;脉冲不分流进样,进样量为1.0 μL;溶剂延迟时间为3 min。
1.3.2 质谱条件
离子源温度为290 ℃,四极杆温度为150 ℃,氮气流速为1.5 mL/min,氦气流速为2.25 mL/min,电离方式为电子轰击(EI),电离能为70 eV,采用多反应离子监测(multiple reaction monitoring,MRM)模式,定性子离子对质荷比(m/z)为m/z266→m/z231,定量子离子对为m/z266→m/z266,驻留时间均为150 ms,碰撞电压均为15 V。
2 结果与讨论
2.1 分析条件的优化
在脉冲不分流进样条件下,影响质谱信号强度的3个因素分别是进样口温度(A)、离子源温度(B)和载气流速(C)。首先,单独考察因素A、B和C对质谱信号强度的影响,结果表明,当3个因素的设定值分别为260 ℃、280 ℃和1.2 mL时,百菌清的信号强度达最大。因此,本文采用正交试验,分别对不同条件下的百菌清标准溶液进行测试。百菌清溶液的峰面积测试结果如表1所示。根据表1中的数据计算各因素的极差,确定优化试验方案为A3B3C2,即进样口温度、离子源温度、载气流速分别为270 ℃、290 ℃和1.0 mL时,百菌清溶液有最大的峰面积值。
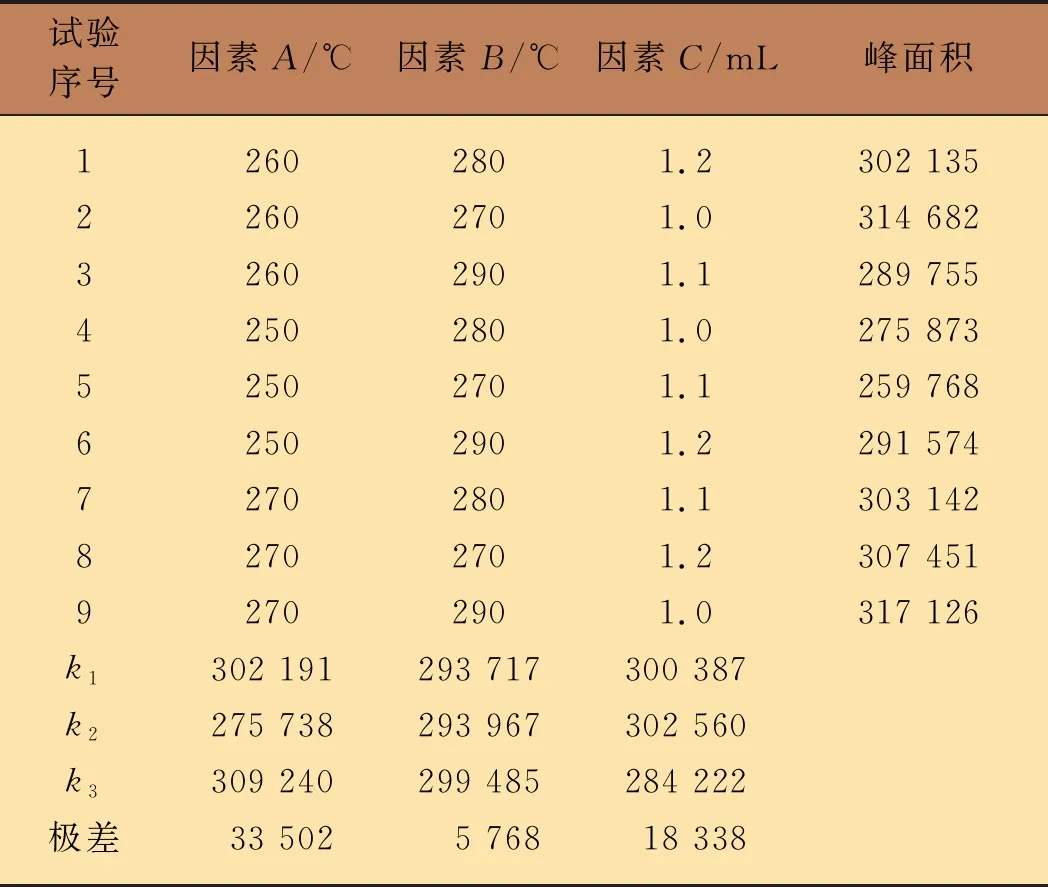
表1 分析条件正交试验表
在优化条件下对百菌清标准溶液进行全扫描质量分析,从其质谱图中选出强度较大的3个离子碎片(m/z266、m/z264和m/z268)作为母离子。在碰撞电压为15V的条件下,采用电子轰击扫描模式对这3个母离子进行碰撞,母离子在碰撞池与氦气碰撞后均产生多个子离子。每个母离子与其产生的1个子离子可形成1个子离子对。对于每个母离子,根据子离子对的响应,选择响应最大的2~3个子离子对进行质谱条件优化试验。为提高每个离子对的数据采集质量,将整个质谱扫描过程划分为不同的时间段,每个时间段有多个扫描通道[6]。改变碰撞电压,分别观察各子离子对在5、10、15、20、25、30、35、40、45和50 V电压下的响应,从中选择响应最大的2个子离子对进行定量和定性分析,其中响应最大的子离子对用于定量分析,此时对应的碰撞电压即为优化碰撞电压。经比较,最终选择用于定量定性分析的子离子对分别为m/z266→m/z266和m/z266→m/z231,其中定量子离子对为m/z266→m/z266,2个子离子对的碰撞电压均为15 V,驻留时间均为150 ms。在此条件下,对百菌清标准溶液进行分析,其GC/MS-MS质谱信号强度与时间的关系如图1所示,在5.661 min处有1个对应于百菌清的尖锐谱峰。
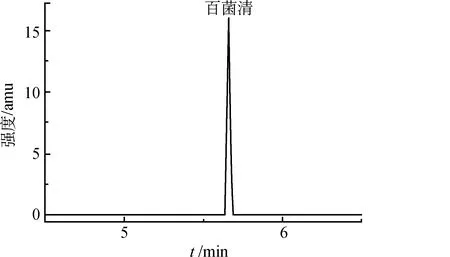
图1 百菌清标准溶液的GC/MS-MS图
2.2 超声萃取条件的优化
为分析萃取溶剂种类、萃取温度(A)、萃取时间
(B)和萃取溶剂体积(C)因素对超声萃取效率的影响[7],本文自制了4种含有不同百菌清含量的阳性试样并选用丙酮进行萃取。首先,分别考察这3个因素对百菌清萃取量的影响,结果发现,4种试样的萃取量达到最大值时的萃取温度、萃取时间和萃取溶剂体积各不相同。其中,1#、2#、3#和4#试样萃取量达到最大值的萃取时间分别为30、30、35和35 min,萃取温度分别为40、35、40和40 ℃,萃取溶剂体积分别为20、30、20和25 mL。然后,设计3因素3水平的正交设计试验,分析上述3个因素对萃取量的综合影响。在9种正交试验条件下对4种试样分别进行萃取,测定百菌清的萃取量。4种试样的萃取量及总萃取量结果如表2所示。萃取温度、萃取时间与萃取溶剂体积这3个因素的k值和极差值计算结果如表3所示。由表3可知,4种试样的超声萃取优化方案均不同,但优化的萃取温度都是A3,而萃取时间和萃取体积则各不相同。根据等权重多指标评价法,将总萃取量作为最终评价指标,综合考虑,最终确定优化超声萃取方案为A3B3C3。
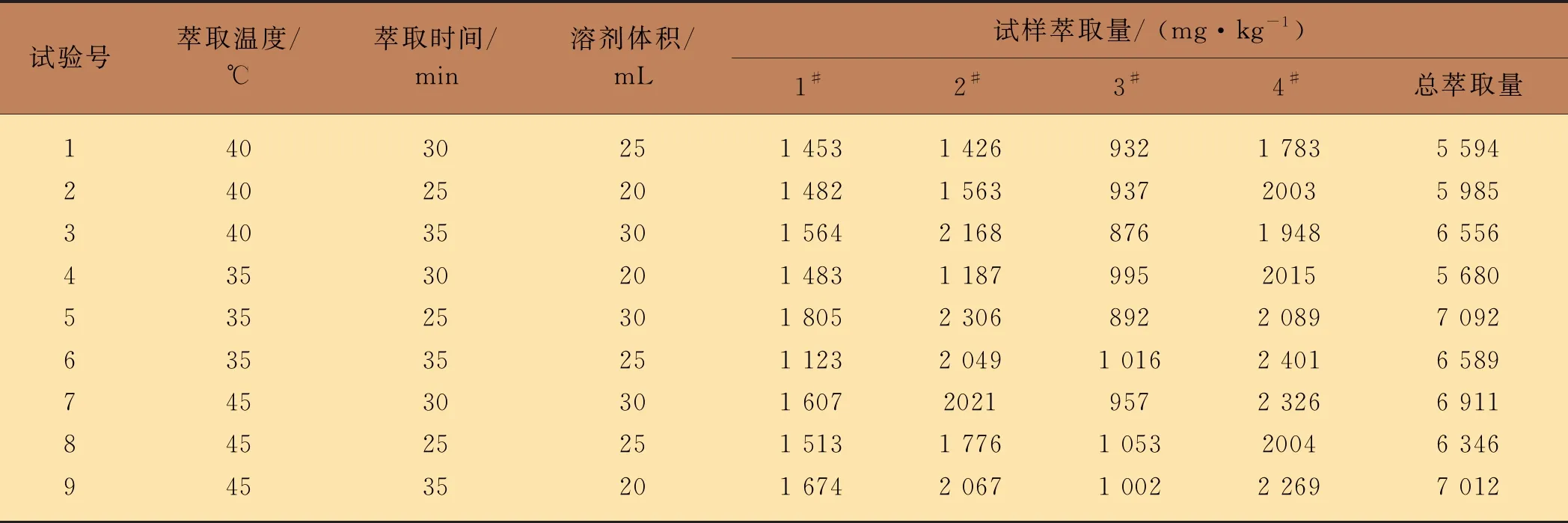
表2 超声萃取正交试验表
在给定的优化萃取条件下,以常见的11种溶剂为萃取溶剂分别萃取4种试样的百菌清含量,萃取结果如表4所示。1#和3#试样萃取溶剂分别为二氯甲烷和乙醇,2#和4#试样适宜的萃取溶剂为乙酸乙酯。为确保最终选定的萃取溶剂对所有试样都有较好的萃取效果,根据等权重多指标评价法,将总萃取量作为判断依据。则当采用乙酸乙酯为萃取溶剂时,百菌清的总萃取量可达最大值。综合考虑,以30 mL乙酸乙酯为萃取溶剂,45 ℃条件下超声萃取35 min作为百菌清的最终萃取条件。

表3 正交试验数据分析

表4 不同萃取剂的萃取量 单位:mg/kg
2.3 方法的线性范围和定量下限
在上述分析条件下,测试了在质量浓度分别为0.1、0.2、0.5、1.1、2.1、5.4、10.7和21.4 g/mL时百菌清标准工作液的响应,以质量浓度(ρ)和相应的峰面积(S)作图得到其标准曲线。结果发现,当百菌清质量浓度处于0.2 ~ 21.4 g/mL范围时,质量浓度与相应的峰面积之间存在良好的线性关系,其线性方程为A=14781ρ- 557,线性相关系数为0.9999。GC/MS-MS的噪声很低,信噪比(S/N)很好。但不能直接根据S/N来计算方法的定量下限(LOQ),于是改用LOQ=10sb/b的方法计算LOQ[8]。式中,sb和b分别为重复20次空白试验的标准偏差与线性方程的平均斜率。根据该计算式可计算出质量方法的定量下限为0.1 mg/kg。
2.4 方法的回收率和精密度
回收率和精密度试验均采用空白基质测试完成,分别选用不添加百菌清的涤纶衬布、白棉衬布、羊毛衬布和尼龙衬布作为空白试样,进行了3个不同质量浓度水平(0.5、2.1和10.7 g/mL)的标准溶液测试,每种质量浓度各进行9次平行试验,测试方法的平均回收率和精密度。其中,精密度以相对标准偏差(RSD)评价,结果如表5所示。该分析方法的平均加标回收率为81.3%~96.4%,精密度为3.9%~12.5%。
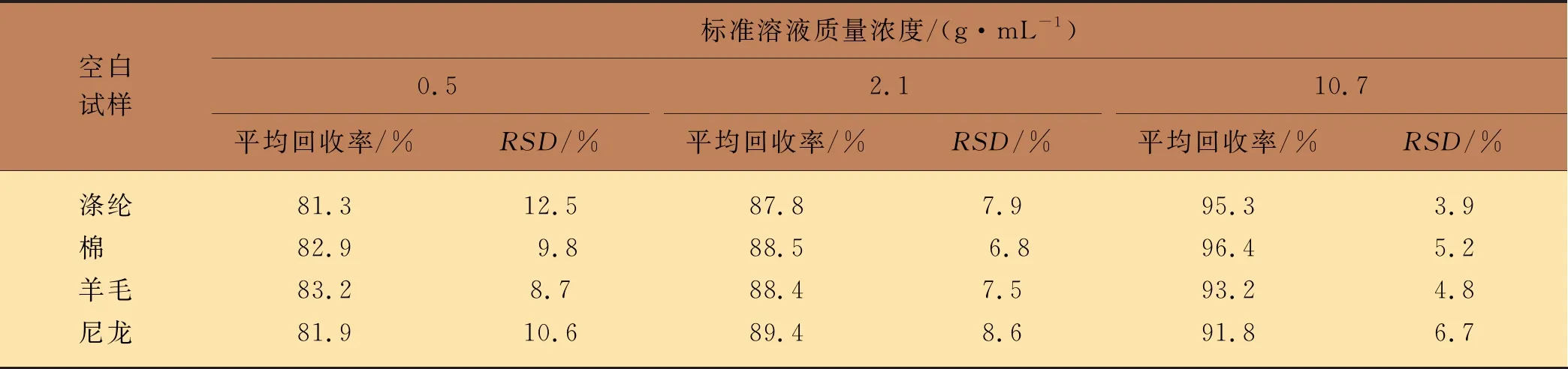
表5 方法的回收率和精密度
2.5 实际试样测试
采用前文建立的方法对市售纺织品中百菌清的含量进行测定。在某种条纹针织女式棉长裤中检出百菌清,其含量为446 mg/kg。图2为该试样的GC/MS-MS图,在t=5.651 min处出现1个对应于百菌清的尖锐谱峰。

图2 某实测试样的GC/MS-MS图
3 结论
本文建立了1种测定纺织品中残留百菌清含量的GC/MS-MS分析方法,并对超声萃取条件和仪器分析条件进行了优化。该方法简便快速,灵敏度高,定量下限低,可用于对市售纺织品百菌清含量的测定。

