迭代法计算磷酸和碳酸钠滴定曲线
许字明 温玉茹 开小明

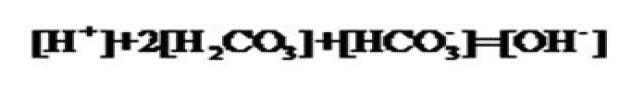
摘 要:用Excel迭代法计算溶液中不同pH时,需滴加滴定剂体积,比通常由滴加滴定剂体积计算pH方便得多。在Excel工作表中很容易找到滴定计量点和突跃范围的pH。计算了磷酸和碳酸钠的滴定曲线,很方便地求出他们滴定计量点和突跃范围的pH。
关键词:磷酸; 碳酸钠; 滴定曲线; 迭代法; 突跃范围
中图分类号:O655 文献标识码:A 文章编号:1006-3315(2020)11-108-001
多元弱酸和多元弱碱滴定曲线计算较复杂,一般在分析化学教学中,只近似计算计量点的pH值,而对其突跃范围没有介绍[1-3]。但用Excel迭代法计算,很容易计算出多元弱酸碱滴定曲线。
1.氢氧化钠标准溶液滴定磷酸滴定曲线
用氢氧化钠标准溶液滴定磷酸,磷酸溶液的质子等衡式表示为:
当滴加氢氧化钠标准溶液时,滴加氢氧化钠标准溶液体积可表示为:
上式中 分别表示磷酸和氢氧化钠的分析浓度,假如浓度均为0.1000mol/L; 分别表示磷酸的起始体积(假如为20.00mL)和滴加氢氧化钠的体积;Ka1、Ka2、Ka3表示磷酸一、二、三级离解常数,离解常数分别是7.6×10-3、6.3×10-8、4.4×10-13。通常是加入不同体积滴定剂氢氧化钠溶液,而后计算溶液pH值,公式是关于氢离子浓度的四次方程,不易求解。滴定磷酸起始pH值可通过通常的弱酸近似式计算,然后由Excel自带的迭代法计算滴加氢氧化钠溶液体积,如此可计算出不同pH值时,滴加氢氧化钠溶液体积。在Excel工作表中,找出滴加20.00mL氢氧化钠时所对应的pH值,就是第一计量点的pH;滴加40.00mL氢氧化钠时所对应的pH值,就是第二计量点的pH。氢氧化钠滴定磷酸曲线如图1所示。
由excel工作表中可查得,氫氧化钠滴定磷酸第一计量点pH4.68,相对误差±0.3%时pH4.49-4.89;第二计量点pH9.67,相对误差±0.3%时pH9.30-10.02,注意此处对应的滴定体积为39.88-40.12mL。
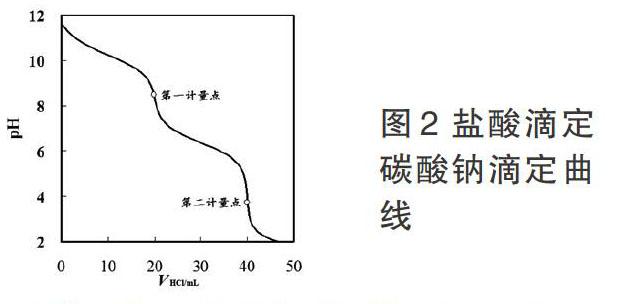
2.盐酸标准溶液滴定碳酸钠滴定曲线
如果用0.1000mol/L盐酸滴定同浓度的碳酸钠溶液,碳酸钠溶液的质子等衡式表示为:
当滴加盐酸标准溶液时,滴加盐酸标准溶液体积可表示为:
上式中 分别表示碳酸钠和盐酸溶液的分析浓度; 分别表示碳酸钠的起始体积(假设为20.00mL)和滴加盐酸的体积;碳酸钠一、二级离解常数Kb1、Kb2分别为1.79×10-4、2.38×10-8,其滴定曲线如图2。由Excel工作表中可查得,盐酸滴定碳酸钠第一计量点pH8.31,相对误差±0.3%时,突跃范围pH8.37-8.26,由于突跃范围小,用酚酞作指示剂,终点误差达到1%;第二计量点pH3.92,相对误差±0.3%时,突跃范围pH4.26-3.60,尽管突跃范围小,但滴定至甲基橙指示剂变橙色,此时pH4.0,与计量点pH非常近,所以用碳酸钠基准物标准盐酸,用甲基橙为指示剂结果是非常准确的,误差可以控制在±0.2%以内。
3.结论
基础分析化学教学对公式的严谨推导是必要的,充分利用计算机的多种计算功能,使复杂的计算过程变得可行[4-7]。迭代法方便计算了多元酸碱滴定曲线,求算计量点和突跃范围pH很直观。
参考文献:
[1]武汉大学.分析化学(第五版)[M]北京:高等教育出版社,2010:192-195
[2]南京大学.无机及分析化学(第五版)[M]北京:高等教育出版社,2015:384-385
[3]华中师范大学,东北师范大学,陕西师范大学,等.分析化学(第四版)[M]北京:高等教育出版社,2011:186-188
[4]开小明,雷玉富.化学教育,2007(1):59
[5]开小明,方皓文.冶金分析,2016,36(3):23-25
[6]方皓文,开小明.安庆师范大学学报(自然科学版),2017,23(1):75-77
[7]开小明,吴健,徐伟.赤峰学院学报(自然科学版),2019,35(1):35-36

