绵羊肺炎支原体和小反刍兽疫病毒双重RT-PCR检测方法的建立
霍晓丽 李文良 毛立 杨蕾蕾 刘茂军 张纹纹 李基棕 孙敏

摘要:绵羊肺炎支原体(MO)和小反刍兽疫病毒(PPRV)都可以造成山羊和綿羊的呼吸系统疾病,二者常呈现混合感染,给我国养羊业造成巨大的威胁和经济损失,对二者的检测有助于了解临床疾病混合感染情况、更好地防控呼吸道疾病。本研究的目的是建立同时检测绵羊肺炎支原体和小反刍兽疫病毒的双重RT-PCR检测方法。根据公布的基因序列针对MO和PPRV的16S rDNA和N基因设计合成2对特异性引物,构建标准质粒,进而通过退火温度和引物浓度的优化、特异性和灵敏性检测,建立双重RT-PCR方法。结果显示,该方法能特异性扩增MO(359 bp)和PPRV(686 bp)基因片段,其特异性好,敏感性高,对MO和PPRV的最小检出量分别为103拷贝/μL和102拷贝/μL。对部分临床样品检测结果显示,该方法可有效检测这2种病原,与单重PCR具有较高的符合率。本研究建立的双重 RT-PCR方法具有良好的特异性和敏感性,可用于临床样品MO和PPRV感染的快速检测。
关键词:绵羊肺炎支原体;小反刍兽疫病毒;双重RT-PCR;标准质粒;混合感染
中图分类号:S858.26 文献标志码: A
文章编号:1002-1302(2020)19-0185-05
收稿日期:2019-12-10
基金项目:江苏省农业科技自主创新资金[编号:CX(18)2003]。
作者简介:霍晓丽(1995—),女,山西晋中人,硕士研究生,从事动物疫病诊断防控技术研究。E-mail:942975692@qq.com。
通信作者:李文良,博士,副研究员,从事动物疫病诊断防控技术研究。E-mail:kfliwenliang@163.com。
小反刍兽疫(peste des petits ruminants,简称PPR)是由小反刍兽疫病毒(peste des petis ruminants virus,简称PPRV)引起的一种具有高度传染性的动物病毒性疾病[1]。小反刍兽疫引起小反刍动物发热、眼和鼻出现大量分泌物、肺炎、白细胞减少、呼吸困难、上消化道溃疡糜烂和腹泻等主要症状[2]。我国的第一例 PPR 病例于 2007 年发现于西藏自治区[3],2013—2014年PPR再次出现并迅速蔓延至多个省(市)[4-5]。小反刍兽疫传播迅速,跨度范围大,感染风险大,给我国动物疫病防控造成了巨大威胁。绵羊肺炎支原体(mycoplasma ovipneumoniae,简称MO)是造成羊支原体肺炎(mycoplasmal pneumonia of sheep)的一种重要病原体,是目前影响养羊业发展的主要呼吸道病原[6]。在临床上表现的主要特征是发热、咳嗽、流涕同时出现肺炎和胸膜炎[7],发病过程多取急性或慢性,有很高的病死率,呈全球性分布[8],多流行于中东、东亚、澳洲等养羊业较为集中的国家。在我国,自 1982年胡景韶等首次分离到 MO以来[9],羊支原体肺炎流行日益普遍,危害增强,对我国养羊业造成巨大威胁。
MO和PPRV均为引起山羊呼吸道疫病的主要病原,临床上常呈现混合感染,因此正确有效地检测混合感染情况对了解疾病的发生及防控具有重要意义。支原体分离培养和病毒分离是检测病原的常用方法,但此方法费时费力,对实验室条件和生物安全性要求很高,很容易因操作原因导致分离失败,且绝大部分实验室不具备病毒分离的条件,这给这2种病原的快速诊断带来困难。目前对于绵羊肺炎支原体和小反刍兽疫病毒的检测已经分别建立了分子生物学方法特异的PCR或RT-PCR方法,这种方法可以广泛应用在对病原的检测、诊断和流行病学调查方面[10-11],但是,建立能够同时检测MO和PPRV的PCR方法将更有利于临床检测。因此,本研究通过筛选靶基因和引物组合,优化反应条件,建立同时检测MO和PPRV的双重RT-PCR方法,以期为这2种病原的检测提供有力的工具。
1 材料与方法
1.1 菌、毒株
山羊支原体(PG3株)、MO(Y98株)、丝状支原体(F38株)购自中国兽医药品监察所;PPRV疫苗(PPRV Nigeria 75/1株)购自新疆天康畜牧生物技术股份有限公司;山羊痘活疫苗购自哈药集团生物疫苗有限公司;蓝舌病病毒(BTV)[12]、牛病毒性腹泻病毒(BVDV)[13-14]、边界病病毒(BDV)[15]、山羊副流感病毒3型(CPIV3)[16]、山羊疱疹病毒Ⅰ型(CpHV-1)[17]由江苏省农业科学院兽医研究所保存。
1.2 试剂
限制性内切酶HindⅢ和BamHⅠ、10×K buffer、pMD18-T载体购自宝生物工程(大连)有限公司; DH5α感受态细胞、Trans Zol UP、一步法RT-PCR试剂盒、Taq DNA聚合酶、DNA Marker购自北京全式金生物技术有限公司;DNA/RNA提取试剂盒、质粒提取试剂盒和胶回收试剂盒购自爱思进生物技术(杭州)有限公司。
1.3 引物设计与合成
参考GenBank中的MO 16S rDNA序列和PPRV N基因序列,利用Primer 5和MPprimer软件设计不同的引物组合,然后筛选出2对特异性引物对(表1),引物由南京擎科生物科技有限公司合成。
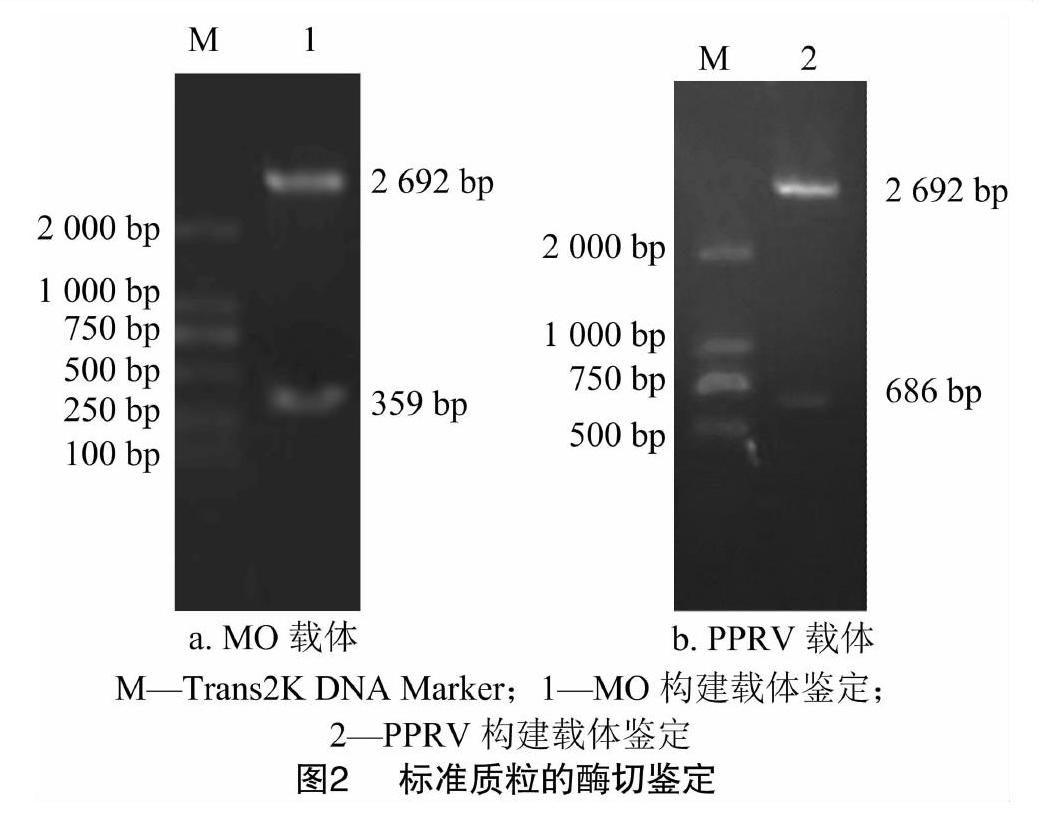
1.4 标准质粒的构建
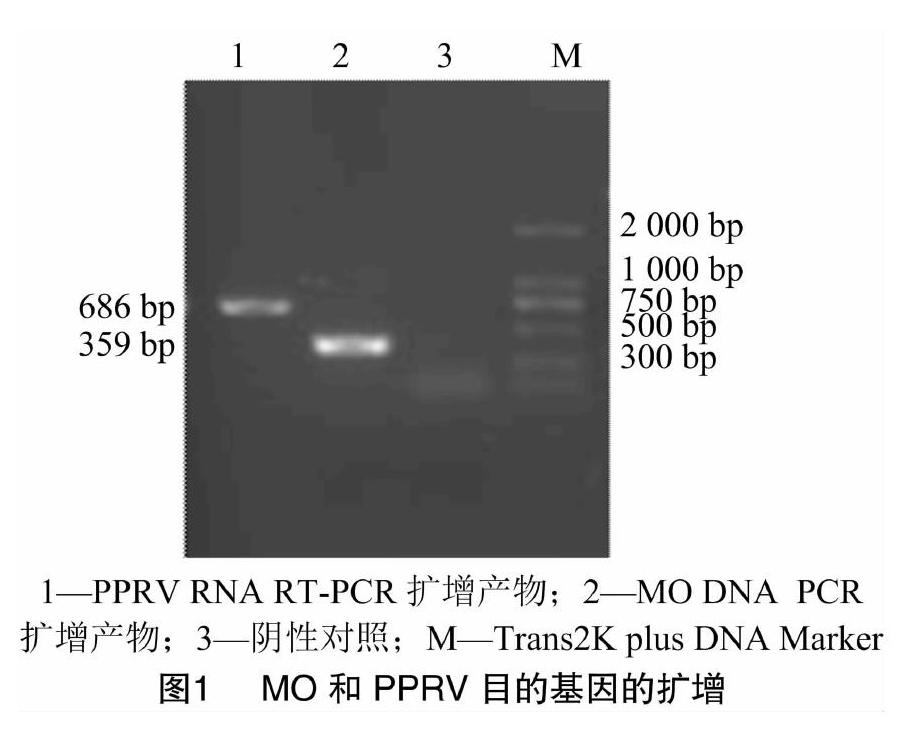
取200 μL MO培养液置于1.5 mL离心管(RNase free)中,参考核酸提取试剂说明书提取DNA,用引物MO1、MO2进行PCR扩增,反应体系:0.2 mL PCR反应管中加入2×PCR Mix10 μL,上下游引物各0.5 μL,核酸模板2 μL,无菌双蒸水加至总体积为20 μL,混匀。反应程序:94 ℃预变性5 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 30 s,共35个循环;最后72 ℃延伸10 min。电泳观察扩增结果。
将MO和PPRV标准品质粒混合物按10倍梯度稀释为1×108拷贝/μL至1×100拷贝/μL,取每个稀释度样品进行双重RT-PCR检测,结果(图7)显示,该方法对MO的最小检出量为103拷贝/μL,对PPRV的最小检出量为102拷贝/μL。
2.6 临床样品检测
利用建立的双重RT-PCR方法对2015—2018年采集的165份临床样本(鼻拭子和血清)进行检测,琼脂凝胶电泳结果如表2所示,165份样本中有79份呈MO阳性,有30份呈PPRV阳性,其中MO和PPRV混合感染的有21份。检测结果与单一PCR和RT-PCR的检测结果符合率为:MO 98.7%、PPRV 100%。这说明本试验建立的双重RT-PCR检测方法可有效地对临床样品中的MO和PPRV进行快速同步检测。
3 讨论
MO在全球范围内均有分布,且有很高的流行率,笔者所在实验室近年来对江苏省及周边地区患呼吸道疾病的山羊和绵羊鼻拭子、肺脏等样品的检测结果表明,MO普遍存在,该结果在臨床疾病防控中发挥重要作用。PPRV自2013年年底再次传入我国多个省(区),造成了巨大的损失,目前虽然通过疫苗免疫已经很好控制了疫病的流行和发生,但仍有散播病例。这2种病原临床上经常混合感染导致羊呼吸道疾病的发生。PCR和RT-PCR方法操作简便、快速且检测结果准确,已被广泛用于这2种病原的实验室检测。但是,目前仅有单独检测MO和PPRV的PCR和RT-PCR方法,需分别进行检测。因此,本研究建立一种一步法双重RT-PCR方法,以同时、快速、准确、方便地检测这2种病原。
由于PCR方法敏感性高,容易污染,且PPRV为RNA病毒,检测时需要先进行反转录再进行PCR扩增,而检测MO时则直接进行PCR扩增,因此,本研究方法采用核酸提取试剂盒从样品中同时提取DNA和RNA,扩增反应采用一步法RT-PCR方法,以减少操作和加样步骤,减少污染的机会并提高检测效率。
引物设计是决定双重PCR成败的关键。利用多重PCR引物设计系统MPprimer软件针对MO和PPRV基因分别设计多对引物并进分析筛选最佳引物组合,在设计过程中,不仅要考虑到每对引物的Tm值、GC含量以及引物特异性,还应确保这些引物对之间有相近的Tm值,同时需保证不同的扩增产物在电泳后能够很清晰地分辨;进而通过试验验证筛选针对MO和PPRV的引物组合,用于同时特异地检测MO和PPRV。在设计筛选过程中发现,有些引物组合经软件预测效果良好且特异,但试验验证时扩增效果不理想,因此在双重PCR引物设计时,应使用软件分析筛选多个引物组合并通过试验验证其应用效果。使用设计好的引物分别用单重PCR/RT-PCR进行扩增,得到特异性片段并克隆入pMD18-T载体上构建标准质粒,作为双重RT-PCR扩增的标准阳性对照。同时,为了减少引物对间的干扰,获得最佳检测效果,本研究对双重RT-PCR的反应条件进行优化,确定最佳引物反应浓度比为1 ∶1,即各上下游引物均为0.5 μL,最佳退火温度为52 ℃。敏感性和特异性试验证明,本研究方法具有良好的特异性和较高的敏感性。通过对165份临床样品进行检测证明,双重RT-PCR的扩增结果与单一PCR和RT-PCR有很高的符合率。临床样品中MO感染率较高(约50%),说明MO临床感染率较高,在PPRV阳性样品中,有70%(21/30)混合感染MO,表明PPRV与MO混合感染较普遍,在PPRV的临床检测时应考虑混合感染情况。
总之,本研究建立的双重RT-PCR方法可用于同时检测临床样品中的绵羊肺炎支原体和小反刍兽疫病毒,操作简单、特异性强、敏感性高且可减少污染机会、提高检测效率,可作为临床呼吸道疾病样品快速检测的有力工具,具有较好的应用前景。
参考文献:
[1]李园丽,李 林,樊晓旭,等. 小反刍兽疫检测技术研究进展[J]. 中国兽医杂志,2018,54(12):76-80.
[2]Li L,Cao X A,Wu J Y,et al. Epidemic and evolutionary characteristics of peste des petits ruminants virus infecting Procapra przewalskii in Western China[J]. Infection,Genetics and Evolution,2019,75:104004.
[3]王志亮,包静月,吴晓东,等. 我国首例小反刍兽疫诊断报告[J]. 中国动物检疫,2007,24(8):24-26.
[4]翁善钢. 小反刍兽疫的流行、诊断与防控[J]. 中国草食动物科学,2012,32(6):48-51.
[5]Wu X,Li L,Li J,et al. Peste des petits ruminants viruses re-emerging in China,2013—2014[J]. Transboundary and Emerging Diseases,2016,63(5):e441-e446.
[6]Balikci E,Kizil O,Karapinar T,et al. Efficacy of marbofloxacin for naturally occurring contagious caprine pleuropneumonia[J]. Small Ruminant Research,2008,77(1):75-79.
[7]Hernandez L,Lopez J,St-Jacques M,et al. Mycoplasma mycoides subsp. capri associated with goat respiratory disease and high flock mortality[J]. The Canadian Veterinary Journal,2006,47(4):366-369.
[8]刘文青,胡明丽,孙红岩,等. 绵羊肺炎支原体P30-HSP70C融合蛋白的表达及免疫原性研究[J]. 中国预防兽医学报,2014,36(11):894-897.
[9]胡景韶,蒋学良,胡诚隆,等. 一种由支原体感染的绵羊增生性间质性肺炎的研究[J]. 中国兽医杂志,1982(5):2-6.
[10]冷青文,李志远,鲁海富,等. 盘羊体内绵羊肺炎支原体的分离和鉴定[J]. 中国预防兽医学报,2014,36(3):197-200.
[11]Bao J,Li L,Wang Z,et al. Development of one-step real-time RT-PCR assay for detection and quantitation of peste des petits ruminants virus[J]. Journal of Virological Methods,2008,148(1/2):232-236.
[12]李文良,毛 立,杨蕾蕾,等. 血清15与21型蓝舌病病毒的分离与鉴定[J]. 西南农业学报,2018,31(3):630-634.
[13]毛 立,李文良,严少华,等. 山羊源牛病毒性腹泻病毒的分离与鉴定[J]. 中国兽医科学,2013,43(7):684-688.
[14]舒 鑫,董心仪,毛 立,等. 2株牛病毒性腹泻病毒基因2型的分离鉴定[J]. 畜牧与兽医,2018,50(10):105-109.
[15]Li W L,Mao L,Zhao Y Q,et al. Detection of border disease virus (BDV) in goat herds suffering diarrhea in eastern China[J]. Virology Journal,2013,10:80.
[16]李文良,毛 立,程素平,等. 山羊源副流感病毒3型的分離与分子鉴定[J]. 畜牧兽医学报,2015,46(2):344-348.
[17]郝 飞,毛 立,李文良,等. 山羊疱疹病毒Ⅰ型的分离鉴定与致病性[J]. 畜牧兽医学报,2018,49(8):1797-1802.

