三七原生质体的制备
王琪 雷秀娟 张浩 王英平


摘要:原生质体因打破了细胞壁的限制,成为遗传转化和体细胞杂交的理想受体。为了以酶解法制备高产量、高活力的三七原生质体,基于组织培养技术,以三七的愈伤组织为试验材料,设置不同纤维素酶和果胶酶的浓度配比,同时探究三七愈伤组织不同培养天数、不同酶解时间、酶液不同渗透压以及离心纯化收集原生质体时不同离心力对原生质体制备的影响,确定三七愈伤组织原生质体分离的最佳条件,以获得较高产量和活力的原生质体材料。结果表明,三七愈伤组织继代培养15 d,酶液组成为15 mg/mL纤维素酶+7 mg/mL果胶酶+CPW液+0.7 mol/L甘露醇,酶解时间为 7 h,以800 r/min离心收集原生质体时其产量和活力较高。
关键词:三七;原生质体;酶解法;纯化;原生质体活力
中图分类号: S567.23+6.01 文献标志码: A
文章编号:1002-1302(2020)19-0045-03
收稿日期:2019-12-05
基金项目:中国农业科学院科技创新工程项目(编号:CAAS-ASTIP-2016-ISAPS)。
作者简介:王 琪(1995—),女,山东淄博人,硕士研究生,从事基因编辑与原生质体融合研究。E-mail:1453865882@qq.com。
通信作者:王英平,博士,研究员,从事药用植物资源与育种研究。E-mail:yingpingw@126.com。
原生质体是除去细胞壁后被质膜包裹的有生活力的细胞,具有细胞全能性[1]。因没有细胞壁的限制,原生质体成为遗传转化、细胞杂交、新型育种的理想材料之一[2]。三七是五加科人参属的一种极具药用价值的草本植物,主产于我国云南省,具有活血化瘀、消肿定痛的功效[3]。本试验对三七原生质体的制备条件进行研究,以期为三七的转化试验和杂交育种等奠定基础。
1 材料与方法
1.1 主要仪器
试验仪器主要有台式冷冻离心机、普通光学显微镜、荧光显微镜、超净工作台、恒温振荡器、血球计数板、高压灭菌锅、电子天平、恒温水浴锅等。
1.2 主要试剂
试验试剂主要有纤维素酶(上海源叶生物科技有限公司)、果胶酶(上海源叶生物科技有限公司)、甘露醇(美国Sigma公司)、荧光素双醋酸酯(FDA)(美国Sigma公司)、细胞-原生质体清洗液(CPW液)(27.2 mg/L KH2PO4、101.0 mg/L KNO3、1 480.0 mg/L CaCl2·2H2O、246.0 mg/L MgSO4·7H2O、0.16 mg/L KI、0.025 mg/L CuSO4·5H2O )、蔗糖、琼脂粉、天门冬氨酸(Asp)、核苷酸、氢氧化钠、水解乳蛋白(国药集团化学试剂有限公司)等。
1.3 试验方法
1.3.1 三七愈伤组织继代培养
试验所用的三七愈伤组织为中国农业科学院特产研究所诱导培养。挑选质地较软、易于分散、颜色鲜黄、生长状态一致的愈伤组织进行继代培养,培养基为MS基本培养基+1.5 mg/L 2,4-二氯苯氧乙酸+8 mg/L Asp+8 mg/L 核苷酸+0.5 g/L水解乳蛋白+60 g/L 蔗糖+5.5 g/L 琼脂,继代后的同一批材料分别暗培养5、10、15、30、40、60 d,探究三七愈伤组织不同的培养时间对于原生质体产量和活力的影响。
1.3.2 三七原生质体分离
以酶解法分离原生质体时,其产量和活力受酶的种类、酶液配比、酶解时间、渗透压等多方面因素的影响[4]。原生质体分离的基础条件为1%纤维素酶+0.5%果胶酶+13%CPW液[5],暗酶解6 h并以600 r/min转速纯化原生质体。对纤维素酶和果胶酶的浓度配比、酶解时间、甘露醇浓度设置不同水平进行单因素试验,每组设3次重复。酶液用NaOH溶液调节pH值為58~60,附加0.3 mmol/L 2-(N-吗啡啉)乙磺酸(MES)缓冲液作为pH值稳定剂,酶液经 0.22 μm 过滤器过滤灭菌使用。酶解前将酶液于37 ℃ 进行预热活化,愈伤组织中酶液加入量为 10 mL/g,在100 r/min转速的摇床上振荡酶解,酶解温度为25 ℃。
1.3.3 原生质体纯化
以离心沉淀的方式对原生质体进行纯化。将酶解产物经100 μm滤网过滤,除去较大的或酶解不完全的细胞团,收集滤液。将滤液离心2 min,用移液器回收上清酶液。向离心管底部沉淀加入10 mL CPW液,离心洗涤2 min弃上清,重复2次。用10 mL液体培养基离心1 min,洗涤原生质体1次。用5 mL培养液重悬原生质体。设置离心转速为200、400、600、800、1 000、1 500、2 000 r/min 等7个水平,离心收集原生质体后观察其形态并计算产量。
1.3.4 原生质体产量计算
用25×16血球计数板进行计数[6]。将纯化收集的原生质体温和颠倒几次混匀后,吸取1.0 mL用培养液稀释3~5倍,取10 μL 滴加在计数板上,每个样品计数3次取平均值。原生质体数(个/mL)=80个小格内原生质体数÷80×400×10 000×稀释倍数,原生质体产量(个/g)=原生质体数(个/mL)×纯化悬浮体积÷酶解材料质量。
1.3.5 原生质体活力检测
以荧光双醋酸酯(FDA)染色法检测原生质体活力[7]。FDA用丙酮溶液配制,使用浓度为5 mg/mL,取1 mL纯化后的原生质体加入25 μL丙酮-FDA溶液,染色5~10 min,吸取100 μL制片,在荧光显微镜495 nm波长下进行观察统计,有活力的原生质体在视野下呈现绿色荧光且活力越高荧光越强。每个试验组取样3次,每次观察3个视野取平均值。原生质体活力=视野内发光细胞数/视野内细胞总数×100%。
2 结果与分析
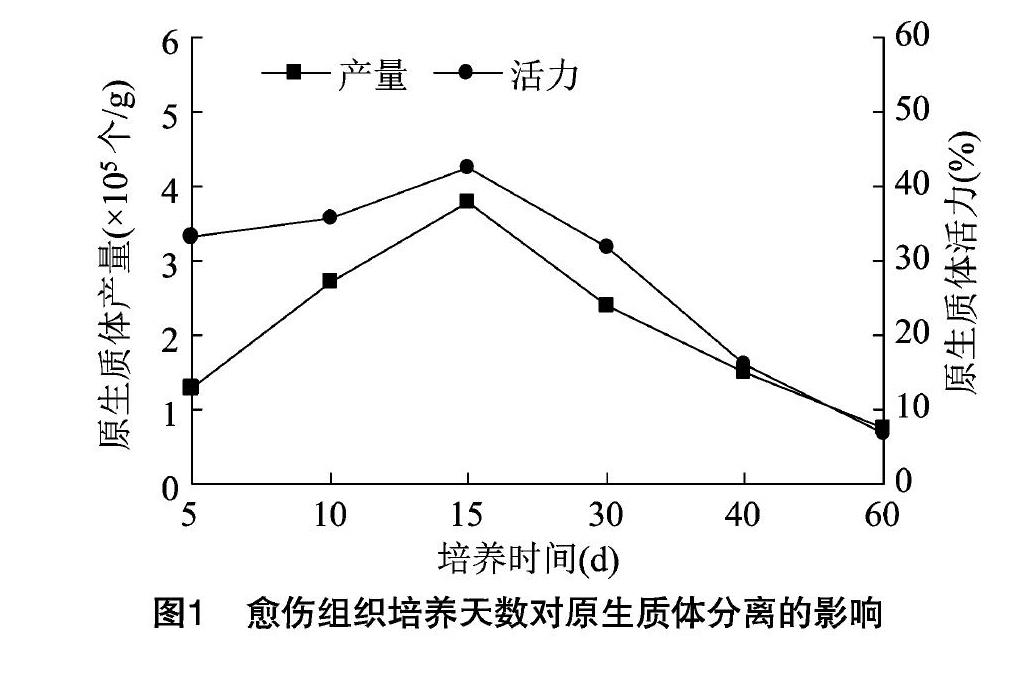
2.1 不同培养天数对原生质体产量和活力的影响
取同一时间继代,分别培养5、10、15、30、40、60 d 的三七愈伤组织各0.5 g,加入5 mL酶液,设3组重复,数据取平均值。在100 r/min转速摇床上酶解6 h,经CPW液洗涤2次,培养液洗涤1次,用5 mL培养液重悬并进行计数,统计原生质体的产量,以FDA染色法检测原生质体活力。结果(图1)表明,对培养15 d的愈伤组织进行酶解能获得较高的产量和活力。培养30 d以后的愈伤组织产量和活力都明显下降,原因可能是培养后期愈伤组织变得紧实密集,不易分散导致酶解不完全,且长时间不更换培养液,所需营养成分缺失,细胞次生代谢产物积累,细胞活力下降。
2.2 不同离心转速对原生质体产量和完整度的影响
将继代培养15 d的3 g愈伤组织用镊子分散,加入30 mL酶液,在100 r/min转速摇床上暗培养酶解 6 h,温和颠倒混匀后用移液器吸4 mL培养液至7支15 mL离心管中,分别以200、400、600、800、1 000、1 500、2 000 r/min转速离心,对酶解的原生质体进行洗涤纯化。用CPW液洗涤2次,用培养液洗涤1次,加入5 mL培养液重悬原生质体,取1 mL悬浮液稀释3倍,再吸取10 μL于血球计数板在显微镜下计数并观察原生质体完整度,试验重复3次。由表1可知,将离心转速设为800 r/min时可以获得较高的原生质体产量,且完整度较高。分析原因可能是离心转速较低时,原生质体沉集不完全,会在纯化过程中随上清液流失;离心转速较高时会增加原生质体与管壁的碰撞次数和压力,导致原生质体破裂,细胞完整度下降,碎片增加且产量降低。
2.3 不同渗透压对原生质体分离的影响
取继代15 d的3 g愈伤组织用镊子分散,加入30 mL酶液,取7支离心管,每管分装4 mL酶解液,分别按0.2、0.4、0.5、0.6、0.7、0.8、1.0 mol/L加入对应浓度的甘露醇,在100 r/min转速摇床上暗培养酶解6 h。结果(图2)表明,甘露醇浓度在0.2~0.4 mol/L 之间时,原生质体的产量和活力很低,分析原因可能是该浓度的渗透压相对于组织细胞过低,显微镜下很多细胞体积膨胀,细胞质外流,细胞破裂;甘露醇浓度在0.5~0.7 mol/L之间时,随着渗透压增加,原生质体的产量和活力逐渐增加,显微镜下细胞形态多为球形,细胞形态较为稳定;甘露醇浓度继续增加后细胞体积减小,原生质体皱缩,产量和活力都下降,且在浓度为1.0 mol/L时产量大幅减少,活力也极低。因此以0.7 mol/L浓度的甘露醇调节酶液渗透压时能获得较高的原生质体产量和活力。
2.4 不同酶解时间对原生质体分离的影响
取培养15 d的0.5 g愈伤组织于5 mL酶液中酶解,材料的酶解时间设置7个水平,分别为3、5、7、8、9、11、13 h。在对应的培养时间取样进行原生质体产量和活力的计算。如图3所示,随着酶解时间的增加,原生质体的产量和活力呈现先上升后下降的趋势。酶解3 h左右在显微镜下能观察到较多大的细胞团,游离的细胞数量少,原生质体的产量和活力较低;酶解5~9 h时,原生质体的释放量逐渐增多,但活力呈现先下降后上升的趋势;酶解9 h后,原生质体的产量明显降低,显微镜下细胞碎片增多,活力急剧下降。酶解7 h与酶解8 h时原生质体的产量差异不明显,但酶解7 h时原生质体的活力较高。高活力的原生质体更有利于后期的培养和应用,因此将酶解7 h设为最佳酶解时间。
2.5 不同酶液配比对原生质体分离的影响
纤维素酶液浓度(质量体积比)设置3个水平,分别为10、15、20 mg/mL,果胶酶液浓度(质量体积比)设置3个水平,分别为5、7、9 mg/mL,共计9种不同的酶液组合,酶解7 h后计算原生质体的产量和活力。如表2所示, 当纤维素酶浓度为20 mg/mL、
果胶酶浓度为7 mg/mL时,原生质体产量可达到682×105个/g,但活力仅为33.7%;当纤维素酶浓度为15 mg/mL、果胶酶浓度为7 mg/mL时,原生质体产量为644×105个/g,活力达到59.6%;当纤维素酶浓度为15 mg/mL,果胶酶浓度分别为7、9 mg/mL 时,二者的产量差异不明显,但原生质体的活力差異明显。原生质体的数量可以通过富集提高,而活力较高的原生质体更有利于后期的培养和应用,综合考虑,将最佳酶液配比组合设置为 15 mg/mL 纤维素酶+7 mg/mL果胶酶。
3 讨论与结论
原生质体的产量和活力受多种因素的影响,如材料的基因型和生理状态、培养基成分、制备方式、制备条件等。本研究以酶解法分离三七原生质体,将继代培养15 d的材料在15 mg/mL纤维素酶+7 mg/mL 果胶酶+CPW液+07 mol/L 甘露醇的酶液中酶解7 h,并以800 r/min纯化收集原生质体时,能获得较为理想的原生质体材料,产量为 6.44×105个/g,活力为59.6%。试验结果为下一步进行原生质体制备条件的优化和原生质体的培养再生奠定了基础。
参考文献:
[1]彭 章,童华荣,梁国鲁,等. 茶树叶片和胚根原生质体的分离及PEG诱导融合[J]. 作物学报,2018,44(3):463-470.
[2]蔡 肖,康向阳. 小青杨叶肉原生质体分离条件的研究[J]. 中国农学通报,2011,27(10):18-22.
[3]李云鹤,王晓梅. 试论中药三七对血液系统的药理药效作用[J]. 中国现代药物应用,2016,10(8):253-254.
[4]Wei Z M,Xu Z H. Plant regeneration from protoplasts of soybean(Glycine max L.)[J]. Plant Cell Reports,1988,7(5):348-351.
[5]王 义,杨 晶,张 颖,等. 人参原生质体的分离培养[J]. 吉林农业大学学报,2009,31(3):268-272.
[6]李 晓. 马铃薯原生质体培养再生及利用CRISPR/Cas9瞬时转化的研究[D]. 呼和浩特:内蒙古大学,2019.
[7]苏 彤,姚陆铭,张 鑫,等. 大豆愈伤原生质体的制备和培养方式探究[J]. 大豆科学,2018,37(5):741-747.

