3种瓣型茉莉基因组大小测定与比较
齐香玉 陈双双 冯景 王华娣 邓衍明

摘要:茉莉具有较高的观赏、茶用和药用价值,但关于其基因组学的研究还相对匮乏。以单瓣、双瓣和多瓣茉莉的嫩叶为材料,选用6种常用的细胞解离液,利用基因组大小已知的水稻(Oryza sativa)日本晴、玉米(Zea mays)B73和番茄(Lycopersicon. Esculentum L. Stupicke polni tyckove rane)为内参,以建立适合于茉莉的流式细胞术基因组大小测定方法。结果表明,WPB细胞解离液对茉莉和内标解离效果最好,粒子清晰集中,无重叠峰且区分度良好;单瓣、双瓣和多瓣茉莉的基因组1C DNA含量分别为0.809 5、0.804 5、0.592 6 pg;单瓣和双瓣茉莉间的基因组大小无显著性差异,但它们与多瓣茉莉的基因组大小有显著性差异。本研究建立了流式细胞术测定茉莉基因组大小的方法,同时测定了3种瓣型茉莉的基因组大小,为茉莉的基因组学及物种进化研究提供参考。
关键词:茉莉;基因组大小;流式细胞术;细胞解离液
中图分类号: S685.160.1 文献标志码: A
文章编号:1002-1302(2020)19-0040-05
收稿日期:2019-11-25
基金项目:国家自然科学基金(編号:31772338)。
作者简介:齐香玉(1986—),女,安徽桐城人,博士,助理研究员,主要从事观赏植物遗传育种与分子生物学研究。E-mail:409241891@qq.com。
通信作者:邓衍明,博士,研究员,主要从事花卉遗传育种与分子生物学研究。E-mail:nksdym@163.com。
基因组大小(或称C值)是指一个物种单倍体核的DNA含量,通常用质量(pg)或核苷酸碱基对数目(Mb)表示,1 pg相当于978 Mb[1]。迄今为止,植物DNA C值数据库(plant DNA C-values database)已有12 273个物种的C值数据,其中包括10 770种被子植物、421种裸子植物、303种蕨类植物、334种苔藓植物和445种藻类[2]。基因组反映了物种全部和特定的遗传信息[3]。测定基因组大小可以预估物种的DNA含量,为植物的基因组学及其亲缘进化研究提供理论依据。目前,测定基因组大小的方法主要有Feulgen微光密度法[4]、流式细胞术(flow cytometry,FCM)[5]和基因组测序法[6]。FCM具有操作简单、高效、准确等优点,因而被广泛应用于不同物种基因组大小的测定,如五节芒[7]、草莓[8]、槭属植物[9]等,也常被用于物种倍性鉴定,如柴胡[10]、枣[11]、旱柳[12]、荔枝[13]等。
茉莉(Jasminum sambac)别称茉莉花、茶叶花,属木犀科(Oleaceae)素馨属(Jasminum Linn.)常绿直立或攀援状灌木。茉莉原产于印度及巴基斯坦等地,在1 700多年前的汉代传入我国,最早在东南沿海地区栽培,然后逐渐北上直到长江流域,是“一路一带”经济植物开发与应用的重要成员之一[14]。茉莉具有较高的观赏、茶用和药用价值,历来受到我国人民的喜爱,被誉为“花树中的珍品” “天下第一香”[15]。茉莉品种较多,但根据花形结构的不同,主要划分为单瓣、双瓣和多瓣茉莉3种类型[16]。不同瓣型茉莉在花朵大小和形态、香气类型和产花量等观赏和经济性状上都存在差异。王湘平等对双瓣茉莉的染色体数目和核型进行分析发现,染色体数目为2n=2X=26,染色体核型公式为2n=2X=8 m+16 sm+2 sm(SAT),核型为3B类型[17]。然而,关于茉莉基因组大小的研究尚未见报道,有关茉莉分子生物学的研究还相对滞后。随着测序技术的发展和测序成本的降低,开展茉莉的全基因组测序成为可能。对物种的基因组大小进行预估,能为测序成本预算及组装策略研究提供重要的理论依据。因此,本试验拟用流式细胞仪技术对单瓣、双瓣和多瓣茉莉的基因组大小进行测定分析,旨在为后期开展茉莉的基因组学及种群进化研究提供数据参考。
1 材料与方法
1.1 试验材料
供试的3种瓣型(单瓣、双瓣和多瓣)茉莉的嫩叶均采自江苏省农业科学院茉莉种质资源圃。试验作为内标的水稻日本晴(Oryza sativa L. subsp. japonica Nippobare)由江苏省农业科学院粮食作物研究所张亚东研究员提供,玉米(Zea mays)B73由南京农业大学农学院李盛本教授提供,番茄(Lycopersicon esculentum L. Stupicke polni tyckove rane)由捷克共和国实验植物学研究所(奥洛摩茨)Jaroslav Dolezel教授提供。
1.2 仪器设备及试剂
试验使用的仪器是美国Becton-Dickinson(BD)公司的FACSCalibur流式细胞仪。荧光染料碘化丙啶(PI)、孔径37 μm的尼龙滤膜、鞘液、培养皿、EP管、刀片等购自南京博巧生物科技有限公司。
1.3 试验方法
1.3.1 细胞解离液的选择
为获得适合茉莉的最佳细胞解离液,分别对Otto、Gal、WPB、GPB、LBO1、Tris-MgCl2等多种解离液进行逐一尝试。
1.3.2 细胞核悬液的制备
取3种瓣型茉莉的新鲜嫩叶,用去离子水洗去表面的灰尘,滤纸吸干后,各称取3份,每份约0.5 g,分别放入预冷的培养皿中,加入1 mL预冷的细胞解离液,用锋利的刀片上下快速切碎,过程中保证样品浸没在解离液中。吸取培养皿中的解离液,用37 μm滤膜过滤到 1.5 mL 离心管中,然后置于冰上孵育5 min,1 000 r/min 离心5 min,弃去上清液,并将离心管倒置在滤纸上使残余的液体自然流干,收集沉淀的细胞,再加入 500 μL 预冷解离液。采用同样的方法获得水稻、玉米和番茄幼嫩叶片的细胞核悬液。
1.3.3 DNA特异性染色
将单瓣茉莉和双瓣茉莉细胞核悬液分别与水稻和玉米细胞核悬液混匀,多瓣茉莉分别与水稻和番茄细胞核悬液混勻,获得混合细胞核悬液。向制备好的混合细胞核悬液中同时加入RNAase A至终浓度为50 μg/mL和碘化丙啶(propidium iodide,PI)染液至终浓度为 100 μg/mL,置于冰上,避光染色20 min。
1.3.4 基因组大小的测定和计算
样品检测前,对流式细胞仪进行预热30 min。采用488 nm的蓝光激发,收集670/30通道的荧光,检测PI的发射荧光强度。每个样品在检测时低速收集10000个细胞,变异系数(CV)控制在5%以内,且每个样品3次重复。使用流式细胞仪自带的FACSTM软件100650分析数据,待测样本核DNA含量计算公式如下:
待测样本核DNA含量=对照样本核DNA含量×待测样本G0/G1峰荧光强度对照样本G0/G1峰荧光强度。
2 结果与分析
2.1 细胞解离液的选择
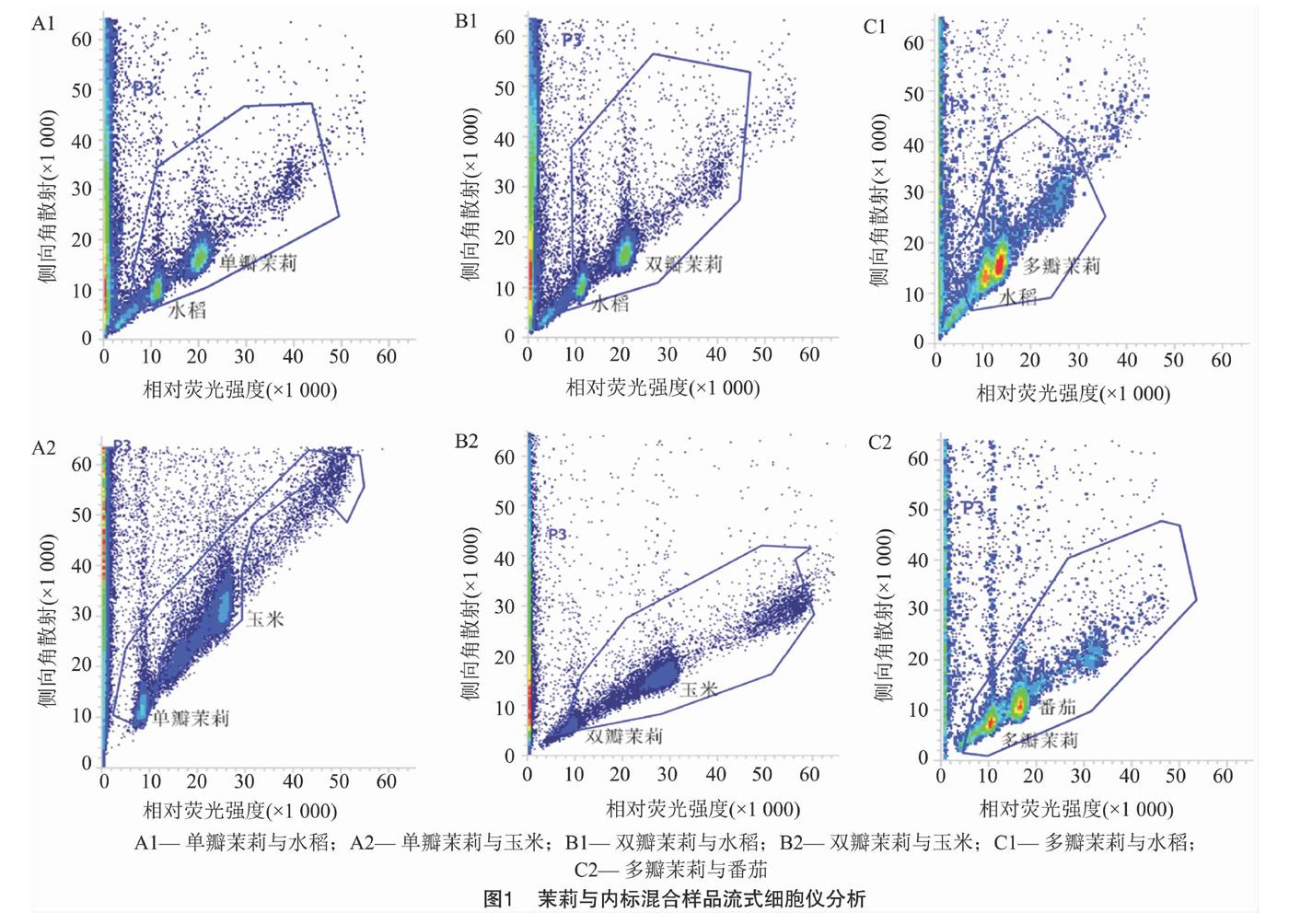
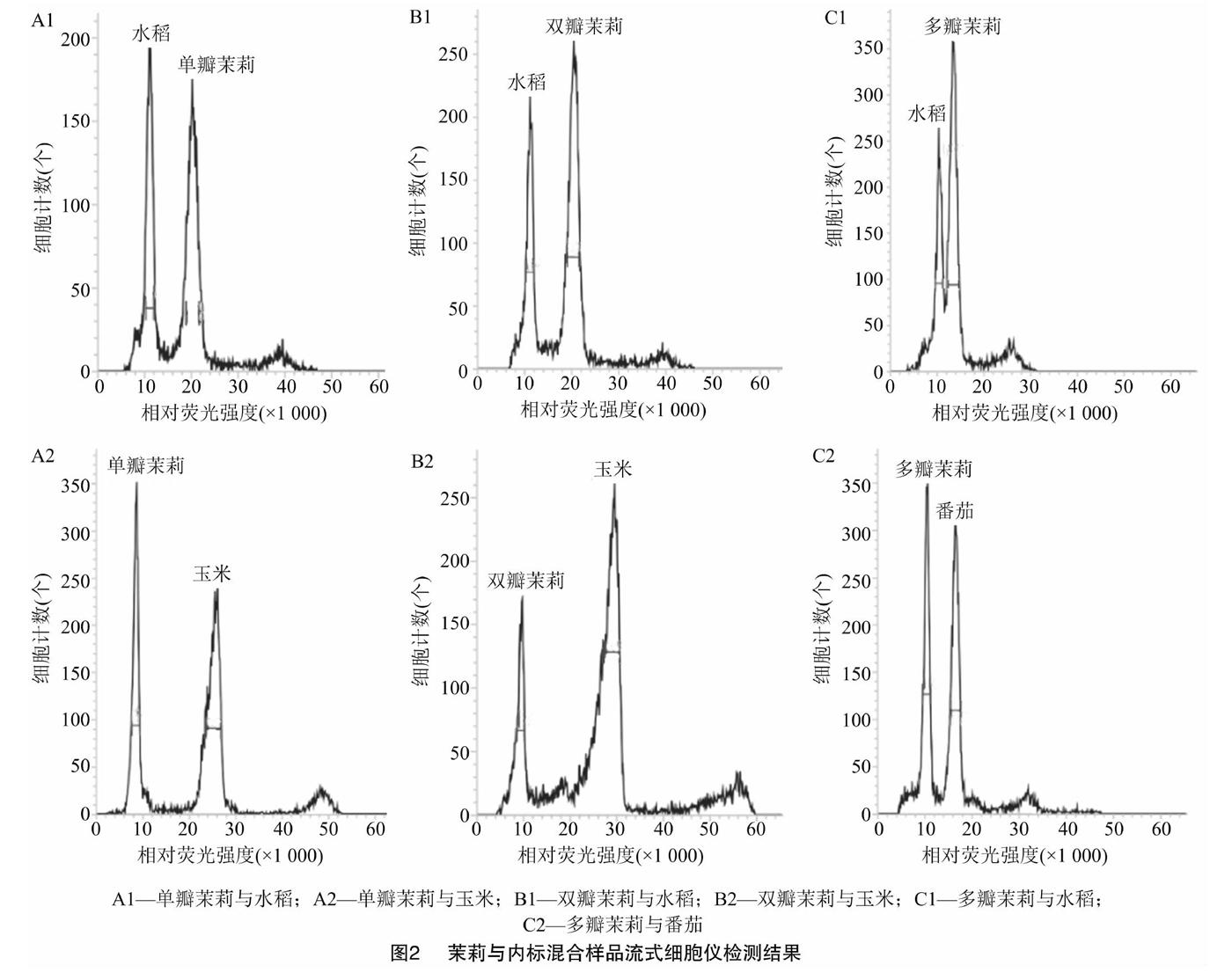
不同裂解液对不同植物的解离效果不同[7,9,11]。为探索茉莉细胞最适合的裂解液,此次研究利用流式细胞仪逐一对6种常用的解离液(Otto、Gal、WPB、GPB、LBO1、Tris-MgCl2)进行比较。最终筛选出WPB解离液,其对茉莉和内标的解离效果最好,变异系数(CV)值控制在5%以内。由图1可知,茉莉与内标的粒子清晰集中,混合样品的粒子团能同时被检测到。由图2可知,获得的峰图清晰,杂峰较少、无重叠峰且区分度良好。因而保证了用基因组大小已知的水稻、玉米和番茄作为内标,测定茉莉基因组大小的合理性及准确性。
2.2 基因组大小的测定结果
PI是一种荧光染料,能够均匀嵌入到双链DNA的碱基对中,其嵌入量与DNA含量成正比,因此可以用相对荧光强度表示DNA相对含量。比较单瓣、双瓣、多瓣茉莉及内标的嫩叶单独制样上机检测结果,基于基因组相差倍数尽量小于2倍的原则,确定以水稻日本晴、玉米B73作为内标,分别测定单瓣茉莉(图2-A1和图2-A2)和双瓣茉莉(图2-B1和图2-B2)的基因组大小;以水稻日本晴、番茄Stupicke polni tyckove rane作为内标,测定多瓣茉莉(图2-C1和图2-C2)的基因组大小。已有研究中,水稻日本晴的2C DNA含量为0.88 pg,玉米B73的2C DNA含量为4.91 pg,番茄Stupicke polni tyckove rane的2C DNA含量为1.96 pg。根据混合样品的PI发射荧光强度,比较茉莉与内标样本峰值的倍数关系,3次重复检测,计算出单瓣茉莉的基因组1C DNA含量为0.809 5 pg,双瓣茉莉的基因组1C DNA含量为0.804 5 pg,多瓣茉莉的基因组1C DNA含量为0.592 6 pg(表1)。从表1可以看出,同一瓣型茉莉用2个内标检测,测得的基因组大小无显著性差异;单瓣茉莉和双瓣茉莉基因组大小无显著性差异,但多瓣茉莉与单瓣、双瓣茉莉基因组大小均有显著性差异。
3 讨论与结论
目前评估基因组大小的方法较多,其中流式细胞术因操作简单、高效、准确等优点,已成为物种基因组大小测定[7-10]和物种倍性鉴定[11-13]的重要技术方法。茉莉不仅具有较高的观赏价值,还具有较高的茶用和药用价值,市场前景广阔。此前,并没有茉莉基因组大小的研究。木犀科其他物种基因组大小已有报道,如樊慧杰等利用流式细胞术测定了连翘属植物连翘的基因组大小为0.74 Gb[18]。Suda等利用流式细胞术测定了浓香茉莉(Jasminum odoratissimum)的基因组大小为1.44 pg[19]。然而,不同物种的基因组大小存在很大差异[3],不同物种的流式细胞术测定条件不同[11-13],所以对于茉莉基因组大小的测定,要对流式细胞术的方法进行探索。
不同植物的叶片结构和次生代谢物组成均不相同,可见材料的选择、细胞核的提取及染色时间是流式细胞术的关键步骤[3]。本研究选取新鲜幼嫩叶片,取样后立即制样。通过对6种不同解离液的筛选,最终筛选出WPB解离液,其对茉莉和内标的解离效果最好,CV值控制在5%以内,粒子清晰集中,获得的峰图清晰,杂峰较少,无重叠峰且区分度良好,保证了结果的可靠性和准确性。木本植物细胞核中含有单宁酸,单宁酸会干扰荧光染色的酚类化合物,对Gal和LBO1裂解液产生负面影响,故Gal和LBO1裂解液不适合用于木本植物细胞核悬液的提取[20],与本研究的试验结果一致。
内标样品的选择是流式细胞术测定结果可靠准确的关键因素。本研究采用已知基因组的水稻日本晴和玉米B73或水稻日本晴和番茄作为双内标对单瓣、双瓣和多瓣茉莉进行测定分析,结果显示,茉莉与内标间的峰区分度良好、无重叠,且DNA含量的CV值均控制在5.0%以内[3],可确保试验结果的准确性,因此,本试验结果可靠稳定。
Bennett等对24种被子植物种内DNA含量变化的研究发现,种内DNA含量变化是很普遍的现象,种内DNA含量变化在4%~28%之间[21]。邓果特等采用流式细胞仪测定来自不同地区五节芒的基因组大小发现,湖南省郴州市、湖北省红安县和江西省修水县采集的五节芒基因组大小间无显著性差异,广东省连山壮族瑶族自治县、江苏省连云港市和福建省永安市采集的五节芒基因组大小间无显著性差异,但它们两者之间有显著性差异,说明五节芒存在种内DNA含量变异[7]。本研究同时测定的3个瓣型茉莉基因组大小中,单瓣茉莉基因组大小(0.809 5 pg)和双瓣茉莉基因组大小(0.804 5 pg)无显著性差异,但它们与多瓣茉莉基因组大小(0592 6 pg)之间存在显著性差异,这与上述研究结果吻合。造成多瓣茉莉与单瓣和双瓣茉莉间基因组大小存在显著性差异的原因可能很多,如染色体的多倍化、B染色体、非整倍体、染色质变异及基因重复与丢失等,这些都可能会对DNA含量的种内变异有一定的作用[22]。此外,植物基因组DNA含量会被某种特定的选择力影响,如纬度、气候、海拔及地区差异都有可能造成DNA含量的变异[23-24]。具体是何原因导致茉莉种内DNA含量变异,还需进一步研究。
总之,本研究首次建立了流式细胞术测定茉莉基因组大小的方法,并测定了3种不同瓣型茉莉的基因组大小,丰富了茉莉的生物学信息,为茉莉的基因组学及系统进化等研究奠定了重要的理论基础。
參考文献:
[1]Largia M J V,Shilpha J,Pothiraj G,et al. Analysis of nuclear DNA content,genetic stability,Bacoside A quantity and antioxidant potential of long term in vitro grown germplasm lines of Bacopa monnieri (L.)[J]. Plant Cell Tissue and Organ Culture,2015,120(1):399-406.
[2]Leitch I J,Johnston E,Pellicer J,et al. Plant DNA C-values Database[DB/OL]. (2019-04-01)[2019-10-21]. https://cvalues.science.kew.org/.
[3]Dolezel J,Bartos J,Voglmayr H,et al. Nuclear DNA content and genome size of trout and human[J]. Cytometry A,2003,51(2):127-128.
[4]Levine R F,Bunn P A,Hazzard K C,et al. Flow cytometric analysis of megakaryocyte ploidy:comparison with Feulgen microdensitometry and discovery that 8N is the predominant ploidy class in guinea pig and monkey marrow[J]. Blood,1980,56(2):210-217.
[5]Dolezel J,Greilhuber J,Suda J. Estimation of nuclear DNA content in plants using flow cytometry[J]. Nature Protocols,2007,2(9):2233-2244.
[6]Teh B T,Lim K,Yong C H,et al. The draft genome of tropical fruit durian (Durio zibethinus)[J]. Nature Genetics,2017,49(11):1633-1641.
[7]邓果特,刘清波,蒋建雄,等. 五节芒基因组大小测定[J]. 植物遗传资源学报,2013,14(2):339-341.
[8]陈丙义,李金凤,霍恒志,等. 6种野生草莓基因组大小估算[J]. 果树学报,2015,32(91):51-56.
[9]马秋月,李淑顺,马 骧,等. 基于流式细胞技术的两种槭属植物基因组大小测定[J]. 南京林业大学学报 (自然科学版),2018,42(5):201-205.
[10]都明理,徐 娇,朱楚然,等. 3种柴胡染色体数目测定及基因组大小估测[J]. 江苏农业科学,2019,47(11):191-193.
[11]王利虎,吕 晔,罗 智,等. 流式细胞术估测枣染色体倍性和基因组大小方法的建立及应用[J]. 农业生物技术学报,2018,26(3):511-520.
[12]张 健,王 莹,马祥建,等. 基于流式细胞术的旱柳染色体倍性与基因组大小测定[J]. 江苏农业科学,2018,46(22):40-43.
[13]赖 彪,吴传龙,秦永华,等. 流式细胞仪测定荔枝倍性和基因组大小的细胞核提取液筛选与应用[J]. 果树学报,2019,36(7):939-946.
[14]袁昌齐,束成杰,贾晓东,等. “一带一路”经济植物应用与开发(南亚篇)[J]. 中国野生植物资源,2016,35(2):1-2.
[15]邓衍明,叶晓青,李聪聪. α-萘乙酸对茉莉水培生根及根尖解剖结构的影响[J]. 江西农业学报,2012,24(2):35-37.
[16]Deng Y M,Sun X B,Gu C S,et al. Identification of pre-fertilization reproductive barriers and the underlying cytological mechanism in crosses among three petal-types of Jasminum sambac and their relevance to phylogenetic relationships[J]. PLoS One,2017,12(4):e0176026.
[17]王湘平,赖志明,苏金为. 茉莉染色体核型研究[J]. 福建农学院学报,1992,21(1):63-66.
[18]樊慧杰,柴 智,殷福栋,等. 连翘基因组大小的流式细胞仪测定[J]. 时珍国医国药,2019,30(3):758-760.
[19]Suda J,Kyncl T,Jarolímová V. Genome size variation in Macaronesian angiosperms:forty percent of the Canarian endemic flora completed[J]. Plant Systematics and Evolution,2005,252(3/4):215-238.
[20]Loureiro J,Rodriguez E,Dolezel J,et al. Flow cytometric and microscopic analysis of the effect of tannic acid on plant nuclei and estimation of DNA content[J]. Annals of Botany,2006,98(3):515-527.
[21]Bennett M D,Leitch I J. Nuclear DNA amounts in angiosperms[J]. Annals of Botany,1995,76(2):113-176.
[22]Biémont C. Genome size evolution:within-species variation in genome size[J]. Heredity,2008,101(4):297-298.
[23]Grime J P,Mowforth M A. Variation in genome size-an ecological interpretation[J]. Nature,1982,299(5879):151-153.
[24]Hall S E,Dvorak W S,Johnston J S,et al. Flow cytometric analysis of DNA content for tropical and temperate new world pines[J]. Annals of Botany,2000,86(6):1081-1086.

