pH敏感聚合物胶束mPEG-GDE-OE的制备及其载药性能
孙 慧,王 菲,汪云云,巩 凯(江南大学药学院,江苏无锡214122)
由亲水链段和疏水链段组成的两亲性聚合物能在选择性溶剂中自组装形成微观聚集体,形成具有核-壳结构的纳米胶束[1]。两亲性聚合物胶束粒径小且分布窄,不易被网状内皮系统吞噬,且能够透过血管选择性蓄积在肿瘤组织,起到被动靶向的作用[2]。因此,聚合物胶束作为药物传递载体,在肿瘤疾病的治疗方面具有广阔的应用前景。两亲性聚合物不同亲疏水基团和结构等对聚合物胶束的性能有重要影响。聚乙二醇(PEG)是一类重要的亲水性高分子,具有良好的生物相容性,PEG基纳米给药系统可以避免粒子被内皮网状系统(RES)吞噬,从而在体内具有长循环特性,在纳米药物递送系统应用广泛[3-5]。从拓扑学角度来说,两亲性聚合物分为线性、梳状、刷状等[6],其合成方法有接枝法、自由基聚合法、开环聚合法等[7,8]。其中,刷状聚合物是一种具有高支化的共聚物,能有效增强胶束核-壳层密度、表面的亲水性以及抗蛋白和血小板吸附能力,提升胶束稳定性,延长胶束的循环周期,从而改善载药聚合物胶束体系的控释性能[9]。杨友强等[10]通过自由基聚合和开环聚合法合成了一种具有无规疏水/pH响应结构的聚合物分子刷,疏水链段为接枝刷状结构,有利于提高胶束内核的紧密度,将聚甲基丙烯酸(PMAA)固定在胶束内核,有效避免因PMAA离子化使胶束内核过度溶胀而导致的胶束解离,从而实现可控释放。Wu等[11]采用开环聚合、酯化等多步反应合成了具有聚缩醛骨架的聚合物分子刷,自组装成棒状载药胶束,该胶束表现出良好的pH响应性,能显著提升药物的细胞摄取量。
基于肿瘤组织微环境,环境敏感性(如pH、温度或氧化还原等[12,13])聚合物胶束应运而生,在物理或化学刺激作用下,聚合物胶束结构发生改变,从而达到控制药物释放的目的。与正常细胞相比,肿瘤细胞吸收和代谢葡萄糖的速率较快,代谢过程会产生大量乳酸,这导致肿瘤细胞内呈酸性环境,pH低于正常组织细胞[14]。基于这一特性,构建具有pH响应性纳米药物载体可实现化疗药物靶向递送或定位释放于肿瘤组织[15],其设计方式有两种:一是利用pH敏感基团构建载体,如聚组氨酸、马来酸衍生物、羧化聚缩水甘油等;二是利用pH敏感化学键构建载体,如腙键、酰腙键、缩醛/酮键等[16]。Zhou等[17]采取可逆-加成断裂链转移自由基聚合(RAFT)合成了两亲性聚合物,其结构由聚甲基丙烯酰胺的骨架和2个原酸酯环的支链组成。当pH=5.0时,原酸酯基团在12h内能完全分解,药物释放量达70%,噻唑蓝(MTT)比色法验证了该材料无细胞毒性。Wang等[18,19]通过缩聚反应合成了含原酸酯的三嵌段聚合物,其纳米胶束具有良好的pH响应性、低细胞毒性和优良的抗肿瘤性。原酸酯基聚合物独特的理化性质引起众多学者的研究兴趣,成为科学家们的研究热点之一。
本课题组在原酸酯基聚合物的合成及其药物递送系统中的应用取得了初步成果,进一步验证了原酸酯基聚合物具有独特的理化特性和优异的性能[20,21]。本文以甲氧基聚乙二醇胺(mPEG-NH2)、(2-十八烷氧基-1,3-二氧戊烷-4基)甲胺(OE)、十八烷基胺(OA)和乙二醇二缩水甘油醚(GDE)为单体,经开环反应一步法合成pH敏感聚合物mPEG-GDE-OE和非pH敏感聚合物mPEG-GDE-OA。采用溶剂挥发法制备了mPEG-GDEOE胶束和mPEG-GDE-OA胶束,以阿霉素(DOX)为模型药物,探讨聚合物胶束的载药性能、体外释放性能以及载药聚合物胶束的细胞毒性与体外抗肿瘤活性。本文报道了一种两亲性聚合物mPEG-GDE-OE的绿色合成方法,该聚合物具有良好的pH响应性和生物相容性,是一种有着重要应用前景的药物载体材料。
1 实验部分
1.1 原料和试剂
三氟乙酸乙酯(CF3COOC2H5)、原甲酸三甲酯、3-氨基-1,2-丙二醇:分析纯,梯希爱(上海)化成工业发展有限公司;二氯甲烷(DCM)、三乙胺、N,N-二甲基甲酰胺(DMF)、四氢呋喃(THF)、对甲苯磺酸(p-TSA)、十八烷醇、水合肼:化学纯,国药集团化学试剂有限公司;甲氧基聚乙二醇胺(mPEG-NH2,Mn=2000)、OA、GDE、对甲苯磺酸吡啶盐、对甲苯磺酰氯、邻苯二甲酰亚胺、盐酸阿霉素(DOX·HCl):分析纯,上海阿拉丁化学试剂有限公司;二甲亚砜(DMSO)、DMEM培养基与RPMI-1640培养基(其中含10%胎牛血清、100IU/mL青霉素及100μg/mL链霉素)、MTT、双抗(青霉素-链霉素):美国Sigma公司;胰酶:上海生工生物工程有限公司;胎牛血清FBS:美国Gibco Invitrogen公司;人乳腺癌细胞(MCF-7)、人宫颈癌细胞(Hela):中国科学院典型生物保藏中心细胞库。
1.2 测试与表征
采用凝胶渗透色谱(GPC)仪(美国沃特世公司Waters1525型)测定聚合物的分子量及分子量分布,用DMF作为流动相;采用核磁共振波谱仪(美国Bruker公司AvanceⅢ400MHz型)测试核磁共振氢谱(1HNMR);采用纳米粒度仪(英国马尔文仪器有限公司Zetasizer Nano ZS型)检测聚合物胶束的粒径和粒径多分散指数;采用紫外分光光度计(上海美谱达有限公司UV-1800型)测定包封率及载药量;采用透射电子显微镜(日本JEOL公司JEM-2100型)观察胶束粒子形态;采用酶标仪(美国分子仪器公司Molecular Devices M2e型)测定吸光度;采用激光共聚焦扫描显微镜(CLSM,日本尼康公司Ti2-E型)观察载药聚合物胶束的细胞摄取情况;采用流式细胞仪(贝克曼库尔特生物科技有限公司Cytoflex A00-1-1102型)检测细胞对药物的摄取量。
1.3 实验步骤
1.3.1OE 的合成 首先,将 3-氨基-1,2-丙二醇(9.11g)溶解于 THF(60mL)中,在 N2保护和冰水浴下,缓慢滴加三氟乙酸乙酯(13.5mL),滴加完毕后,室温下搅拌反应6h后旋转除去THF,向圆底烧瓶中加入乙酸乙酯(100mL),分别用饱和硫酸氢钠水溶液(10mL×2)、饱和盐水(10mL×2)洗涤,有机相用无水碳酸钾干燥过夜,过滤旋蒸得到化合物1。
将化合物 1(9.356g)、原甲酸三甲酯(25.46g)溶于 DCM(60mL)中,加入 p-TSA(0.1g),于 N2保护下室温反应12h后,向反应液中滴加几滴三乙胺终止反应,加入二氯甲烷(30mL)稀释,分别用饱和NaHCO3水溶液(30mL×3)、饱和盐水(30mL)洗涤,有机相用无水碳酸钾干燥过夜,经过滤旋蒸干燥得到化合物2。
向圆底烧瓶中加入化合物 2(4.58g)、十八烷醇(5.40g)、对甲苯磺酸吡啶盐(0.05g),于 110℃ 真空条件下反应 12h 后,加入 THF(40mL)溶解反应物,于冰水浴下缓慢滴加NaOH 水溶液(w=4%,60mL),室温下反应4h后,用乙醚(200mL×3)萃取,合并有机相,用无水碳酸钾干燥过夜,经过滤旋蒸得到粗产物,经层析柱得到产物OE,其合成路线如图1所示。

图1 单体 OE 的合成路线Fig.1 Synthetic routes of monomer OE
1H-NMR(400MHz,CDCl3)δ:0.88(t,J=6.8Hz,3H,CH3),1.25(s,32H,CH2(CH2)16CH3),1.60~1.57(m,2H,CH2CH2CH2),2.97~2.82(m,2H,NH2CH2CH),3.54~3.49(m,2H,OCH2CH2),3.82~3.73(m,1H,(CH2)2CHO),4.37~4.05(m,2H,OCH2CH),5.83(d,J=14.2Hz,1H,CH)。
1.3.2聚合物的合成 向圆底烧瓶中加入 OE(或 OA)、mPEG-NH2和 GDE(三者的物质的量之比为 1∶1∶2)溶于干燥的 DMF(2mL)中,在 60℃ 反应 48h 后,用透析袋(截留分子量为 3500)透析 2~3d,经冷冻干燥得到聚合物mPEG-GDE-OE(或mPEG-GDE-OA),其合成路线如图2所示。mPEG-GDE-OE:产率为81%,Mn=14136,Mw=16682,PDI=1.18;mPEG-GDE-OA:产率为 85%,Mn=13638,Mw=16398,PDI=1.20。
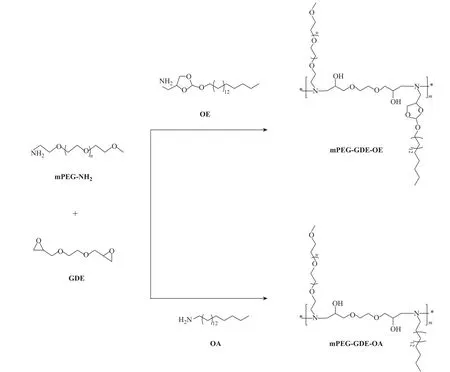
图2 聚合物的合成路线Fig.2 Synthetic routes of polymers
1.3.3聚合物胶束的制备 称取 mPEG-GDE-OE(或 mPEG-GDE-OA)10mg 溶于 THF(2mL)中,将其缓慢滴加到 10mL 磷酸盐缓冲溶液(PBS,pH=7.4)中,配成 1mg/mL 的溶液。搅拌过夜,在冰水浴下超声 10min(功率200W,工作 5s,间歇 5s)得到澄清的聚合物胶束。
1.3.4载药聚合物胶束的制备 首先对 DOX·HCl进行脱盐处理,称取 DOX·HCl(10mg)溶于甲醇(10mL)中,加入适量三乙胺(10μL),室温下避光搅拌过夜,真空干燥得到脱盐阿霉素。称取mPEG-GDE-OE(或mPEGGDE-OA)10mg 溶于 THF(2mL)中,将其缓慢滴加到 10mL 的 PBS(pH=7.4)中,配成1mg/mL 的溶液。充分搅拌后,缓慢滴入DOX的THF溶液(2mL,质量浓度约为1mg/mL),避光搅拌过夜,在冰水浴条件下超声10min得到载药聚合物胶束,其制备示意图如图3所示。
1.4 胶束的pH敏感性
用稀盐酸(0.1mol/L)调节胶束的 pH 分别为 5.0 和 7.4,然后放置于摇床中(37℃,100r/min),在 0.5、2、6、12h取样,测定胶束的粒径。
1.5 聚合物胶束的载药与体外释放特性
利用紫外-可见分光光度计测定载药聚合物胶束在480nm处的总阿霉素和游离阿霉素的吸光度,经计算,DOX/mPEG-GDE-OE、DOX/mPEG-GDE-OA 载药量分别为(9.4±1.3)%、(10.8±0.8)%,包封率分别为(94.3±1.9)%、(96.4±0.9)%,表明两种聚合物具有较好的胶束化性能和良好的载药性能。
采用动态透析法考察载药聚合物胶束的体外释放行为。精确量取1mL载药聚合物胶束DOX/mPEGGDE-OE、DOX/mPEG-GDE-OA置于透析袋(截留分子量为3500)中,分别放置于pH为7.4、6.8和5.0的20mL PBS中,并放置在37℃、100r/min的摇床中,于不同时间取样1mL,同时补充相同体积和温度的新鲜PBS释放介质。利用紫外-可见分光光度计测定取样样品的紫外吸光度,计算累积释放率,其药物释放示意图如图3所示。

图3 载药聚合物胶束的制备与药物释放示意图Fig.3 Schematic representation of drug-loaded polymeric micelles’s formation and drug release
1.6 体外细胞实验
1.6.1细胞毒性实验 以MCF-7细胞和Hela细胞为模型,研究了胶束的细胞毒性。MCF-7细胞用DMEM培养基培养,Hela细胞用RPMI-1640培养基培养。首先将培养状态良好的细胞以每孔1×104个的密度接种于96 孔板中,在 37℃、CO2体积分数为 5% 的条件下培养24h;然后分别加入100μL 聚合物胶束(0.1~200μg/mL)、游离 DOX·HCl(0.01~20μg/mL)以及载药聚合物胶束(0.01~20μg/mL)混悬液来替换原培养基,同时设阴性对照组。加药培养 48h 后,弃去含药培养基,每孔加入 100μL MTT 溶液(0.5mg/mL)孵育 4h,吸出 MTT 溶液,每孔加入100μL DMSO,用酶标仪在570nm波长下测定每孔的吸光度,并计算细胞存活率和半抑制浓度(IC50)值。
1.6.2细胞摄取实验 载药聚合物胶束对Hela细胞在6孔板中以每孔3×105个的密度进行接种,培养24h后,分别加入 2mL 游离 DOX·HCl、DOX/mPEG-GDE-OE 和 DOX/mPEG-GDE-OA(DOX 质量浓度为 5μg/mL)孵育2h或4h后,弃去含药培养基并用PBS洗涤3次,每孔加入200μL胰蛋白酶消化细胞,离心并收集细胞,将细胞分散在300μL的PBS中,利用流式细胞仪检测细胞摄取情况。
将 Hela细胞接种于共聚焦皿(每个皿含有 8×104个细胞)培养 12h,加入 500μL 游离 DOX·HCl、DOX/mPEG-GDE-OE 和 DOX/mPEG-GDE-OA(DOX 质量浓度为 5μg/mL)培养 1、2h或 4h后,弃去含药培养基并用PBS洗涤3次;然后用200μL多聚甲醛溶液(w=4%)固定细胞20min,再用PBS洗涤3次;最后加入200μL的DAPI染色30min,并用PBS洗涤3次,利用CLSM进行观察。
2 结果与讨论
2.1 聚合物的表征
聚合物的核磁共振氢谱图如图4所示。在mPEG-GDE-OE的1H-NMR谱图中,化学位移为0.88处为OE的CH3峰;1.49~1.20处为OE中烷基的CH2峰;5.82处为OE的CH特征峰,并含有mPEG-NH2的特征峰;3.5处为mPEG-NH2的OCH2CH2O特征峰。同样,在mPEG-GDE-OA的1H-NMR谱图中亦含有mPEG-NH2和OA的特征峰,由此可见,成功合成了聚合物mPEG-GDE-OE和mPEG-GDE-OA。
2.2 胶束的表征
聚合物胶束和载药聚合物胶束的粒径测定结果如图5(a)所示。mPEG-GDE-OE、mPEG-GDE-OA胶束的平均粒径分别为(168.2±4.6)nm、(157.5±3.4)nm,PDI分别为 0.223±0.013、0.234±0.049;前者比后者平均粒径略大,可能是mPEG-GDE-OE中含五元环原酸酯的OE基团比mPEG-GDE-OA中的直线型OA基团略大造成的,OE基因受到空间位阻和氢键作用,使胶束的疏水内核也有所增大。载药聚合物胶束DOX/mPEG-GDEOE、DOX/mPEG-GDE-OA 的平均粒径比相应的聚合物胶束有所增大,分别为(191.6±6.7)nm、(182.8±5.2)nm,PDI分别为0.215±0.017、0.199±0.049,这是由于包载了疏水性药物DOX所致。
由mPEG-GDE-OE胶束的TEM图(图5(b))可知,该胶束呈球形,且大小均一,粒径约120nm,比DLS法测定粒径小,这是因为透射电镜的样品需经干燥预处理,胶束的亲水外壳和疏水内核因受热脱水导致其发生收缩。
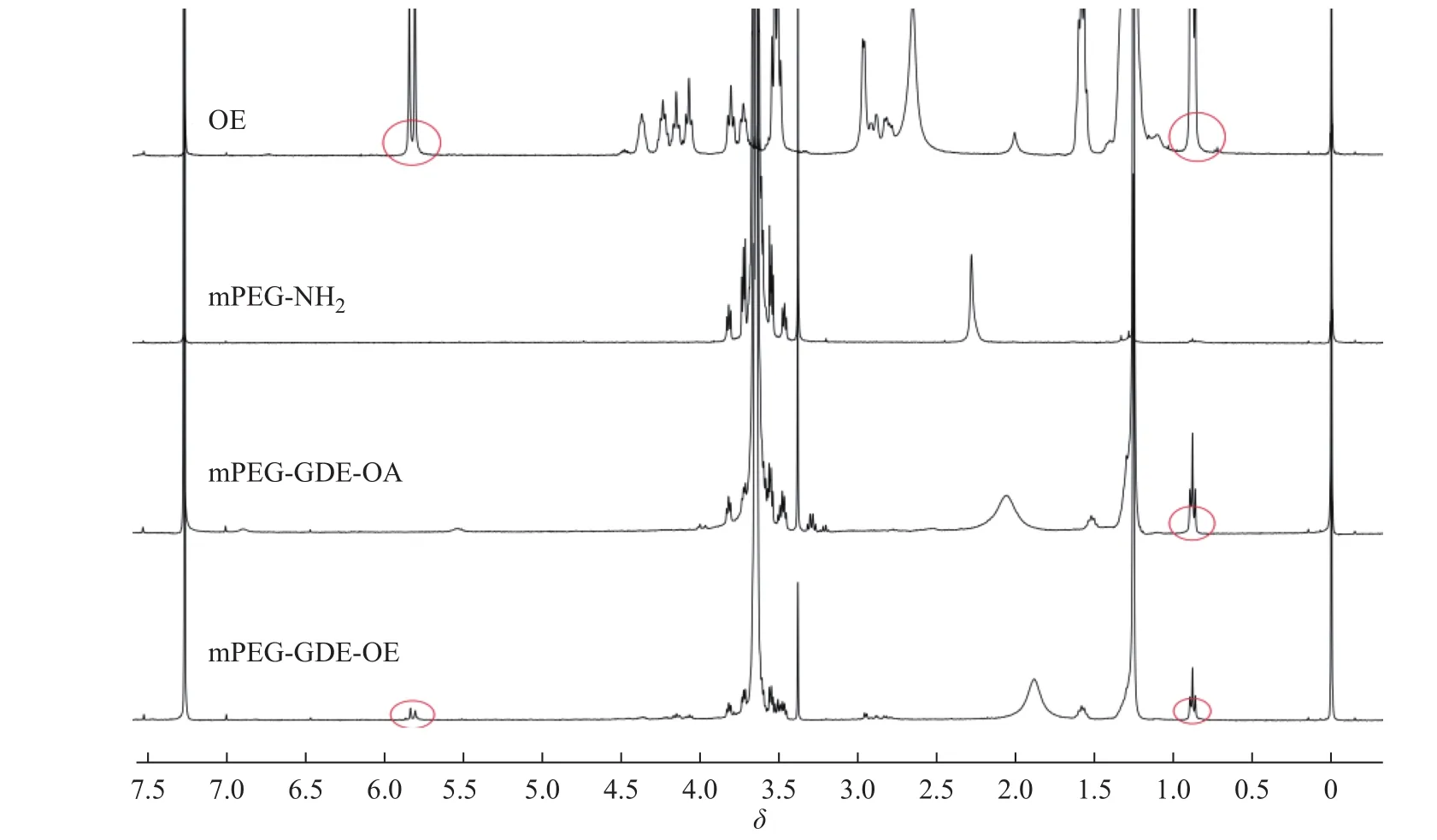
图4 聚合物的1H-NMR 谱图Fig.4 1H-NMR spectra of polymers
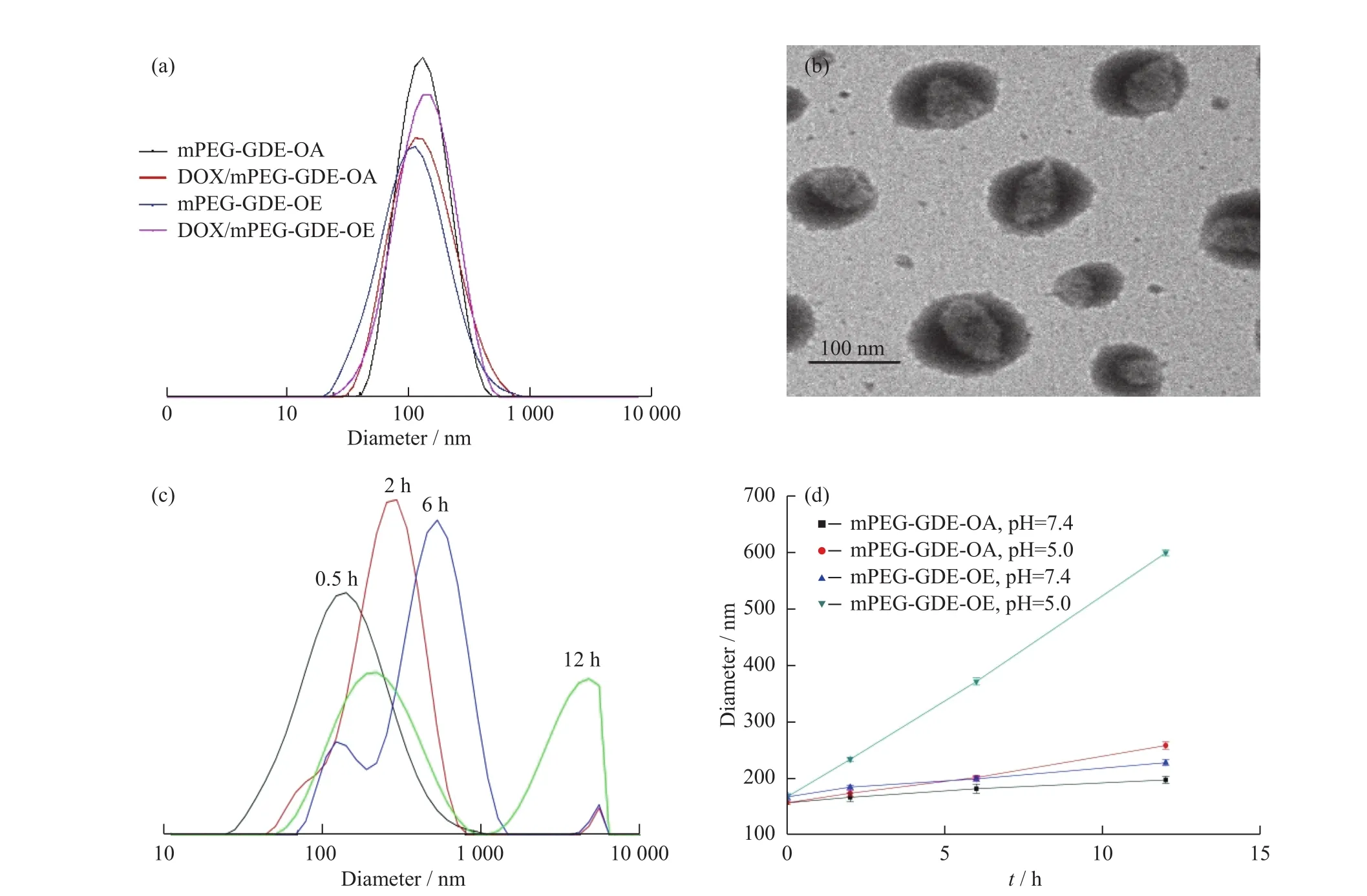
图5 (a)胶束的粒径分布;(b)mPEG-GDE-OE 胶束的 TEM 图;(c)当 pH=5.0 时,mPEG-GDE-OE 胶束的粒径分布图;(d)不同pH条件下胶束的粒径变化Fig.5 (a)Size distribution of micelles;(b)TEM image of mPEG-GDE-OE micelles;(c)Size distribution of mPEG-GDE-OE micelle at pH=5.0;(d)Size changes of micelles at different pH values
将制备好的mPEG-GDE-OE胶束分别加入pH=5.0的PBS中,在不同时间点测定胶束的粒径变化结果如图5(c)所示。由图5(c)可知,mPEG-GDE-OE胶束的粒径随着时间增加而变大,0.5h取样时,胶束粒径没有明显变化;2h 时,粒径为(232.4±3.8)nm,粒径分布变宽,说明胶束开始发生溶胀;6h 时,胶束粒径进一步变大,分布变宽,并开始有小粒子出现,说明少部分胶束开始解体;12h时胶束粒径继续增大,并出现2个峰,说明有一部分胶束分解。
将聚合物胶束分别加入不同pH的PBS中,在不同时间点测定胶束的粒径变化情况,结果如图5(d)所示。由图5(d)可知,mPEG-GDE-OA胶束在pH=7.4和pH=5.0的PBS中,胶束粒径没有明显变化;mPEGGDE-OE胶束在pH=7.4的PBS中呈现出良好的稳定性,而在pH=5.0的PBS中,随着时间延长粒径变化较大,进一步说明了mPEG-GDE-OE胶束具有pH响应性。
2.3 聚合物胶束的载药与体外释放性能
载药聚合物胶束的体外释放曲线如图6所示。由图6可知,DOX/mPEG-GDE-OA胶束在不同pH下的释放速率差别不大,累积释放率也变化不大。DOX/mPEG-GDE-OE胶束在pH=7.4时,释放速率平缓,72h累积释放率约50%;当pH=6.8时,在释放初期,释放速率略有加快,但72h后累积释放率变化不大;当pH=5.0时,释放速率明显变快,累积释放率继续增加,72h累积释放率约80%。实验结果进一步说明了DOX/mPEG-GDEOE胶束具有明显的pH响应性,其原因主要是在酸性环境中原酸酯基团的水解使载药聚合物胶束解离,从而加快了药物释放速率,提高其药物累积释放率。
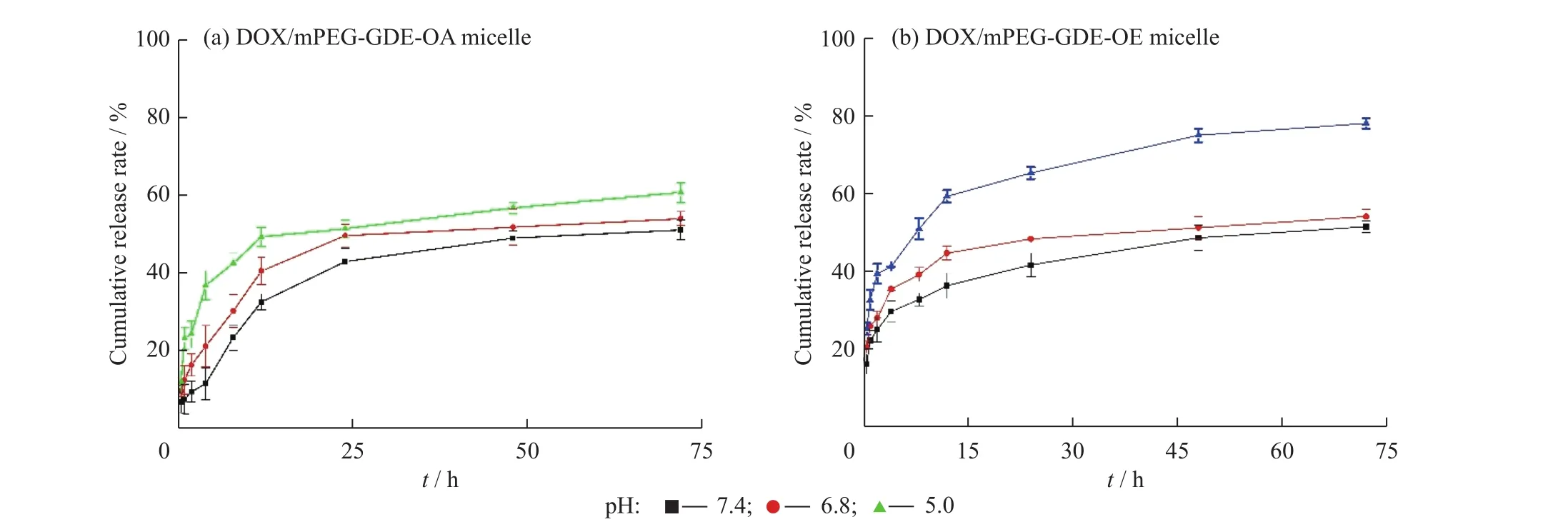
图6 胶束的体外药物释放曲线Fig.6 In vitrodrug release profiles of micelles
2.4 细胞毒性研究
聚合物胶束的体外细胞毒性实验结果如图7所示。由图7可知,MCF-7细胞及Hela细胞在聚合物胶束(聚合物质量浓度为200μg/mL)束中孵育48h后,细胞的存活率在85%以上,说明聚合物胶束对MCF-7细胞和Hela细胞的毒性较低,安全性良好,可作为药物的传递材料。
载药聚合物胶束对MCF-7细胞、Hela细胞体外的杀伤性能实验结果如图8所示。MCF-7细胞和Hela细胞的存活率随着胶束中DOX浓度的升高而降低,对于MCF-7细胞,游离DOX·HCl、DOX/mPEG-GDE-OE、DOX/mPEG-GDE-OA 的 IC50值分别为(2.22±0.08)、(2.45±0.21)μg/mL 和(4.26±0.23)μg/mL;而对于 Hela细胞,三者的 IC50值分别为(1.83±0.12)、(2.08±0.16)μg/mL 和(3.9±0.27)μg/mL。由此可知,DOX/mPEG-GDE-OA的IC50值最大,而游离DOX·HCl和DOX/mPEG-GDE-OE的IC50值差别不大,说明聚合物胶束及载药聚合物胶束对两种细胞生长有一定影响,DOX/mPEG-GDE-OE对肿瘤细胞的杀伤能力与游离DOX相当。
2.5 细胞摄取研究
利用细胞摄取DOX而产生的荧光强度来描述细胞对DOX/mPEG-GDE-OE胶束、DOX/mPEG-GDE-OA胶束和游离DOX·HCl的摄取情况,结果如图9所示。随着孵育时间延长,细胞培养孔板中的荧光强度增强,表明细胞对DOX的摄取具有时间依赖性。在每个时间点,DOX/mPEG-GDE-OE胶束的细胞摄取量均高于DOX/mPEG-GDE-OA胶束和游离DOX·HCl的细胞摄取量,由此可见,DOX/mPEG-GDE-OE胶束有利于提高细胞对DOX的摄取,并能可控药物释放,提高抗肿瘤性能。
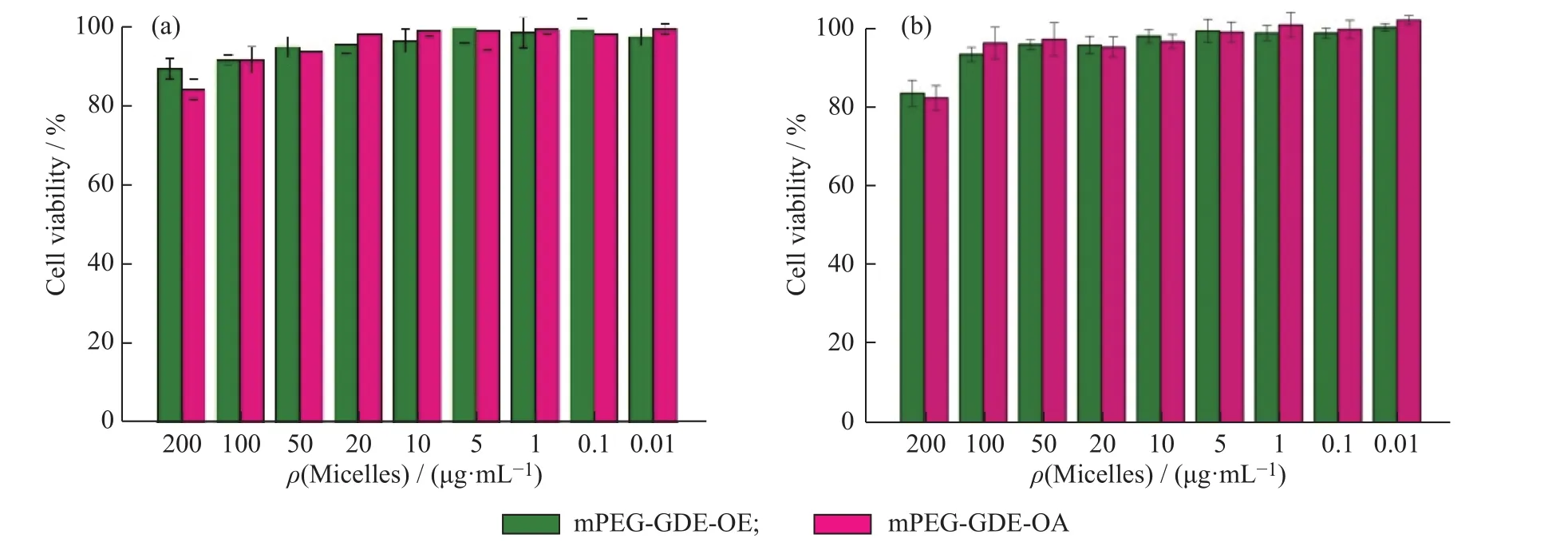
图7 聚合物胶束对 MCF-7 细胞和(a)Hela细胞(b)的体外毒性Fig.7 In vitrocytotoxicity of polymer micelles against(a)MCF-7cells and(b)Hela cells
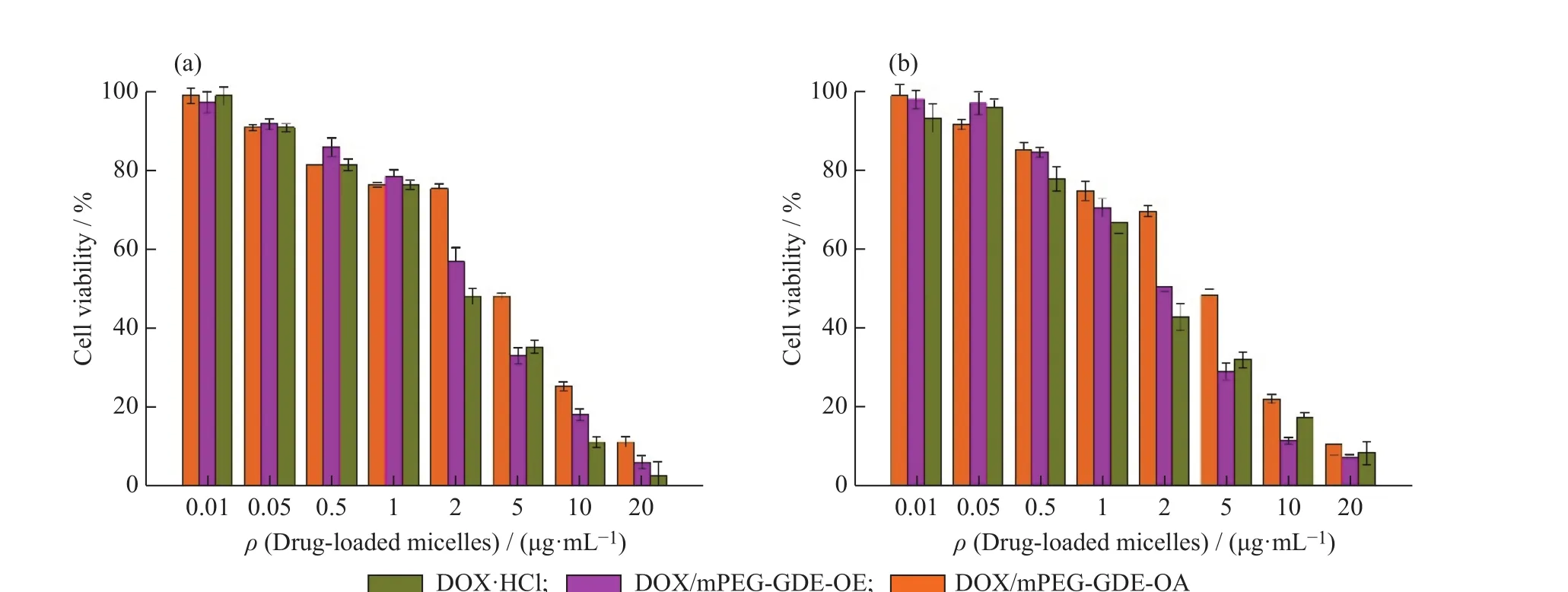
图8 载药聚合物胶束对(a)MCF-7 细胞和(b)Hela细胞的体外毒性Fig.8 In vitrocytotoxicity of drug-loaded polymer micelles against(a)MCF-7cells and(b)Hela cells

图9 载药胶束在 Hela 细胞的(a)荧光强度分布和(b)平均荧光强度Fig.9 (a)Fluorescence intensity distribution and(b)average fluorescence intensity of drug-loaded micelles in Hela cells
为了进一步确定DOX/mPEG-GDE-OE胶束、DOX/mPEG-GDE-OA胶束和游离DOX·HCl被细胞摄取的情况及在细胞内的分布情况,通过CLSM对细胞进行观察,结果如图10所示。当培养1h时,游离DOX·HCl进入细胞核,而DOX/mPEG-GDE-OE胶束、DOX/mPEG-GDE-OA胶束开始进入细胞,分布在细胞质中;当培养2h时,DOX/mPEG-GDE-OE胶束集中分布在细胞核,有部分DOX/mPEG-GDE-OA胶束被摄取到细胞核中;当培养4h时,DOX/mPEG-GDE-OE胶束进一步在细胞核聚集,DOX/mPEG-GDE-OA胶束被摄取到细胞核中的量比前者少,还有部分分布在细胞质中,说明了DOX/mPEG-GDE-OE胶束能较好地进入细胞核,并可控释放DOX,从而有效抑制肿瘤细胞生长。
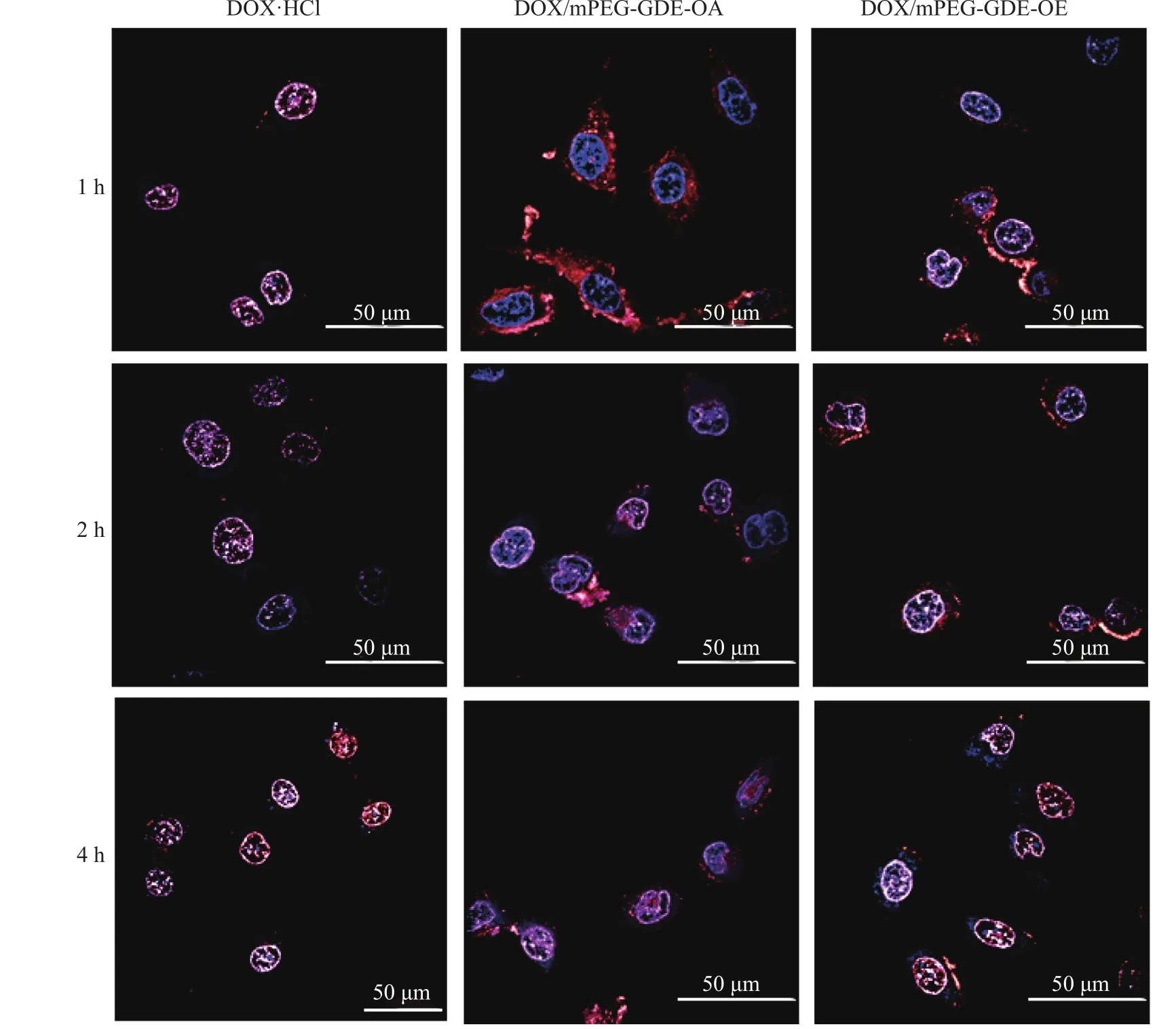
图10 DOX/mPEG-GDE-OE、DOX/mPEG-GDE-OA 胶束在 Hela 细胞中的共聚焦扫描显微镜图Fig.10 CLSM images of DOX/mPEG-GDE-OE and DOX/mPEG-GDE-OA micelles in Hela cells
3 结 论
(1)通过开环聚合反应一步法合成了pH敏感聚合物mPEG-GDE-OE和非pH敏感聚合物mPEG-GDEOA,采用溶剂挥发法制备了相应的聚合物胶束及载药聚合物胶束,其形貌呈球形、粒径分布均匀,具有良好的载药性能和包封率。
(2)与mPEG-GDE-OA胶束相比,mPEG-GDE-OE胶束能有效控制药物释放速率,并具有良好的抗肿瘤活性,且聚合物材料具有良好的细胞相容性。

