一种基于聚乳酸-聚组氨酸的新型口服药物递送载体
易翠翠, 马梦雅, 吴超慧, 王金凤, 张振中, 任雪玲
(郑州大学 1. 药物研究院; 2. 河南省肿瘤重大疾病靶向治疗与诊断重点实验室,郑州 450001)
化学药物治疗(简称化疗)是目前肿瘤治疗的主要手段[1]。尽管口服给药具有携带和服用方便,患者顺应性好等优点[2],但是由于大多数抗肿瘤药物属于疏水性分子,不仅在水中溶解度低,而且在胃肠道环境中不稳定,导致口服药物后血药浓度和生物利用度低,限制肿瘤治疗效果。同时,化疗药物副作用强,容易产生耐药性[3,4]。因此设计并构建安全、高效的口服药物递送载体以提高化疗药物的溶解性和生物利用度,降低化疗药物毒副作用,提高化疗药物治疗效率,对于肿瘤治疗具有重要意义。
两亲性嵌段共聚物是由亲水和疏水两个不同链段组成的一类高分子共聚物,在药物递送领域具有重要的应用前景[5]。一方面,这类药物载体可以在水溶液中自组装,疏水性的内核或层状结构可以高效包载疏水性药物,从而有效改善药物溶解性;另一方面,药物载体可以降低机体对药物的降解和清除作用,提高药物的生物利用度[6],通过改变共聚单体的线性长度可调节药物的释放速率,延长药物作用时间,减少给药次数[7]。但是,两亲性嵌段共聚物大多数应用于静脉给药,在口服药物递送中因苛刻的胃肠道环境使其稳定性下降[8]。因此,本文希望设计并制备一种新型的口服药物递送载体,以期增强化疗药物的生物利用度,减少给药频次,降低毒副作用,提高治疗效果。
聚乳酸(PLA)是美国食品与药品管理局批准的生物降解医用材料,也是两亲性嵌段共聚物常用的疏水性链段,具有无毒、无刺激性、可生物降解吸收的特点,常用于药物载体之一[9,10]。PLA分子链中含有酯键,易水解产生乳酸、水和二氧化碳,导致载体所在微环境酸性增强,从而影响所载药物的稳定性[11,12]。为改善PLA作为载体材料存在的缺点,通常使用其他材料对其进行改性。聚组氨酸(PLH)是一种具有良好生物相容性的高分子聚合物,在药物递送领域具有重要应用前景[13]。PLH咪唑环的不饱和氮原子上有一对孤电子对,解离常数(pKa)为6.5,可通过质子-脱质子作用实现亲疏水性的转变而具有两亲性特征。在低于pKa条件下,PLH由疏水性转变为亲水性[14,15],可作为药物载体的亲水端。目前,PLH常用作药物载体的疏水端,而其作为亲水端的研究尚鲜见报道。
本文设计了一种基于PLA-PLH的新型药物递送载体,对其进行结构表征;然后以2-甲氧基雌二醇(2-ME)作为模型药物,以结肠癌细胞株CT26为肿瘤细胞模型考察PLA-PLH/2-ME纳米粒的细胞摄取、细胞毒性和细胞迁移;最后在动物水平考察其口服后的体内分布情况,探讨其作为口服药物递送载体的可行性。结果表明:PLA与PLH通过酰胺键连接形成嵌段聚合物,在弱酸性条件下,PLA作为疏水端,PLH可作为亲水端,自组装形成纳米粒子;同时PLH降解产生的小分子组氨酸能够中和PLA载体降解所产生的酸性物质,缓解单一PLA降解所导致的局部pH过低现象。
1 实验部分
1.1 原料和试剂
2-ME(纯度≥99.5%):郑州大学药物研究院提供;PLA(Mw=5×103):济南岱罡生物科技有限公司;L-组氨酸盐酸盐(His·HCl)、2,4-二硝基氟苯、氯甲酸苄酯(CBZ-Cl)、亚硫酰氯(SOCl2)、正己胺:分析纯,上海麦克林试剂有限公司;四氢呋喃(THF)、N-羟基琥珀酰亚胺(NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl)、1,4-二氧六环:分析纯,上海阿拉丁生化科技股份有限公司;β-巯基乙醇:分析纯,美国Genview公司;异硫氰酸荧光素(FITC):分析纯,美国Sigma公司;荧光染料1,1'-二十八烷基-3,3,3',3'-四甲基吲哚并花青碘化物(DIR):北京中生瑞泰科技有限公司;氯仿、乙醚、N,N-二甲基甲酰胺(DMF)、二甲基亚砜(DMSO)、盐酸(HCl)、氢氧化钠(NaOH)、碳酸氢钠(NaHCO3):分析纯,天津市风船化学试剂科技有限公司。
小鼠结肠癌细胞株CT26:郑州大学药物研究院保存;BALB/c小鼠:(18±2) g,无特定病原体(SPF)级,雌性,河南省实验动物中心提供,许可证号为SCXK(豫)2017-0001。
1.2 测试与表征
核磁共振分析仪(德国布鲁克AVAVCE III型);傅里叶变换红外光谱仪(日本岛津RF-5301pc型):溴化钾压片,光谱扫描范围500 ~4 000 cm-1;马尔文纳米粒度仪(英国马尔文Nano-ZS90型):溶液体积为1 mL,25 ℃,平行扫描3次;荧光显微镜(日本Nikon Eclipse 80i型);酶标仪(美国DYNEX Spectra MR型):波长490 nm;小动物活体成像仪(德国布鲁克In Vivo FX PRO型)。
1.3 实验步骤
1.3.1 PLA-PLH的制备 PLA-PLH的合成路线如图1所示,首先采用文献[16~18]报道的酸酐开环反应合成PLH,然后再与PLA缩合而成PLA-PLH。
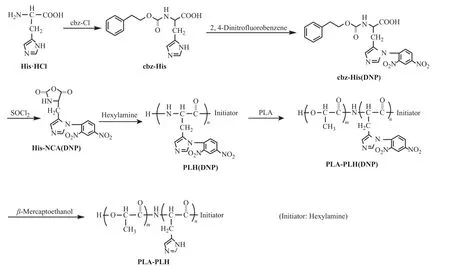
图1 PLA-PLH的合成路线Fig. 1 Synthetic route of PLA-PLH
cbz-His的合成:将 2.100 0 g His·HCl溶于 NaOH 溶液(25 mL,1 mol/L)中,0 ℃ 条件下,滴加 1.41 mL cbz-Cl,接着升至室温继续反应2 h,然后向上述反应体系中加入20 mL乙醚,反应3 h后以盐酸调节pH至产物析出,经过滤、干燥得到白色固体cbz-His。
cbz-His(DNP)的合成:将0.500 0 g cbz-His与0.600 0 mg NaHCO3溶于10 mL蒸馏水中,在冰浴条件下,依次加入 NaOH 溶液(1.2 mL,0.5 mol/L),1 mL 2,4-二硝基氟苯(216 μL)的 1,4-二氧六环溶液,在 0 ℃ 搅拌反应 8 h后,用盐酸酸化析出沉淀,过滤、干燥得黄色固体cbz-His(DNP)。
His-NCA(DNP)的合成:将0.030 0 g cbz-His(DNP)溶于25 mL 无水THF 中,加入10 μL SOCl2,室温反应40 min后,加入过量无水乙醚以沉淀产物,经过滤、真空干燥得到His-NCA(DNP)。
PLH(DNP)的合成:将 0.020 0 g His-NCA(DNP)溶于 30 mL 无水 DMF中,加入 5 μL 引发剂正己胺,在氮气保护下室温反应72 h后,以盐酸酸化析出沉淀,经过滤、干燥得黄色固体PLH(DNP)。
PLA-PLH(DNP)的合成:将 1.000 0 g PLA 溶于 50 mL CHCl3中,加入 0.115 0 g NHS、0.192 0 g EDC·HCl,室温、氮气保护下搅拌反应4 h后,向上述反应体系中加入0.756 0 g PLH(DNP),室温反应48 h后,反应液先用DMSO透析3 d,再用超纯水透析3 d,冻干即得产物PLA-PLH(DNP)。
PLA-PLH的合成:称取0.500 0 g PLA-PLH(DNP)溶于20 mL DMF中,加入7.5 mL β-巯基乙醇,在氮气保护下,室温反应24 h,将反应液用超纯水透析72 h,冷冻干燥即得目标产物PLA-PLH,转化率为26%,产率为17%。
1.3.2 PLA-PLH/2-ME的制备 将药物2-ME(激发波长为290 nm,发射波长为 318 nm)与药物载体PLA-PLH以不同质量比(0.2∶1、0.4∶1、0.6∶1、0.8∶1、1.0∶1)溶于 DMSO。随后,在搅拌条件下,将上述混合溶液缓慢滴加到pH=6.5的超纯水中。最后,经透析、冷冻干燥得到PLA-PLH/2-ME,其制备示意图如图2所示。称取5 mg PLA-PLH/2-ME纳米粒,用甲醇溶解,定容至25 mL,经超声裂解、超速离心分离得到上清液,采用荧光分光光度计测定荧光强度。按下列公式分别计算包封率(RE)与载药量(RL):


图2 PLA-PLH在水溶液中的自组装Fig. 2 Self-assembly of PLA-PLH in aqueous solution
1.3.3 PLA-PLH的体外细胞摄取 参照PLA-PLH/2-ME的制备方法制备PLA-PLH/FITC(FITC与PLA-PLH的质量比为0.6∶1)。将对数生长期的CT26细胞接种于12孔板中(每孔1.5×105个),常规培养过夜,移除旧培养基,更换为含有PLA-PLH/FITC的培养基,同时设置FITC对照组,每组设3个复孔。继续培养8 h后,弃去上清液,磷酸盐缓冲溶液洗涤3次,采用荧光显微镜观察荧光分布情况。
1.3.4 PLA-PLH/2-ME的细胞抑制率 将对数生长期的CT26细胞接种于96孔细胞培养板(每孔5.0×103个)培养至细胞汇合度约为80%,弃去原培养基,加入含有PLA-PLH/2-ME纳米粒(2-ME浓度分别为2.5、5.0、10、20、40、80、160 μmol/L,2-ME与 PLA-PLH的质量比为 0.6∶1)的培养基,同时设置 2-ME对照组,每个浓度设5个复孔。培养48 h后,每孔加入20 μL噻唑蓝(5 mg/mL),置于培养箱中继续培养4 h,弃去上清液,每孔再加入150 μL的DMSO,低速振荡(1.0×102r/min)至孔内紫色结晶溶解完全,采用酶标仪测定490 nm波长处的吸光度[19],计算细胞抑制率(RI)并进行显著性分析(**P<0.01, ***P<0.001)。
1.3.5 PLA-PLH/2-ME抑制细胞迁移 将对数生长期的CT26细胞接种于12孔细胞培养板,每孔2.0×105个,培养至细胞汇合度约为80%,用10 μL枪头在细胞板底部划出一条笔直的横线,磷酸盐缓冲溶液洗涤,除去漂浮细胞,加入含有PLA-PLH/2-ME(2-ME浓度为80 μmol/L,2-ME与PLA-PLH质量比为0.6∶1)的培养基,同时设置2-ME对照组和NC对照组,置于CO2培养箱继续培养至特定时间(0、12、24、36 h)于显微镜下观察细胞迁移情况并拍照。
1.3.6 PLA-PLH的体内组织分布 按照PLA-PLH/2-ME的制备方法制备PLA-PLH/DIR(m (DIR)/m (PLAPLH)=0.6∶1),DIR载药量为33.7%。分别将DIR、PLA-PLH/DIR(DIR质量浓度为1.00 mg/mL)按每只小鼠200 μL的剂量,经口饲喂BALB/C小鼠,随后在不同时间点(1、8、24 h)用小动物活体成像仪拍照,并在24 h脱颈处死小鼠,解剖主要脏器(心、肝、脾、肺、肾、胸腺与结肠),观察荧光分布情况。
2 结果与讨论
2.1 PLA-PLH的结构表征
反应原料、中间体及目标产物的FT-IR谱图如图3所示。与His·HCl相比,cbz-His的FT-IR谱图中,3 412 cm-1处的氨基伸缩振动峰消失,并新增了1 738 cm-1处的羰基伸缩振动峰,说明cbz-His制备成功。与cbz-His相比,cbz-His(DNP)的FT-IR谱图在2 930 cm-1处出现了苯环的伸缩振动峰,说明cbz-His(DNP)制备成功。与 cbz-His(DNP)相比,His-NCA(DNP)的谱图出现了羰基峰(1 785 cm-1),证明 His-NCA(DNP)的合成。与 His-NCA(DNP)相比,在 PLH(DNP)的谱图上观察到酸酐羰基峰(1 785 cm-1)的消失,证明 PLH(DNP)的合成。与PLH(DNP)相比,PLA-PLH(DNP)的FT-IR谱图中,在3 442 cm-1处出现了PLH(DNP)的氨基伸缩振动峰,在1 631 cm-1处出现了苯环的伸缩振动峰,且在 1 759 cm-1处出现了羰基伸缩振动峰,证明PLA-PLH(DNP)合成成功。PLA-PLH的FT-IR谱图与PLA-PLH(DNP)相比并没有明显变化,需要进一步进行核磁表征。
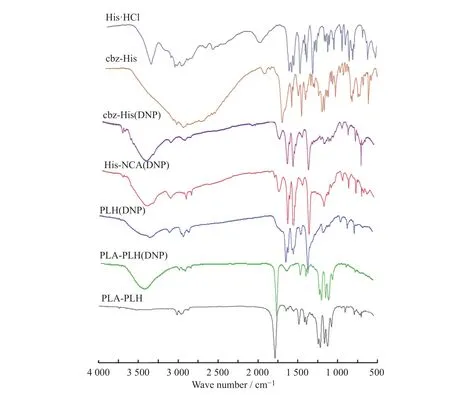
图3 样品的红外光谱图Fig. 3 FT-IR spectra of samples
样品的1H-NMR表征结果如图4所示。与PLA相比,PLA-PLH(DNP)在化学位移8~9处出现了新质子峰,PLA-PLH(DNP)在4~5处出现了CH—NH—CO的质子峰,表明成功合成PLA-PLH(DNP)。在PLA-PLH的1H-NMR谱图中,可以明显看到在8~9处2,4-二硝基氟苯基团峰消失,证明脱保护成功。1H-NMR进一步验证FT-IR结果,表明PLA-PLH成功合成。
2.2 PLA-PLH的粒径与电位表征
PLA-PLH具有两亲性,因此理论上PLA-PLH在水溶液中会自组装成亲水性PLH在外、疏水性PLA在内的结构。利用动态光散射法进行粒径与电位的测定,实验结果如图5所示。PLA-PLH纳米粒的粒径为(224.93±13.05) nm,电位为(5.42±1.01) mV,表明 PLA-PLH 可以形成纳米结构,同时 ζ-电位的电正性也进一步验证了PLH在外的结构特征,这是因为PLH咪唑环的不饱和氮具有电正性。
2.3 PLA-PLH/2-ME纳米粒的制备
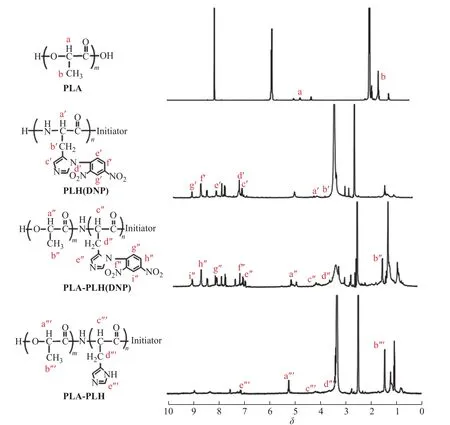
图4 样品的1H-NMR谱图Fig. 4 1H-NMR spectra of samples
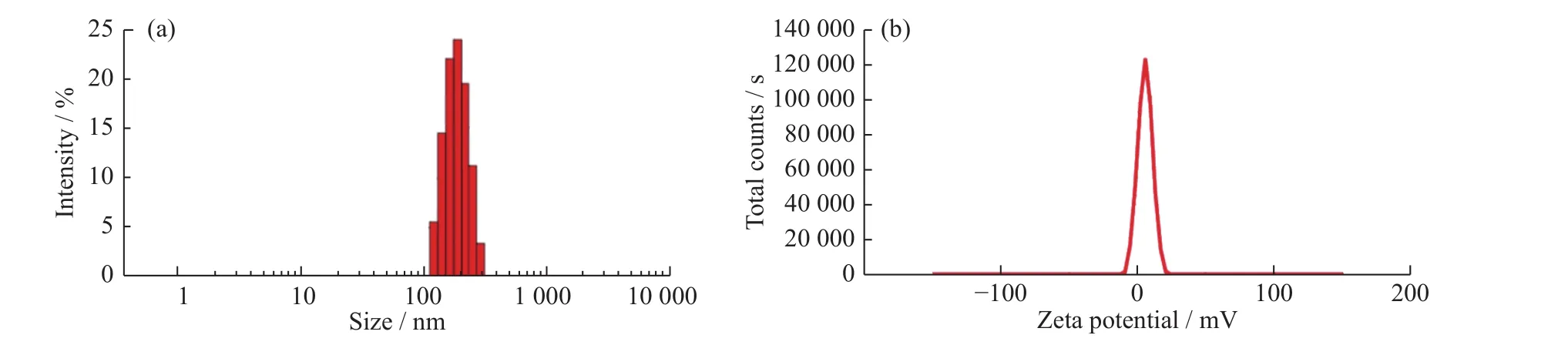
图5 PLA-PLH 的(a)粒径与(b)电位Fig. 5 (a)Particle size and (b) potential of PLA-PLH
采用溶剂交换法制备得到的PLA-PLH/2-ME的载药量与包封率如图6(a)所示。随着药物与载体投料比的增加,PLA-PLH的载药量逐渐增大。当投料比为0.6∶1时,PLA-PLH的载药量增加到(27.86±0.19)%,包封率达到最大((64.38±0.50)%);当投料比继续增加时,PLA-PLH的载药量没有明显提高,包封率显著降低。因此,后续实验中投料比均为0.6∶1。以上实验结果说明,PLA-PLH能够有效负载2-ME。
PLA-PLH负载2-ME后粒径与电位如图6(b)所示,2-ME负载前后,PLA-PLH的粒径与电位均没有明显变化,表明2-ME包裹至纳米粒内部,且PLA-PLH负载2-ME后,依然能够维持良好的纳米结构。
2.4 PLA-PLH/2-ME的体外细胞实验研究
采用PLA-PLH负载FITC考察CT26细胞对PLA-PLH的摄取情况,结果如图7(a)所示。摄取8 h后,游离FITC组与PLA-PLH/FITC组的CT26细胞内均能观察到绿色荧光,但是与游离FITC组相比,PLA-PLH/FITC组细胞内荧光强度显著增强,表明PLA-PLH纳米粒能够显著提高CT26细胞对FITC的摄取效率。
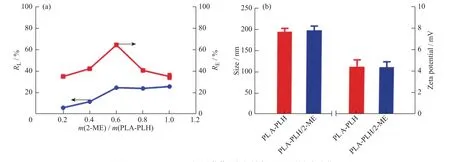
图6 PLA-PLH/2-ME的(a)载药量与包封率以及(b)粒径与电位Fig. 6 (a)Drug loading and encapsulation efficacy,(b)particle size and potential of PLA-PLH/2-ME
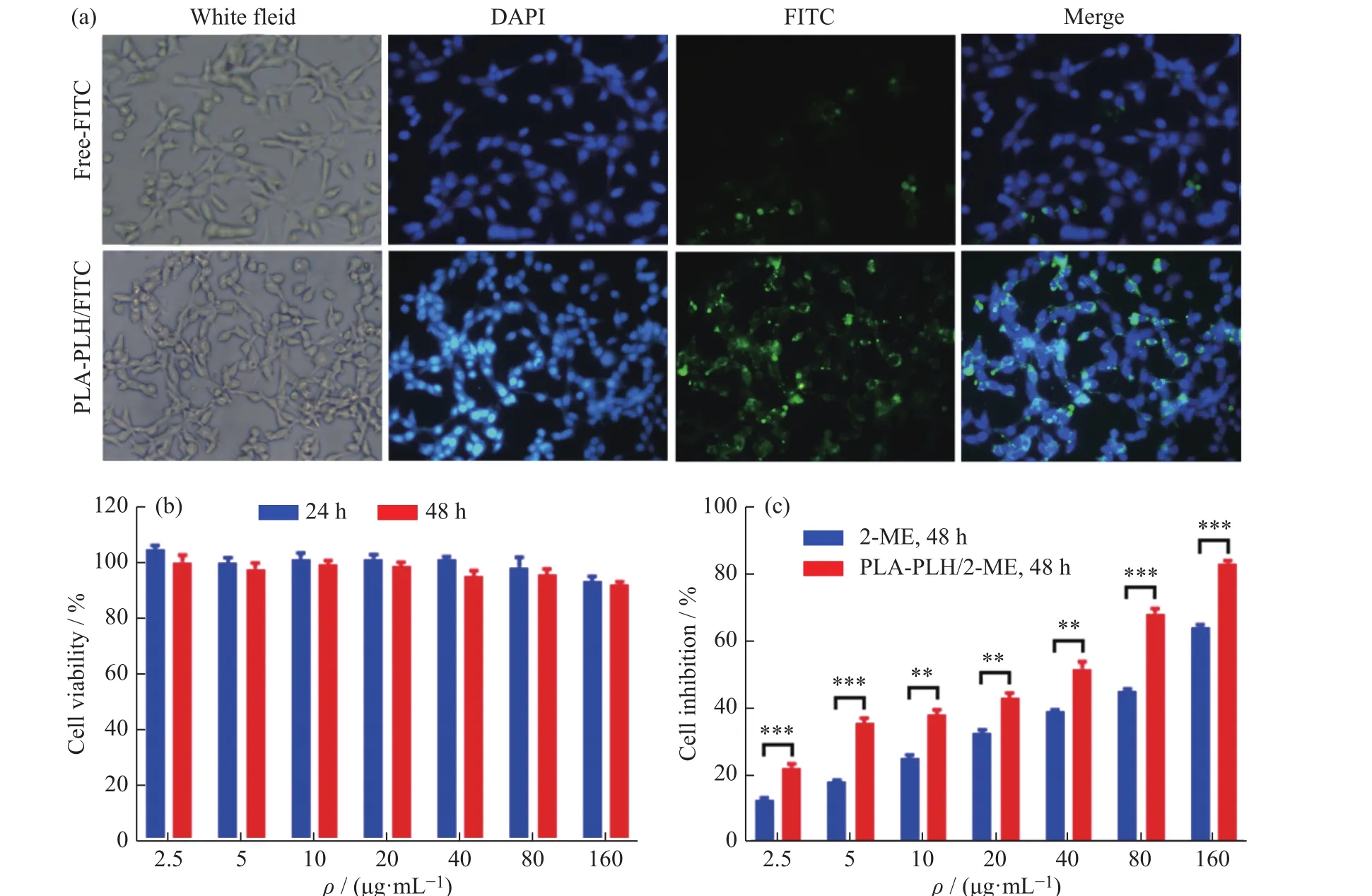
图7 (a)CT26细胞摄取成像(200×);(b)PLA-PLH对 CT26 细胞的细胞毒性测定结果;(c)2-ME 和 PLA-PLH/2-ME 对 CT26 细胞的细胞抑制率测定结果Fig. 7 (a)Cell uptake imaging of CT26 cells (200×);(b)Cytotoxicity results of CT26 cells with PLA-PLH;(c)Cell inhibition results of CT26 cells with 2-ME and PLA-PLH/2-ME
药物载体PLA-PLH的细胞毒性结果如图7(b)所示。当作用时间为24 h或48 h时,随着PLA-PLH质量浓度的不断增加,CT26细胞的存活率有所下降;然而,即使PLA-PLH的质量浓度增加到160 μg/mL,CT26肿瘤细胞的存活率仍然高于85%。表明空白载体PLA-PLH对CT26细胞增殖率的影响具有剂量和时间依赖性,但未表现出明显的增殖抑制作用。PLA-PLH/2-ME的细胞毒性实验结果如图7(c)所示。当作用48 h后,随着药物质量浓度的增加,游离药物2-ME与PLA-PLH/2-ME对CT26细胞的增殖均具有抑制作用,且具有浓度依赖性。与2-ME组相比,PLA-PLH/2-ME组CT26细胞的抑制率显著增加,表明PLA-PLH可以提高2-ME对肿瘤细胞的杀伤作用,增强2-ME的抗肿瘤活性。
利用细胞划痕实验考察纳米粒PLA-PLH/2-ME对CT26细胞迁移的影响,结果见图8。随着培养时间的延长,各组CT26细胞均逐渐向划痕间隙迁移。与NC组和2-ME组相比,PLA-PLH/2-ME组的细胞迁移显著减慢,说明PLA-PLH能够显著提高2-ME对细胞迁移的抑制作用。

图8 PLA-PLH/2-ME抑制CT26细胞迁移情况Fig. 8 PLA-PLH/2-ME suppressed the migration of CT26 cells
2.5 PLA-PLH的体内组织分布
用DIR染料作为荧光标记物,使用活体成像对口服灌胃后的DIR、PLA-PLH/DIR体内分布情况进行考察,结果如图9(a)所示。经口给药后,随着时间的延长,DIR组与PLA-PLH/DIR组小鼠体内总荧光强度均不断降低。但是与游离DIR组相比,PLA-PLH/DIR组小鼠体内荧光强度显著增加。口服给药24 h后,脱颈处死小鼠,解剖主要脏器进行荧光成像,结果见图9(b),相比于DIR组在各脏器均有荧光分布,PLA-PLH/DIR组的荧光主要集中于结肠。实验结果表明,PLA-PLH可以显著延长DIR在小鼠体内的滞留时间。更为重要的是,PLA-PLH/DIR可以高效进入小鼠肠组织,说明PLA-PLH是一种高效的口服递送载体,可以降低机体对DIR的降解和清除作用,提高DIR的生物利用度。
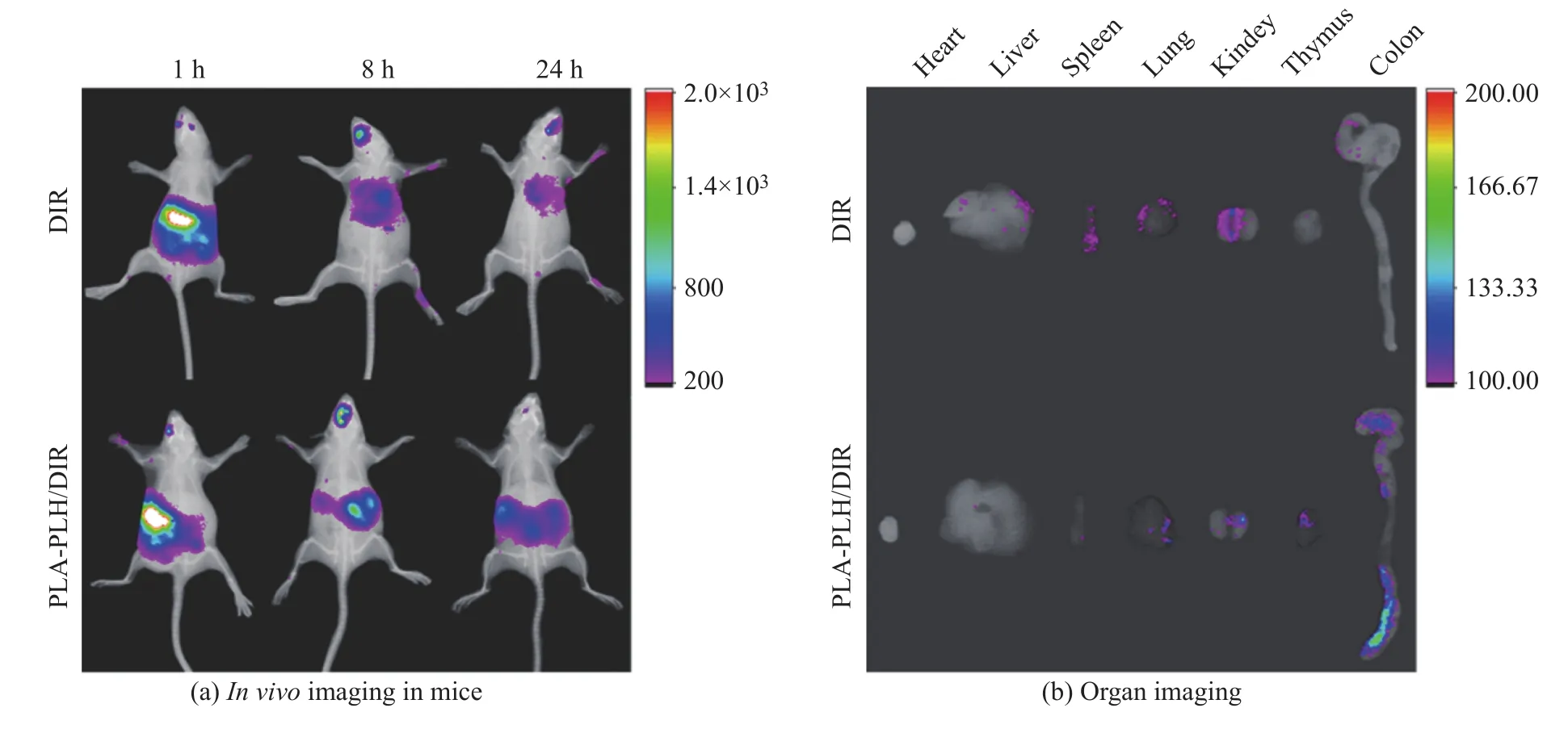
图9 DIR与PLA-PLH/DIR的体内分布Fig. 9 Distribution of DIR and PLA-PLH/DIR in vivo
3 结 论
(1)基于聚组氨酸与聚乳酸成功构建了两亲性嵌段共聚物PLA-PLH,并将其作为纳米药物载体。
(2)PLA-PLH纳米粒可以提高药物的细胞摄取,增强药物对肿瘤细胞的增殖与迁移的抑制作用。
(3)PLA-PLH可以降低药物在胃肠道的降解,提高药物的生物利用度。

