小麦矮秆突变体jm22d响应赤霉素处理的转录组学分析
方汉顺,谢永盾,曾伟伟,郭会君,熊宏春,赵林姝,古佳玉,徐延浩,刘录祥*
1.长江大学农学院,主要粮食作物产业化湖北省协同创新中心,湖北 荆州 434025;2.中国农业科学院作物科学研究所,国家农作物基因资源与基因改良重大科学工程,国家农作物航天诱变技术改良中心,北京 100081
小麦是我国第三大粮食作物,逐步提高产能并改良品质是保障国家粮食安全的重要基础。株高是影响小麦产量和品质的重要性状,20世纪60年代,矮秆基因的利用显著提高了小麦的产量,引发了“绿色革命”[1]。目前小麦中已经发现的矮秆基因共有25个,其中用于生产应用的主要有Rht-1、Rht-2和Rht8,可利用的矮秆遗传基础狭窄[2]。因此,发掘新的矮秆基因资源并解析降秆机理对丰富小麦矮秆基因遗传多样性具有重要作用。
植物的生长发育受到多种植物激素的影响,包括生长素(auxin,IAA)、赤霉素(gibberellin,GA)、脱落酸(abscisic acid,ABA)、细胞分裂素(cytokinin,CTK)、油菜素内酯(brassinosteroids,BRs)、茉莉素(jasmonate,JA)、乙烯(ethylene)、水杨酸(salicylic acid,SA)和独脚金内酯(strigolactones,SL)等,它们既相互独立又能协同作用调控植物的生长发育及其对环境的适应能力[3]。研究表明,植物激素的合成代谢途径和信号转导途径异常均会引起植株矮化[4]。拟南芥、水稻和玉米中编码KS和GA3ox的基因发生突变,会导致内源赤霉素合成缺陷,引起植株产生矮化表型[5-8]。生长素转录调控中的3个关键因子是TIR1/AFB、ARF和Aux/IAA,在拟南芥中超表达AtARF19基因会引起植株严重矮化[9],水稻的OsIAA25基因功能丧失导致突变体株高明显降低[10]。P450单加氧酶是BR合成中重要的催化酶,其功能的缺失能够导致水稻突变体dwarf2矮化,外施BR可以恢复正常表型[11]。
突变体创制在新品种培育、基因资源挖掘和分子机制研究中发挥了十分重要的作用。利用γ射线辐射、激光处理、低能重离子注入、航天诱变等诱变技术,可以提高突变发生的频率,获得自然变异难以获得的突变性状,为育种工作提供丰富的材料,缩短育种周期[12-16]。根据联合国粮农组织和国际原子能机构联合处(FAO/IAEA)突变品种数据库(http://mvd.iaea.org/)最新统计,利用诱变技术已经成功培育出3 320个突变品种,其中小麦突变品种263个,由中国育成的小麦突变品种为164个,占总量的64%,这些品种具有高产、优质和抗逆等优良性状。
转录组测序是利用高通量测序技术将细胞或组织中的mRNA进行测序分析的技术,目前在植物的突变体、胁迫、抗病等研究领域应用广泛[17-18]。Xiong等[19]通过RNA-seq对小麦耐盐突变体的研究表明,氧化还原过程对突变体的耐盐性具有重大影响。栾海业等[20]发现叶绿体形成和发育相关基因的表达受到抑制,导致光合作用下降可能是大麦突变体al形成白化颖壳的原因。本研究以小麦品种济麦22(WT)及矮秆突变体jm22d为材料,鉴定二者的表型差异,利用转录组学比较分析,筛选差异表达基因,通过功能注释和通路富集分析,以期为解析突变体致矮机理提供更多线索。
1 材料与方法
1.1 试验材料
供试材料为济麦22(野生型,WT)及其矮秆突变体jm22d。jm22d由济麦22经过γ射线辐照诱变获得,经过多年田间表型鉴定,突变体矮化性状稳定。
1.2 试验方法
1.2.1株高相关性状调查 自拔节期起,每两天随机选取田间长势均匀的WT和jm22d植株各20株,监测株高的动态变化;在成熟期,分别考察WT和jm22d的株高、节间数和节间长度,每个材料随机选取100株。
1.2.2茎秆细胞学观察 在植株的抽穗期,截取穗下第一节间中部1 cm的部位,各设置3个重复,放入FAA固定液(福尔马林:乙酸:70%乙醇=1∶1∶18)中固定48 h;依次通过体积分数为70%、85%、95%、100%的乙醇溶液进行脱水后,放入体积比为2∶3和3∶2的二甲苯乙醇混合液各1 h;将浸入纯二甲苯溶液1 h后的材料放入石蜡与二甲苯比例为1∶1的混合液中14 h,再浸入纯石蜡中包埋,烘箱温度设置为60 ℃,每隔8 h更换一次石蜡,更换两次;使用轮转式切片机将石蜡切成16 μm厚的蜡带,42℃烤片机进行展片;用二甲苯溶解石蜡,再将切片依次浸入浓度为100%、95%、85%和70%的酒精各5 min复水,之后将切片染色4 h;用OLYMPUS显微镜观察,DP2-BSW成相并拍摄照片,随机选取同一视野里的400个细胞测量长度。
1.2.3赤霉素含量测定 准确称量抽穗期新鲜植物叶片和茎秆样品各1 g,于液氮中研磨至粉碎;向粉末中加入10 mL异丙醇/盐酸提取缓冲液,同时加入8 μL 1 μg·mL-1的内标溶液4 ℃震荡30 min;加入20 mL二氯甲烷,4 ℃震荡30 min;4 ℃,13 000 r·min-1离心5 min,取下层有机相;避光,以氮气吹干有机相,以400 μL甲醇(0.1%甲酸)溶解;过0.22 μm滤膜,进HPLC-MS/MS检测。以甲醇(0.1%甲酸)为溶剂分别配制梯度为0.1、0.2、0.5、2.0、5.0、20.0、50.0、200.0 ng·mL-1的GA1、GA3、GA4、GA7标准溶液,并加入终浓度为20 ng·mL-1的内标溶液,每个浓度做3个重复。
1.2.4外源赤霉素处理 选取饱满完整的jm22d和WT种子,用10%的次氯酸钠溶液浸泡20 min,冲洗种子至无刺激性气味,使用蒸馏水在室温条件下浸种24 h,种子萌动露白后移至4℃冰箱放置2 d。将种子整齐摆放于发芽架上,置于恒温光照培养箱中,温度设置为21 ℃,光照时间为12 h,使用霍格兰营养液培养3 d,待发芽整齐一致后,对照组继续使用霍格兰营养液培养,实验组换为含20 μmol·L-1赤霉素的霍格兰营养液进行培养。
1.2.5叶绿素含量测定 配制丙酮:乙醇=2∶1的提取液,向试管中加入10 mL提取液,将叶片剪碎成宽度小于1 mm的细丝或者小块,称取0.1 g剪碎的叶片置于有提取液的试管中,密封室温黑暗条件下浸提;当用肉眼观察到叶组织完全变白时,定容至15 mL,黑暗条件保存备用;每个样品设置4个重复,以提取液为参考,测定在645 nm和663 nm处的吸光度,利用Arnon法计算叶绿素含量[21],公式如下:CT=Ca+Cb,Ca=(12.7A663-2.59A645)×(V/M),Cb=(22.9A645-4.67A663)×(V/M),其中CT为总叶绿素含量,Ca为叶绿素a的含量,Cb为叶绿素b含量,V为提取液体积,M为样品重量。
1.2.6RNA提取和cDNA文库的构建、测序 分别在赤霉素处理0(D0)、1(D1)和3 d(D3)时进行取样,各组别的材料选取7株长势均匀的幼苗,截取基部第一片叶下约1.5 cm的部分,设置3个生物学重复。根据试剂说明书的步骤,使用TRNzol-A+ Reagent试剂盒(天根生化科技有限公司)提取总RNA,通过Nanodrop 2000进行质量和浓度检测,1%琼脂糖电泳检测RNA样品的完整性。
cDNA文库由选取的7株幼苗的总RNA等量混合而成。野生型的样本文库命名为:WT_D0、WT_D1、WT_D3,突变体的命名规则与野生型相同。样品检测合格后,用带有Oligo(dT)的磁珠富集真核生物mRNA,加入Fragmentation Buffer将mRNA随机打断,以mRNA为模板合成第一条cDNA链,然后加入缓冲液、dNTPs、RNase H和DNA polymerase I合成第二条cDNA链,对纯化的双链cDNA进行末端修复、加A尾并连接测序接头,然后用AMPure XP beads进行片段大小选择,文库构建成功后,用Illumina平台进行测序。cDNA文库的构建和测序由北京百迈客生物科技有限公司完成。
1.2.7测序原始数据过滤 对测序产生的原始数据进行过滤,流程如下:过滤掉含有接头的Reads;过滤含N(不确定碱基)的比例大于10%的Reads;过滤质量值Q≤10的碱基数占整条Read 50%以上的Reads。将过滤后获得的高质量Clean Reads与小麦参考基因组进行比对,对测序产出的数据和比对情况进行统计。
1.2.8基因表达定量和差异表达基因(DEGs)分析 利用StringTie最大流量算法,采用FPKM作为衡量转录本或基因表达水平的指标。利用DEseq软件对样品间的差异表达基因进行筛选,将Fold Change≥2,FDR<0.05作为筛选标准,分别对野生型和突变体在对应时间点的差异表达基因进行分析。分别利用GOseq R包和KOBAS软件对差异表达基因的GO功能和KEGG通路进行富集分析。
1.2.9qRT-PCR验证分析 随机选取9个差异表达基因,以β-Actin为内参基因,使用Beacon Designer 7.0软件设计特异性引物(表1)。采用All-in-One First-Strand cDNA Synthesis SuperMix反转录试剂盒(北京全式金生物技术有限公司)合成cDNA。用Top Green qPCR SuperMix荧光定量试剂盒(北京全式金生物技术有限公司)进行荧光定量PCR,反应仪器为Bio-Rad CFX 96(美国伯乐),反应程序为94 ℃ 30 s;94 ℃ 5 s,60 ℃ 15 s,72 ℃ 10 s,40个循环。采用2-ΔΔ t算法进行相对定量分析。

表1 qRT-PCR引物序列Table 1 The primers of qRT-PCR
2 结果与分析
2.1 株高表型鉴定
jm22d成熟期株高为53±1.8 cm,比WT低约20 cm。自拔节期起,jm22d的株高始终低于WT植株,各时期二者的株高差异均达到统计学水平(P<0.01)(图1D)。jm22d有4个节间,少于WT的5个节间,并且jm22d各节间长度均小于WT各节间(P<0.01),其中穗下第四节间缩短程度最大(43.8%,图1E)。因此,节间数目的减少以及节间长度的缩短是jm22d株高降低的主要原因。
2.2 茎秆细胞学分析
jm22d茎秆细胞的平均长度为192.8 μm,低于WT的茎秆细胞长度(279.2 μm,P<0.01),jm22d的细胞长度相较于WT缩短约31%(图2)。由此推测,jm22d节间长度的缩短是由节间细胞长度的缩短导致的。
2.3 赤霉素含量分析
jm22d叶片中赤霉素的总含量高于WT,其中GA4的含量是WT的1.8倍,差异具有统计学意义(P<0.01),GA1、GA3和GA7的含量较对照无统计学差异(图3)。而jm22d茎秆中赤霉素总含量低于WT(P<0.01),其中WT茎秆中GA1含量为jm22d的2.8倍,GA4含量为jm22d的1.5倍,差异均具有统计学意义(P<0.01);而jm22d的GA7含量为WT的2.1倍,差异具有统计学意义(P<0.01);两者中GA3的含量无统计学差异(图3)。

A:拔节期;B:抽穗期;C:成熟期;D:株高动态变化;E:株高及各节间长度图1 株高表型鉴定Fig.1 Plant height phenotype of WT and jm22d
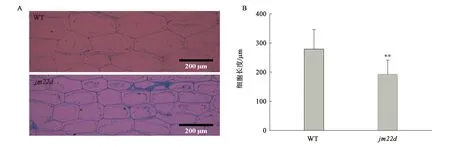
A:细胞显微照片;B:细胞长度。**—与WT相比,差异具有统计学意义(P<0.01)。图2 茎秆细胞观察Fig.2 The observation of stem cell
2.4 赤霉素对WT和jm22d苗期性状的影响
如图4所示,WT和jm22d在未施加赤霉素处理(D0)和施加赤霉素处理的第1天(D0)、第3天(D3)时,株高和根长随时间逐渐增加,但是赤霉素处理和对照组的苗高和根长均无显著差异,说明jm22d为赤霉素不敏感型突变体;而jm22d与WT相比,其苗高和根长在D0、D1和D3 3个时间点均极显著小于WT。
2.5 叶绿素含量分析
在赤霉素处理0(D0)、1(D0)和3 d(D3),对jm22d和WT取样提取叶绿素,利用分光光度计法,根据Arnon算法计算二者在3个时间点体内叶绿素含量的变化。结果(图5)显示,在赤霉素处理0天时,jm22d体内叶绿素含量极显著高于WT;赤霉素处理1和3 d后,jm22d中叶绿素含量呈下降趋势,而WT中叶绿素含量呈上升趋势。赤霉素处理1 d后,jm22d体内叶绿素含量开始高于WT,但未达到显著差异。赤霉素处理3 d后,jm22d中叶绿素含量极显著低于WT。由此说明持续的赤霉素处理对jm22d体内叶绿素的合成具有明显的抑制作用。
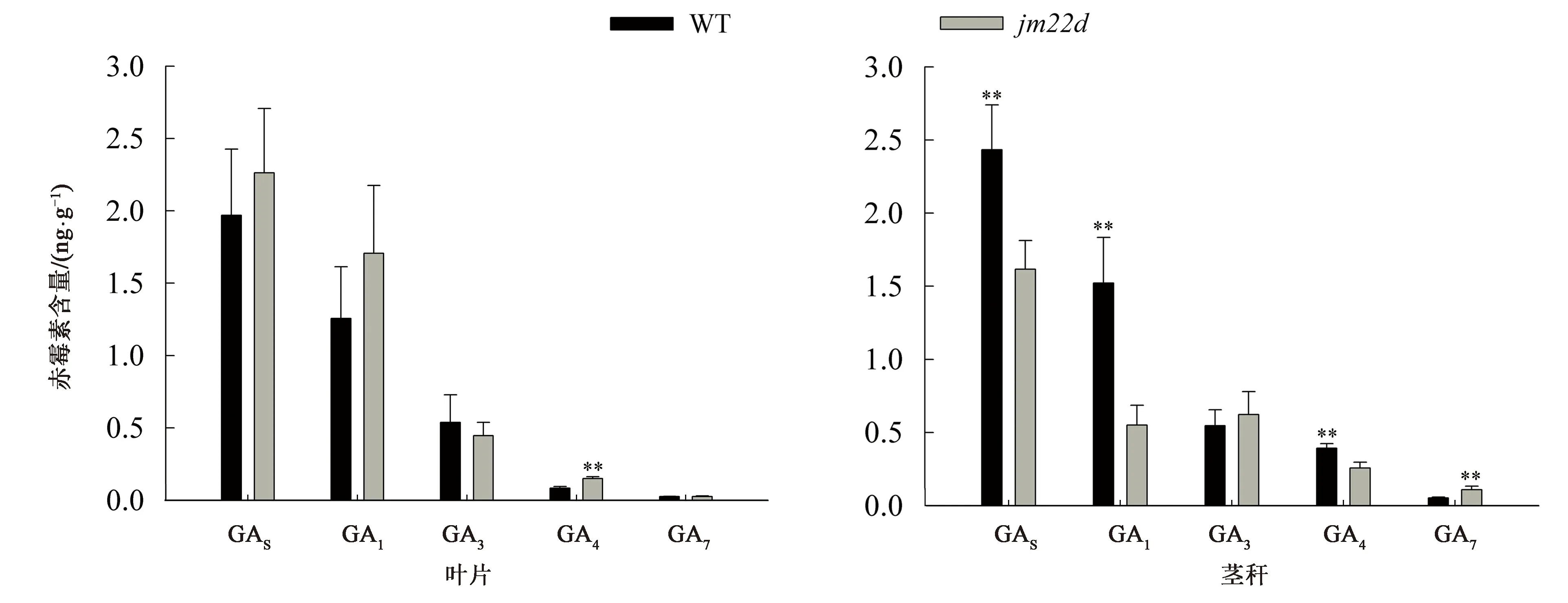
**—与同组WT相比,差异具有统计学意义(P<0.01)。图3 赤霉素含量测定Fig.3 The concentration of gibberellin

A:幼苗表型;B:株高;C:根长图4 赤霉素处理后幼苗表型Fig.4 Phenotype of GA-treated wheat seedlings
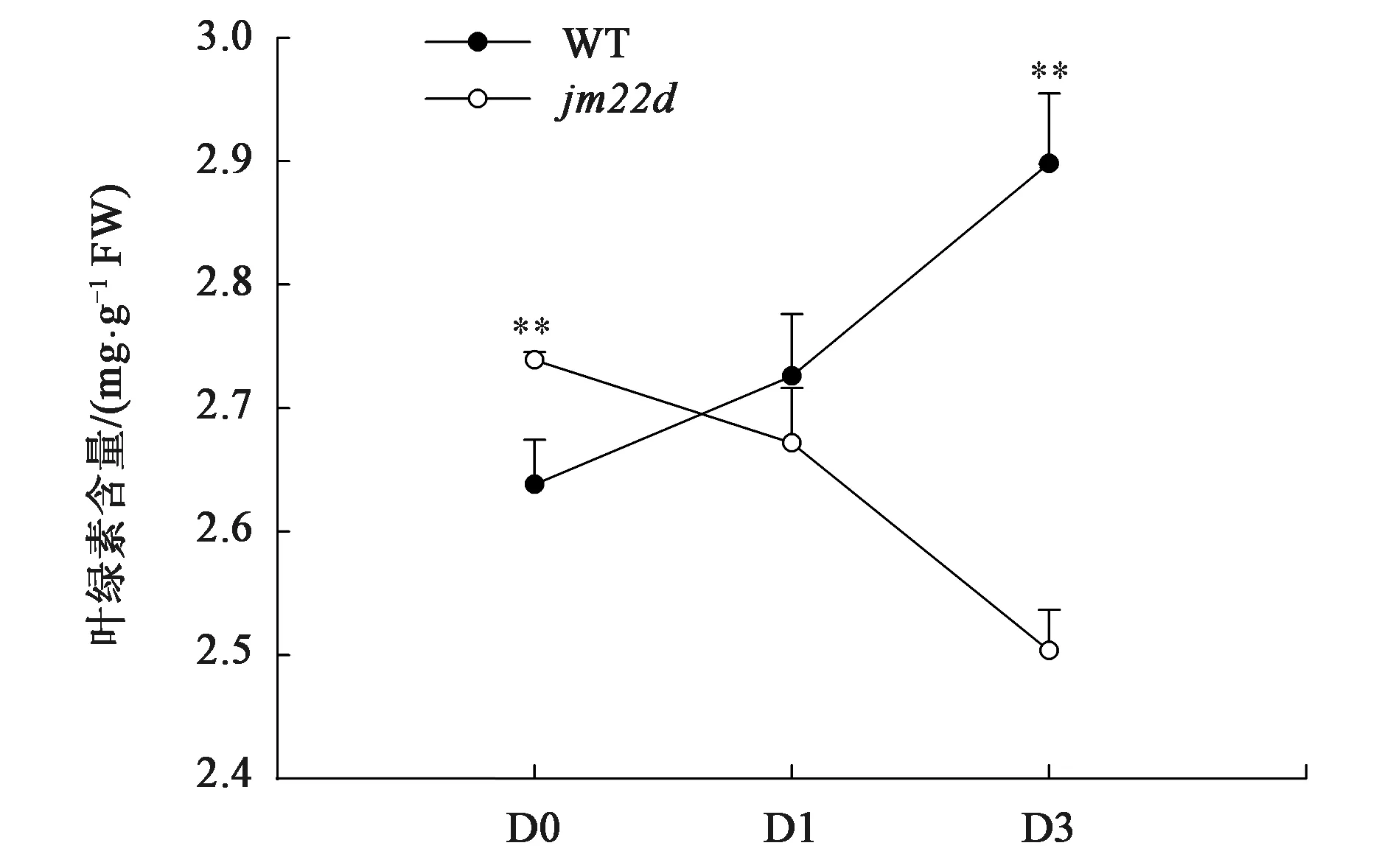
**—与同组WT相比,差异具有统计学意义(P<0.01)。图5 叶绿素含量测定Fig.5 Determination of chlorophyll content
2.6 转录组数据比对
共构建18个RNA-seq测序文库,每个样本包含3个生物学重复。测序原始经过质量控制后,各样品clean data均达到6.13 GB,Q20和Q30的百分比均高于94.33%,GC含量不低于57.55%。分别将各样品的Clean Reads与小麦参考基因组序列进行比对,比对效率分布在89.24%~94.78%不等,其中唯一比对到参考基因组的Reads数占84.8%以上,比对到参考基因组多处位置的Reads在6.55%以下(表2)。将皮尔逊相关系数r2(pearson’s correlation coefficient)作为生物学重复相关性的评估指标,分别计算各处理3个生物学重复之间的皮尔逊相关系数,两两样品之间的r2均在0.956以上(表3)。综上,表明转录组测序质量和样品重复性良好。

表2 转录测序数据统计Table 2 Statistics of RNA-seq
2.7 差异表达基因分析
对jm22d和WT中的差异表达基因进行筛选和分组对比分析。赤霉素处理0 d时(WT_D0vs.jm22d_D0),从两个材料中筛选出955个差异表达基因(270个上调表达,685个下调表达);赤霉素处理1 d时(WT_D1vs.jm22d_D1),筛选出772个差异表达基因(278个上调表达,494个下调表达);赤霉素处理3 d时(WT_D3vs.jm22d_D3),筛选出1 067个差异表达基因(318个上调表达,749个下调表达);jm22d和WT中共筛选到1 763个差异基因,在3个时间点均有显著差异的基因数目为411个,其中62个上调表达,349个下调表达(图6)。
2.8 差异表达基因GO功能注释和富集分析
对jm22d和WT间的差异表达基因进行GO功能注释和富集分析,1 763个差异基因中注释到了生物学过程(biological process)、细胞组分(cellular component)、分子功能(molecular function)的条目分别有19、15和13个。生物学过程中注释数目前三位的条目分别是代谢过程(metabolic process)、细胞进程(cellular process)和单一生物过程(single-organism process),注释基因的数目分别为777个(44.1%)、674个(38.2%)和598个(33.9%);细胞组分中注释数目前三位的条目分别是细胞成分(cell part)、细胞(cell)和细胞器(organelle),注释基因的数目分别为840(47.6%)、840(47.6%)和714个(40.5%);分子功能中注释基因数目前三位的条目分别是催化活性(catalytic activity)、结合(binding)和转运活性(transporter activity),注释基因的数目分别为708(40.2%)、674(38.2%)和89个(5%)(图7)。

表3 生物学重复间相关系数Table 3 The correlation coefficient of biological replicates

A:差异基因柱状图;B:差异基因韦恩图;C:上调差异基因;D:下调差异基因图6 差异表达基因统计Fig.6 Statistics of differentially expressed genes
将3个时间点上调表达和下调表达的差异基因进行GO富集分析。上调表达的差异基因富集最显著的4个GO条目分别是半乳糖脂酶活性(galactolipase activity)、硫酸盐运输(sulfate transport)、分子结构活性(structural molecule activity)和β-葡糖苷酶活性(beta-glucosidase activity)(图8A); 下调表达的差异基因富集最显著的4个GO条目分别是光合作用-光捕获(photosynthesis, light harvesting)、叶绿体膜(chloroplast membrane)、胁迫反应(response to stress)和谷氨酰tRNA还原酶活性(glutamyl-tRNA reductase activity)(图8B)。
2.9 差异表达基因KEGG富集分析
将3个时间点共有的差异基因进行KEGG富集分析,结果显示,在光合作用-天线蛋白(photosynthesis-antenna proteins,ko00196)、亚油酸的新陈代谢(linoleic acid metabolism,ko00591)以及卟啉与叶绿素代谢(porphyrin and chlorophyll metabolism,ko00860)通路中富集最显著(图9)。进一步分析发现,赤霉素处理0 d时,WT和jm22d中差异表达基因富集到93个通路中,其中在亚油酸的新陈代谢(linoleic acid metabolism,ko00591)通路上显著富集,内质网蛋白质加工(protein processing in endoplasmic reticulum,ko04141)途径上富集有大量的差异表达基因;赤霉素处理1 d时,差异表达基因富集到光合作用-天线蛋白、卟啉和叶绿素代谢等81个通路上,光合作用-天线蛋白(photosynthesis-antenna proteins,ko00196)表现为显著富集,且富集到的差异表达基因数目也较多;赤霉素处理3 d时,没有发现显著富集的通路,但在植物与病原菌互作(plant-pathogen interaction,ko04626)、淀粉和蔗糖代谢(starch and sucrose metabolism,ko00500)和碳代谢(carbon metabolism,ko01200)等通路上富集到大量差异表达基因。

图7 差异表达基因GO功能注释Fig.7 GO function classification and GO enrichment of DEGs
2.10 植物激素相关差异表达基因
从jm22d下调表达的基因中筛选到5个与植物激素信号转导相关的基因,分别是TraesCS2B01G582300、TraesCS2B01G600800、TraesCS2B01G556600、TraesCS2B01G630000和TraesCS6B01G439600。其中TraesCS2B01G582300是细胞分裂素信号途径中的负反馈调控因子(ARR-A),在WT中表达量高,且随着外源赤霉素处理时间的延长表达量增加,但该基因在jm22d中不表达。TraesCS2B01G600800是生长素信号转导途径中的GH3响应基因,在WT中表达量保持稳定,在jm22d中不表达。TraesCS2B01G5-56600是水杨酸信号途径中的TGA转录因子,在WT和jm22d中赤霉素处理1和3 d时表达量均上调,但3个时间点在WT中的表达量均显著高于jm22d,差异倍数分别为4.7、5.0和4.9倍。TraesCS2B01G630000是脱落酸信号转导途径中SRK2蛋白激酶编码基因,该基因在WT和jm22d中均随着赤霉素处理时间的延长表达上调,在jm22d中3个时间点的表达量均显著低于WT。TraesCS6B01G439600是乙烯信号转导途径中的ETR受体,该基因在WT中赤霉素处理1和3 d后表达量持续上调,但在jm22d中表达量无明显差异,3个时间点的差异倍数分别为12.3、16.5和35.2倍(表4)。
2.11 光合作用相关差异表达基因
KEGG富集分析显示,差异表达基因在光合作用相关通路上有显著的富集,主要包括光合作用-天线蛋白(photosynthesis-antenna proteins,ko00196)与卟啉和叶绿素代谢(porphyrin and chlorophyll metabolism,ko00860)两条通路。光合作用-天线蛋白通路上共富集到15个基因,均注释到叶绿素a-b结合蛋白LHCII 1,这15个基因在jm22d中随着赤霉素处理时间的延长持续下调,而在WT中表现为赤霉素处理1 d上调表达,处理3 d时下调表达,并且D0、D1和D3 3个时间
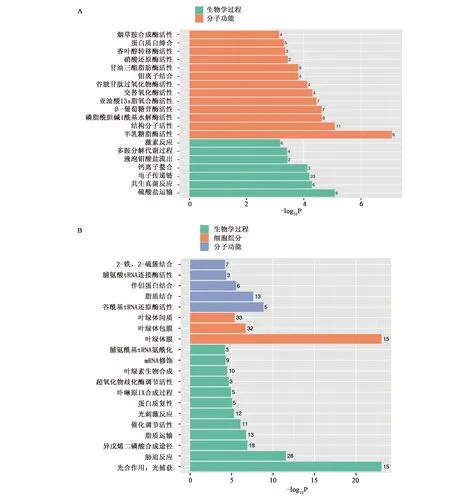
A:上调差异基因GO富集;B:下调差异基因GO富集图8 差异表达基因GO富集分析Fig.8 GO enrichment of DEGs
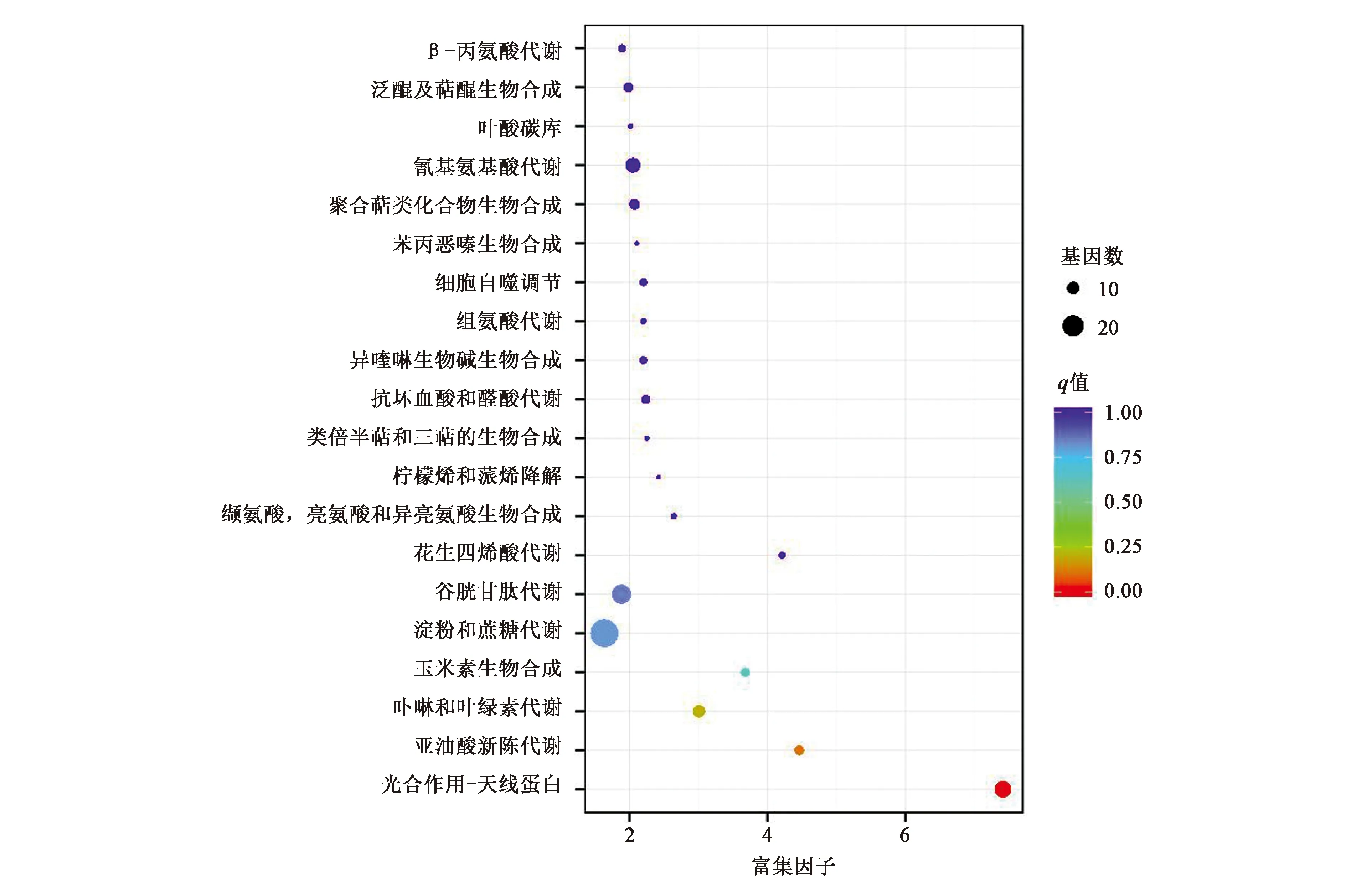
图9 差异表达基因KEGG富集分析Fig.9 KEGG enrichment of DEGs

表4 激素相关差异表达基因KEGG注释和FPKM值Table 4 The KEGG annotation and FPKM of DEGs related with plant hormone
点在jm22d中的表达量均显著低于在WT中的表达量。卟啉和叶绿素代谢通路上富集到6个基因,分别注释到谷氨酰tRNA还原酶和叶绿素b还原酶,这6个基因未施加赤霉素处理时在jm22d中的表达量高于WT中的表达量;随后经过赤霉素处理1和3 d时,在jm22d中的表达量低于在WT中的表达量(表5)。
2.12 荧光定量PCR验证
为验证转录组测序结果,随机选取9个差异表达基因进行了qRT-PCR定量分析,并与转录组数据进行比对,qRT-PCR的结果与转录组测序结果一致(图10)。
3 讨论
激素在植物的生长发育过程中扮演着重要的角色,它们与外界环境和发育过程一起构成了一个完整的调控网络[22]。如拟南芥中细胞分裂素响应元件B型ARR可以抑制生长素的积累[23];水稻中低浓度油菜素甾醇可以促进GA3ox2的表达,促进赤霉素的合成[24];生长素和赤霉素可以协同调控水稻XET基因的表达来调节茎秆的负向重力反应[25],生长素也可以正向调节DELLA蛋白的稳定性从而影响根部细胞的发育[26]。本研究中矮秆突变体jm22d叶片中赤霉素含量高于WT,而茎秆中的赤霉素含量显著低于WT,可能是jm22d中赤霉素转运途径出现异常导致其茎秆中赤霉素含量显著降低,引起植株出现矮化表型。结合转录组测序结果,赤霉素处理后,在生长素、乙烯、细胞分裂素等激素途径中筛选到5个差异基因,如生长素响应基因GH3家族(TraesCS2B01G600800)和细胞分裂素信号途径中的负反馈调控因子ARR-A(TraesCS2B01G582300),它们在jm22d中不表达,但在WT中高表达,且随着赤霉素处理,表达量出现上调或者下调的变化,由此推断生长素、细胞分裂素等植物激素相关基因的差异可能会影响jm22d细胞的伸长、细胞的分裂等多个发育过程,从而引起植株株高降低,同时也说明外源赤霉素对植物体内其他激素具有明显调节作用。综上,jm22d可能是一个赤霉素转运途径异常的突变体,其矮化可能与茎秆部分赤霉素含量的减少以及其他植物激素信号通路中不表达或者低表达的基因有关。

表5 光合作用相关通路上的差异表达基因Table 5 DEGs related with photosynthesis
光合作用是绿色植物将光能转化为化学能储藏在有机物中的过程,叶绿素作为光合作用中重要的色素,它对植物的生长发育意义重大。叶绿素的生物合成是L-谷氨酰-tRNA经过L-谷氨酰-tRNA还原酶等多种酶的作用形成叶绿素a,再经过叶绿素酸酯加氧酶氧化形成叶绿素b,整个合成过程共有15步反应,主要包括L-谷氨酰-tRNA到原卟啉Ⅸ的生物合成和原卟啉Ⅸ到叶绿素的生物合成两部分[27]。前期有研究证明外源赤霉素能够影响植物的光合作用,如在蚕豆叶片上喷施赤霉素可以显著提高叶片的光合作用速率[28];Dijkstra[29]的研究则表明外源赤霉素使得叶绿素a的含量以及单位叶面积的光合速率降低,但对蒸腾速率无显著影响。本实验中施加外源赤霉素后,jm22d中叶绿素含量明显降低,KEGG富集分析显示大量差异表达基因在光合作用相关通路有明显富集,如光合作用-天线蛋白、光合作用和卟啉-叶绿素代谢,说明外源赤霉素对jm22d中叶绿素含量的积累具有负向效应,并且外源赤霉素对光合作用相关代谢通路有较大影响,能够调控光合作用相关基因的表达,与毛竹中的研究结果一致[30]。

图10 qPCR验证结果Fig.10 The result of qPCR and RNA-seq
为了进一步验证转录组测序结果的准确性,本研究还选取了植物激素信号转导、光合作用等通路上的9个差异表达基因进行qRT-PCR验证,与转录组测序结果一致。矮秆突变体jm22d中的生长素响应因子AUX15、GH3表达量较低或者不表达可能是引起矮化的关键基因,施加外源赤霉素后这些基因的表达量出现明显的上调或者下调,说明植物体内的多种激素具有明显的相互作用,它们之间的协同作用共同调控植物的生长发育。光合作用和叶绿素代谢途径相关通路上富集有大量的差异表达基因,如HEMA1、PORA等基因出现了不同程度的下调,从而引起jm22d中叶绿素含量的降低,说明外源赤霉素对jm22d叶绿素的含量具有负向影响。本研究进一步丰富了小麦矮秆材料和基因资源的多样性,同时也为突变体中赤霉素的作用机制解析提供了重要的理论参考。

