普济煎液对豚鼠EB病毒的抑制及免疫干预作用
江伟炽,苏旭春,闫冰川,孔嘉欣,程 玲,宋 璟
(1.广州医科大学,广东 广州 511436;2.广州医科大学附属肿瘤医院中西医综合二科)
EB病毒感染可诱发鼻咽癌、伯基特淋巴瘤、霍奇金淋巴瘤、胃癌等多种肿瘤[1]。尤其在未分化型的鼻咽癌中,95%以上的患者感染EB病毒[2]。而且,EBV-DNA水平还与鼻咽癌治疗和预后密切相关[3]。因此治疗EB病毒感染,对鼻咽癌治疗具有重要意义。中药抗EB病毒感染具有独特优势,能有效抑制EBV-DNA复制,促进鼻咽癌康复[4]。本课题组曾采用普济煎液进行临床观察,证明普济煎液对鼻咽癌患者EB病毒有抑制作用[5]。为进一步探讨探究普济煎液抑制EB病毒增殖的作用机制,本研究建立豚鼠感染EBV模型,检测用药后豚鼠外周血单 个 核 细 胞(peripheral blood mononuclear cells,PBMSc)中EBV-DNA拷贝数以及血清免疫因子含量变化。
1 材料
1.1 实验细胞
狨猴EBV转化的白细胞B95-8,由广州医科大学附属肿瘤医院肿瘤研究所提供。
1.2 实验动物
普通级FMMU雄性豚鼠,60只,体重240~280 g,购自南方医科大学动物实验中心,生产许可编号:SCXK(粤)2016-0041。
1.3 主要试剂
RPMI1640培养基、双抗、胎牛血清购自GIBCO公司;细胞DNA提取试剂盒购自天根生化科技(北京)有限公司;病毒DNA基因组提取试剂盒购自北京索莱宝公司;豚鼠外周血单个核细胞分离液购自天津灏洋(TBD);EB病毒染料法荧光定量PCR试剂盒购自北京天恩泽有限公司;EB病毒早期抗原(EBV-VCA)抗体IgG ELISA试剂盒购自欣博盛生物科技有限公司;豚鼠IL-10、IL-8 ELISA试剂盒购自江莱生物有限公司;豚鼠IL-6、TNF-αELISA试剂盒购自上海酶联生物有限公司;豚鼠IFN-γELISA试剂盒购自酶免有限公司。
1.4 主要药物
阿昔洛韦购自麦克林有限公司,产品批号A829547 25 g。普济煎液组方:牛蒡子15 g,女贞子15 g,夏枯草15 g,黄芩10 g,连翘10 g,柴胡10 g,陈皮5 g,射干10 g,僵蚕10 g,板蓝根30 g,猫爪草30 g,太子参10 g,玄参20 g,生地黄15 g,甘草5 g。实验用中药由广州医科大学附属肿瘤医院中药房提供,经自动煎药机煎煮。
1.5 主要实验仪器
Svnergyr2多功能酶标仪,美国BioTek公司;CFX96 Real-Time Systerm,美国BIO-RAD公司。
2 方法
2.1 细胞培养
B95-8细胞用含10%胎牛血清、1%双抗的RPMI1640培养基于37℃,4%CO2培养箱培养1周。当细胞计数达约5×106个/mL时,静置于33℃,4%CO2培养箱培养2周,于-80℃及37℃反复冻融3次,8 000×g离心30 min,取上清用0.45 μm滤器过滤,收集溶液于-80℃保存备用[6]。
2.2 EB病毒液病毒载量测定
取收集的EB病毒液,根据病毒DNA提取试剂盒说明书操作提取病毒DNA。使用EB病毒染料法荧光定量PCR试剂盒测定EB病毒载量,检测样品设置3个复孔取平均值,根据qPCR所得Ct值计算病毒载量。
2.3 动物模型建立及给药方法
将普通级豚鼠60只分成2组,分别为正常对照组10只,病毒组50只。所有豚鼠置于实验环境温度为20℃~22℃,12 h昼夜交替光照[7],在动物房适应1周后,正常对照组经滴鼻、口腔接种100μL无血清RPMI1640培养基,病毒组接种100μL病毒液,计量为2.0×106病毒载量/只。接种1周后,局部麻醉,经股动脉取血5mL,分离外周血单个核细胞,检测EBV-DNA复制载量。正常对照组在取血过程中死亡1只,共有36只豚鼠造模成功。把动物分为模型组、阿昔洛韦组、低、高剂量普济煎液组各9只。阿昔洛韦组予阿昔洛韦组灌胃,普济煎液组予普济煎液灌胃,模型组和正常对照组分别予等比例生理盐水灌胃,给药1次/天,持续2周。阿昔洛韦组用药量为0.04 g/kg,低剂量普济煎液组为17.5 g/kg,高剂量组35 g/kg。末次给药后禁食12 h,使用10%水合氯醛腹腔注射过量麻醉后,剖胸心脏取血,一份使用柠檬酸钠抗凝管取血5 mL检测外周血单个核细胞中EB病毒复制载量,另一份使用离心管取血10 mL检测血清中免疫因子含量。
2.4 外周血单个核细胞EB病毒载量测定
取使用柠檬酸钠抗凝采血管采血样与等量分离液混合后,按照豚鼠外周血单个核细胞分离液说明书加入分离液中,500 g,离心30 min。离心后溶液分为四层,第一层为血浆层,第二层为环状乳白色淋巴细胞层,第三层为分离液层,第四层为红细胞层。用干净的15 mL离心管收集第二层细胞,加入10 mL清洗液,250 g,离心10 min。收集沉淀,用无血清RPMI1640培养基重悬细胞,按照细胞DNA提取试剂盒说明书提取DNA,并测定DNA浓度。根据北京天恩泽公司EB病毒染料法荧光定量PCR试剂盒说明书操作,测定外周血单个核细胞中EBV病毒载量。每个样本取3个复孔,反应条件为:预变性,95℃,2 min;PCR反应,温度91℃,15 s,58℃,60s,共45个循环。以6个阳性对照浓度的log值为横轴,以Ct值为纵轴,绘制标准曲线,再以待测阳品Ct值从标曲上找出其浓度的log值,计算出待测样品的DNA浓度。
2.5 ELISA指标检测
取无抗凝血样,室温放置2 h后,250 g离心5 min,小心收集上清于干净离心管中,根据豚鼠IL-10、IL-6、IL8、TNF-α、IFN-γ试剂盒以及EBV-VCA IgG试剂盒说明书进行检测,于450nm吸光度测定OD值,计算浓度值。
2.6 统计学处理
采用SPSS16.0进行分析,所有数据相互独立,以x±s表示,采用单因素方差分析法进行多样本比较,组间比较采用LSD检验,结果以P<0.05为差异有统计学意义。
3 结果
3.1 绘制EB病毒液拷贝数的标准曲线
根据qPCR扩增结果,绘制标准曲线(见图1),检测EBV-DNA拷贝数标曲方程为y=-2.6909x+27.722,R2=0.999。根据病毒液qPCR的Ct值为9.554,计算出病毒DNA载量约为2.01×107copies/mL病毒载量。
3.2 豚鼠接种EB病毒1周后外周血单个核细胞中EB病毒拷贝数
把正常对照组编号为1~10,病毒组分为5组,分别编号A1-10、B1-10、C1-10、D1-10、E1-10,共有36只豚鼠检测到EBV-DNA复制,正常对照组在取血过程中死亡1只(见表1)。
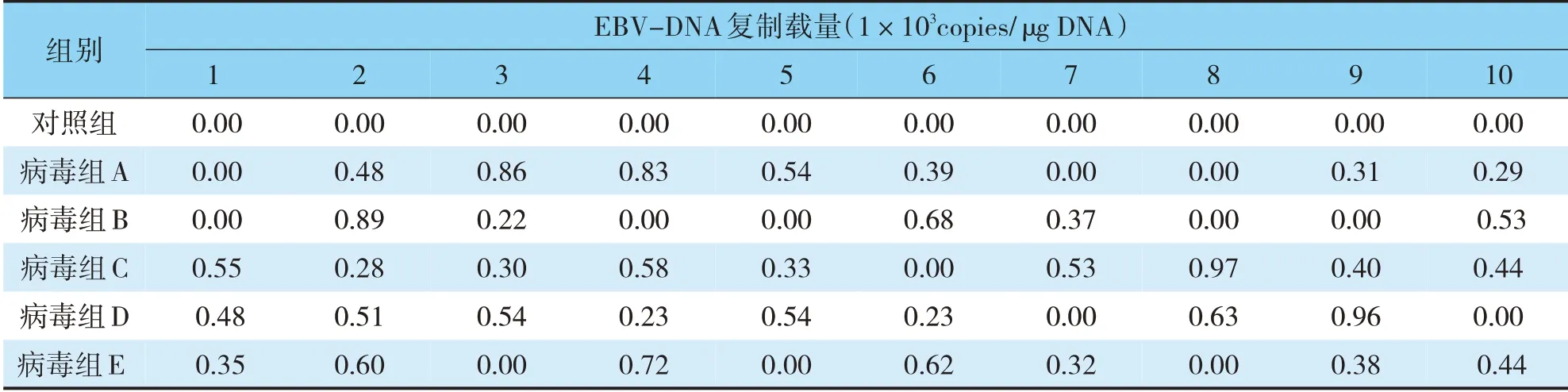
表1 各组豚鼠接种EB病毒1周后外周血单个核细胞中EBV-DNA拷贝数
3.3 各组豚鼠体重变化比较
实验过程中,模型组豚鼠死亡2只。灌胃前1天、第7天,正常对照组,模型组、阿昔洛韦组、低、高剂量普济煎液组体重变化比较无统计学差异(P>0.05)。灌胃第14天,与模型组比较,正常对照组、阿昔洛韦组、低、高剂量普济煎液组豚鼠体重显著升高(P<0.05),高剂量普济煎液组体重较阿昔洛韦组升高(P<0.05)(见表2)。
表2 各组豚鼠灌胃前1天、灌胃第7天、灌胃第14天体重比较(g,)
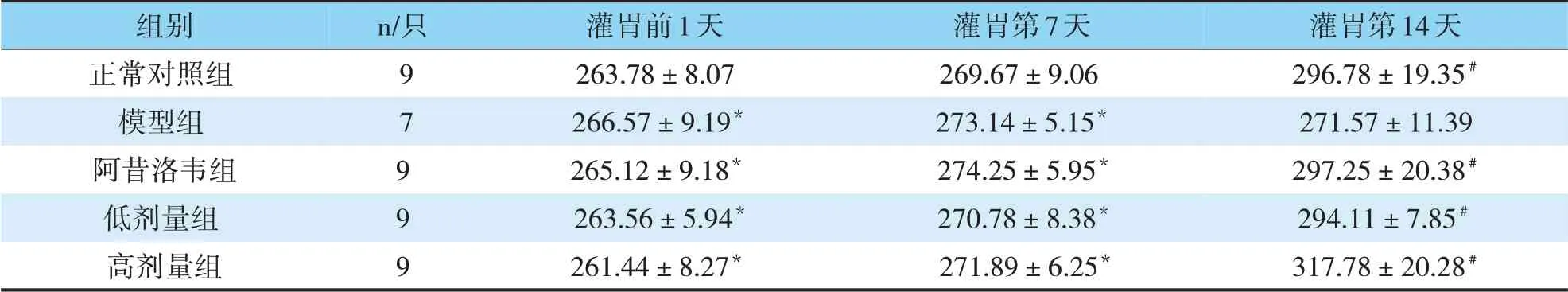
表2 各组豚鼠灌胃前1天、灌胃第7天、灌胃第14天体重比较(g,)
注:与正常对照组比较,*P>0.05;与模型组相比,#P<0.05
组别正常对照组模型组阿昔洛韦组低剂量组高剂量组n/只灌胃第14天296.78±19.35#271.57±11.39 297.25±20.38#294.11±7.85#317.78±20.28#9 7 9 9 9灌胃前1天263.78±8.07 266.57±9.19*265.12±9.18*263.56±5.94*261.44±8.27*灌胃第7天269.67±9.06 273.14±5.15*274.25±5.95*270.78±8.38*271.89±6.25*
3.4 重新绘制EB病毒拷贝数的标准曲线
检测EB病毒DNA拷贝数标曲方程为y=-2.821x+27.544,R2=0.9978。利用新的标准曲线方程,根据样本的Ct值,计算灌胃2周后豚鼠外周血单个核细胞中EBV-DNA拷贝数变化(见图2)。
3.5 灌胃2周后各组豚鼠外周血单个核细胞中EBV-DNA拷贝数比较
与模型组比较,阿昔洛韦组、低、高剂量普济煎液组中EBV-DNA拷贝数降低(P<0.05);与阿昔洛韦组比较,高剂量普济煎液组中EBV-DNA拷贝数降低(P<0.05)(见表3)。
表3 各组豚鼠EBV-DNA复制载量比较(1×104copies/μgDNA,)
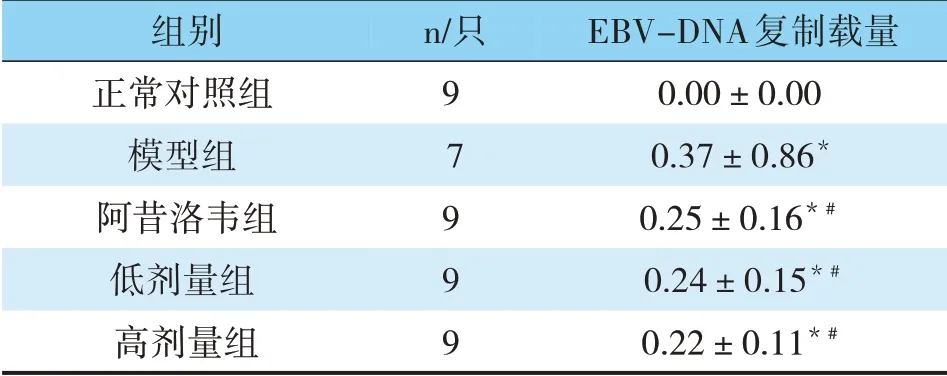
表3 各组豚鼠EBV-DNA复制载量比较(1×104copies/μgDNA,)
注:与正常组比较,*P<0.05,#与模型组比较,#P<0.05
EBV-DNA复制载量0.00±0.00 0.37±0.86*0.25±0.16*#0.24±0.15*#0.22±0.11*#组别正常对照组模型组阿昔洛韦组低剂量组高剂量组n/只9 7 9 9 9
3.6 灌胃2周后各组豚鼠血清中EBV-VCA IgG、IL-10、IFN-γ含量比较
与正常对照组比较,模型组、阿昔洛韦组、低、高剂量普济煎液组中EBV-VCA IgG显著升高(P<0.05);与模型组比较,阿昔洛韦组、低、高剂量组普济煎液组中IL-10含量降低(P<0.05),阿昔洛韦组、低、高剂量普济煎液组中IFN-γ含量显著升高(P<0.05);与阿昔洛韦组比较,低、高剂量普济煎液组中IFN-γ含量升高(P<0.05)(见表4)。
表4 各组豚鼠血清中EBV-VCA IgG、IL-10、IFN-γ含量比较(pg/mL,)
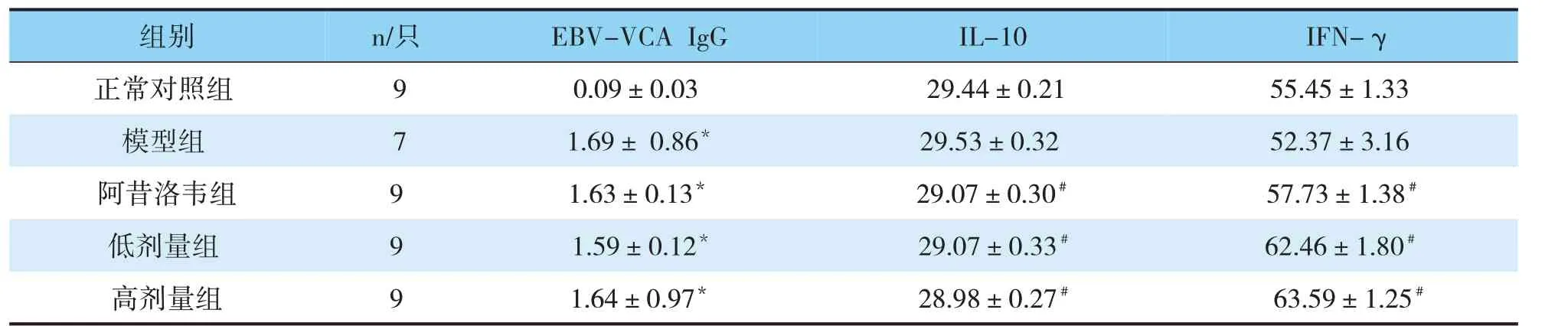
表4 各组豚鼠血清中EBV-VCA IgG、IL-10、IFN-γ含量比较(pg/mL,)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
组别正常对照组模型组阿昔洛韦组低剂量组高剂量组n/只IL-10 29.44±0.21 29.53±0.32 29.07±0.30#29.07±0.33#28.98±0.27#9 7 9 9 9 EBV-VCA IgG 0.09±0.03 1.69±0.86*1.63±0.13*1.59±0.12*1.64±0.97*IFN-γ 55.45±1.33 52.37±3.16 57.73±1.38#62.46±1.80#63.59±1.25#
3.7 灌胃2周后各组豚鼠血清中IL-6、IL-8、TNFα含量比较
与模型组比较,阿昔洛韦组、低、高剂量普济煎液组中IL-6、TNF-α含量显著升高(P<0.05);阿昔洛韦组血清中IL-6含量与低、高剂量普济煎液组比较无统计学差异(P>0.05);正常对照组、阿昔洛韦组、低、高剂量普济煎液组血清中IL-8含量比较无统计学差异(P>0.05);高剂量普济煎液组中TNF-α含量较阿昔洛韦组显著升高(P<0.05)(见表5)。
表5 各组豚鼠血清中IL-6、IL-8、TNF-α含量比较(pg/mL,)
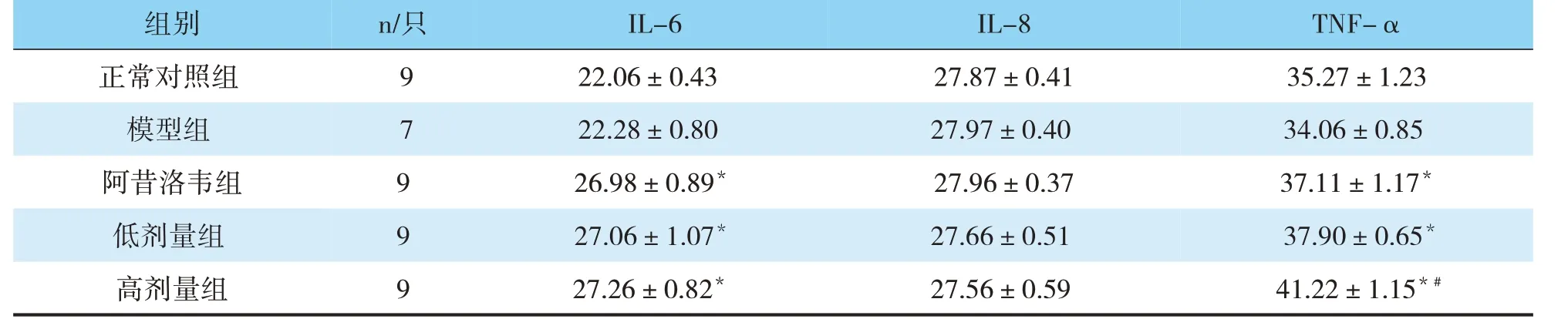
表5 各组豚鼠血清中IL-6、IL-8、TNF-α含量比较(pg/mL,)
注:与模型组比较,*P<0.05;与阿昔洛韦组比较,#P<0.05
组别正常对照组模型组阿昔洛韦组低剂量组高剂量组n/只9 7 9 9 9 IL-6 22.06±0.43 22.28±0.80 26.98±0.89*27.06±1.07*27.26±0.82*IL-8 27.87±0.41 27.97±0.40 27.96±0.37 27.66±0.51 27.56±0.59 TNF-α 35.27±1.23 34.06±0.85 37.11±1.17*37.90±0.65*41.22±1.15*#
4 讨论
EB病毒在人群中具有普遍易感性,据统计,全球范围内共有90%以上的人感染EB病毒[8]。EB病毒感染多发生在幼儿时期,感染后多表现为隐性感染或者潜伏状态,一般无明显或伴随较弱的临床症状[9]。EB病毒作为一种致癌病毒,与鼻咽癌、伯基特淋巴瘤、霍奇金淋巴瘤、胃癌等多种恶性肿瘤发生有关,其中与鼻咽癌的发生、发展关系密切[10]。研究表明,在鼻咽癌患者治疗中,治疗后血清中EBVDNA水平持续增高,可增加鼻咽癌复发及转移风险[11]。因此,治疗EB病毒感染与鼻咽癌预后密切相关。
EB病毒主要感染B淋巴细胞及上皮细胞,诱导宿主产生固有免疫及特异性免疫应答,其中Toll样受体(toll-like receptors,TLRs)介导的信号通路是固有免疫的重要信号通路[12]。TLRs表达于各种免疫细胞,通过诱导分泌肿瘤坏死因子α(tumor necrosis factorα,TNF-α)、IL-6、IL-8细胞因子,同时上调NK细胞数量抵御病毒入侵[13]。BZLF1是EB病毒表达得即刻早期蛋白,在病毒感染早期,BALF1可下调TNF-α的表达,抑制机体抗病毒免疫反应,利于病毒DNA复制[14]。IL-6和IL-8都是一种多效能的细胞因子,可以刺激造血干细胞、免疫细胞等的增殖,调节机体抗炎反应,EB病毒编码的潜伏膜蛋白1(latent membrane protein 1,LMP1)能上调IL-6、IL-8和IL-10等细胞因子的表达,干扰宿主机体细胞因子分泌,从而调控免疫应答反应[15]。EBNA1是EB病毒核抗原的一种,可通过诱导IL-10产生抑制TLR信号通路激活,抑制抗原呈递细胞活性,产生免疫逃逸。细胞免疫在在抗EB病毒感染过程中亦占有重要作用,EB病毒感染机体后,EB病毒抗原特异性细胞毒性T淋巴细胞(cytotoxic lymphocyte,CTL)大量增值,激活CD8+T细胞、CD4+T细胞介导的细胞免疫,同时CTL可分泌大量的IFN-γ进一步发挥抗病毒作用。EB病毒可通过干扰抗原呈递、干扰细胞因子作用,逃避宿主免疫,通过调节免疫抑制性因子IL-10,抑制IFN-γ细胞因子分泌,同时下调NK细胞和特异性CTL活力,调控TNF-α、IL-6、IL-8等细胞因子的分泌影响宿主免疫应答。
中医学认为EB病毒属于温病邪气,外感温邪,传变迅速,可侵及他脏。据临床研究显示,采用益气养阴结合清热解毒法,辩证用药,可提高中药治疗EB病毒感染的疗效。放疗是鼻咽癌的主要治疗手段,中医学认为放射线属于“火热”毒邪,耗伤气阴,故在使用中药治疗鼻咽癌合并EB病毒感染的患者时,不仅考虑采用清热解毒药物,也需配伍养阴清热中药,提高中药抗病毒疗效。普济煎液采用普济消毒饮为基础化裁,配伍太子参、女贞子、玄参、生地黄益气养阴药物,扶正祛邪并重。方中黄芩、板蓝根、牛蒡子、射干共为君药,清热解毒,利咽喉;僵蚕、猫爪草、夏枯草共为臣药,有解毒散结、化痰软坚之功效;陈皮、太子参、女贞子、玄参、生地黄为佐药,其中陈皮理气化痰,太子参、女贞子、玄参、生地黄益气养阴;甘草为使药,调和诸药。全方配伍攻补结合,共奏解毒化痰、益气养阴之功。
本实验通过滴鼻、口腔接种EB病毒成功建立豚鼠感染EB病毒模型[23],接种1周后通过股静脉取血,分离外周血单个核细胞,并检测到36只豚鼠细胞中有EB病毒复制,说明造模成功。予阿昔洛韦、普济煎液灌胃2周后,与正常对照组比较,模型组、阿昔洛韦组、低、高剂量普济煎液组中EBV-VCA IgG含量、外周血单个核细胞中EBV-DNA拷贝数升高。与模型组比较,阿昔洛韦组、低、高剂量普济煎液组EBV-DNA拷贝数降低;高剂量普济煎液组EBV-DNA拷贝数较阿昔洛韦组降低,提示阿昔洛韦、普济煎液能有效抑制EBV-DNA复制。实验发现各组豚鼠血清中IL-8含量比较无明显差异,考虑普济煎液可能不通过调节IL-8的分泌抑制EB病毒增殖。与模型组比较,阿昔洛韦组、低、高剂量普济煎液组血清中IL-6、TNF-α、IFN-γ含量升高,IL-10含量降低;高剂量普济煎液组中TNF-α、IFN-γ含量较阿昔洛韦组升高,提示普济煎液抑制EBV-DNA复制的机制可能是通过增加IL-6、TNF-α、IFN-γ的表达,降低血清中IL-10的表达,增强豚鼠免疫应答效应,抑制EB病毒增殖。

