虫瘿组织中肚倍蚜唾液蛋白的提取和鉴定
杨 瑛,魏洪媛,邵淑霞,陈晓鸣,杨子祥*
(1. 中国林业科学研究院资源昆虫研究所,国家林业局资源昆虫培育与利用重点实验室,云南 昆明 650233;2. 南京林业大学研究生院,江苏 南京 210037)
唾液是刺吸式昆虫与寄主植物相互作用的重要媒介,其主要成分为唾液蛋白,并含有大量可溶性酶类[1]。唾液在昆虫唾液腺中合成和贮存,通过取食被注入并作用于植物组织,具有克服寄主植物抗性、帮助口针穿刺、消化食物、解毒次生代谢物质和克服寄主植物抗性等功能[2-3]。蚜虫通过针状口器吸食植物汁液,阻碍植物生长,导致植物的叶、花、芽出现畸形,还可能传播病毒或者引起其他危害,是农、林植物上的重要害虫。五倍子蚜通过取食将唾液注入植物组织,其中的酶类或特定功能蛋白能诱导植物产生一系列生化反应,引起植物组织的不正常增生,从而形成具有特定结构和功能的虫瘿[4-5]。
昆虫的唾液是植物虫瘿形成和生长的关键物质,是虫瘿形成的 “启动子”[6]。与自由生长的蚜虫相比,瘿蚜通常具有专化性强、个体数量大、局限于特定部位取食和极少造成寄主植物枯萎或死亡的特点,代表了一种独特的昆虫与植物相互关系的作用类型[7]。瘿蚜与寄主植物不仅仅是简单的取食与防御的关系,而是操控与适应的关系,从某种意义上说,瘿蚜与寄主植物已经形成了一种特殊的共生关系[8],因此,对瘿蚜唾液成分的研究,不仅有助于揭示虫瘿形成机理,还可为刺吸式昆虫与寄主植物的协同进化研究提供依据。
由于蚜虫个体小,特定阶段的生活期短,唾液蛋白收集困难和易于降解等原因,给蚜虫唾液的提取、分离和鉴定带来了很大困难。到目前为止,仅对豌豆蚜(Acyrthosiphon pisum)、麦长管蚜(Sitobion avenae) 、 桃 蚜 (Myzus persicae) 和 角 倍 蚜(Schlechtendalia chinensis)等少数种类的唾液进行过研究[9-14]。这些研究均以蚜虫为研究对象,采用双层膜夹营养液模拟蚜虫取食过程收集唾液[15],或进一步解剖蚜虫唾液腺提取蛋白并鉴定[16],因此鉴定的蛋白为模拟取食注入营养液或唾液腺贮存的蛋白,而不是蚜虫正常取食过程中注入植物组织的蛋白。本研究以五倍子蚜的重要种类肚倍蚜指名亚种(Kaburagia rhusicola rhusicola)( Aphididae:Eriosomatinae: Fordini)在青麸杨(Rhus potaninii)上形成的虫瘿为材料,根据虫瘿组织的结构特点,建立了从虫瘿组织中提取、浓缩、液质联用分析和鉴定唾液蛋白的方法,应用该方法成功提取和鉴定了肚倍蚜注入虫瘿组织中的唾液蛋白。
1 材料与方法
1.1 供试虫源
供试肚倍蚜虫瘿采自云南省昆明市金殿国家森林公园(102°48′ E,25°5′ N,H:1 980 m),为野生自然分布的肚倍蚜。于5 月初在林间采集新鲜肚倍蚜初期虫瘿,立即置于液氮罐中,带回实验室,转到-80 ℃立式超低温冰箱(Forma)保存,并进行后续处理。
1.2 肚倍蚜虫瘿处理及蛋白提取
选取直径为3~6 mm 的初期肚倍蚜虫瘿,对其进行解剖,移除虫瘿内部的干母和干雌,并去除蜡粉和杂质等,用无菌水冲洗干净。将虫瘿外壁切成小块,沿外壁的中心线切除外表层,取虫瘿壁的内层,将内层切成约0.5 mm×0.5 mm 的小方块,浸入TE-SDS 缓冲液中(10 mmol·L-1Tris,1 mmol·L-1EDTA,pH 8.0,0.1%SDS),4 ℃ 静置1 h 以上。移除上清液,收集下层蛋白质沉淀,置于液氮中保存备用。重复上述过程,解剖30~50 个虫瘿,直到收集到足够数量的蛋白质沉淀液,用于后续电泳分离。
1.3 蛋白浓缩
1.3.1 真空冷冻干燥法 将收集的蛋白沉淀液合并于50 mL 离心管中,在-80 ℃冰箱中预冷成固态,转移至超低温真空冷冻干燥仪内(ZL-12 TDT 架型),设置参数为:0.024 mbar,-54 ℃,至完全干燥成粉末状,加入200 μL TE-SDS 缓冲液溶解,用于后续电泳检测。
1.3.2 超滤膜浓缩法 将收集的蛋白沉淀液(500 μL)转移到截留分子量(MWCO)10 K 的超滤管中,1 300×g,4 ℃,离心25 min。转移沉淀液至截留分子量(MWCO)3 K 的超滤管中,1 000×g,4 ℃,离心30 min。再转移沉淀液至1.5 mL 的离心管中,加50 μL 蛋白酶抑制剂(PMSF),超声破碎,旋涡混匀。真空离心浓缩,30 ℃热干30 min。最终沉淀液体积约为100 μL。
1.4 蛋白检测
1.4.1 Bradford 法定量检测 采用酶标板法检测蛋白浓度,选择Protein 程序下的Bradford 法。使用96 孔酶标板(Corning,货号3 524),取5.0 mg·mL-1的BSA 蛋白(牛血清蛋白)为标准蛋白,用蛋白定量染料分别稀释10、20、40、60、80、100、150 倍,每个标准品设置1 个重复,各孔分别加入20 μL 相应浓度的标准蛋白质溶液(200 μg·mL-1)。各酶标孔加入200 μL Bradford 工作液,迅速混匀。室温25~30 ℃,反应5 min 后,以0 号管为空白对照,在酶标仪上测各孔在A595 处的OD 值。以标准组各孔在A595 nm 处测定的OD 平均值为纵坐标,对应的蛋白质浓度为横坐标,在SPSS Statistics 17.0 软件中绘制标准曲线。所得标准曲线为 :y=0.007 7x+0.379 1,R2=0.997 0。 取20 μL 上述1.3 样品浓缩液用蛋白定量染料按照10、20、40、60、80、100、150 倍的浓度梯度进行稀释,测定A595 nm 处的OD 值,对照已经得到的标准曲线,计算得出样品的蛋白浓度。
1.4.2 聚丙烯酰胺凝胶电泳(SDS-PAGE) 采用BIO-RAD 的垂直电泳仪, 配制浓度为12% 的SDS-聚丙烯酰氨凝胶电泳分离胶,再配制5% 的SDS-聚丙烯酰氨凝胶电泳浓缩胶。以等体积去离子水为阴性对照,5 μL 预染蛋白Marker 作为阳性对照,90 V 恒压电泳至溴酚蓝的前沿超过浓缩胶,再用120 V 恒压电泳约1.5 h,至溴酚蓝的前沿接近凝胶末端时,停止电泳。
1.5 考马斯亮蓝染色、脱色
染色:将胶块放置在转速约为65 r·min-1的摇床上染色1 h 左右,取出胶块,去离子水清洗。
脱色:将染色过的胶块放于转速为65 r·min-1摇床上脱色1 h 以上,至胶底色干净,条带清晰可见即可。
1.6 凝胶摄像
将脱色的胶块静置于凝胶扫描板上,采用MagicScan 5. 1 进行摄像和分析。
1.7 质谱分析
1.7.1 溶液酶解(in-solution digestion) 浓缩之后的肚倍蚜唾液蛋白用50 μL 0.1 mol·L-1碳酸氢铵溶 液 调 节pH 值 至7~8 之 间 , 加 入1 mol·L-1的DTT(二硫苏糖醇)至浓度为10 mmol·L-1,55 ℃恒温金属浴加热1 h。再添加1 mol·L-1的碱乙酸铵至浓度为50 mmol·L-1,在室温下,置于暗箱中静置暗反应1 h。接着加入0.3 μg 的胰蛋白酶溶液trypsin(TB180 索莱宝),置于37 ℃恒温箱,培养15~16 h,用于质谱检测。
1.7.2 液相色谱质谱联用检测(LC-MS/MS) 取上述酶解产物,进行液相色谱质谱联用仪分析。设置步骤如下:分离柱:Dr.Maisch 色谱柱(75 μm ×150 mm),流动相:乙腈和水(70:30) 为流动相进行梯度洗脱,时间:45 min,流速:200 nL·min-1,柱温:室温。质谱分析在北京蛋白质组研究中心(BPRC)进行。
1.8 蛋白鉴定
采用Mascot 搜索软件,对上述蛋白(LC-MS/MS)的分析结果进行蛋白多序列检索比对。搜索的数据库为:豌豆蚜蛋白数据库ACYPIproteinsV2.1b(http://www.aphidbase.com/aphidbase/downloads) 和拟南芥蛋白数据库( https://www.arabidopsis.org/download)。搜索参数设置:Peptide Mass Tolerance:± 0.1 Da, Fragment Mass Tolerance: ± 0.2 Da, Max Missed Cleavages: 2。
2 结果与分析
2.1 蛋白检测结果
2.1.1 Bradford 法定量检测 经Bradford 法酶标仪检测,真空冷冻干燥法浓缩样品的蛋白浓度为39 μg·mL-1;超滤膜浓缩法浓缩液中没有检测出蛋白。表明真空冷冻干燥法浓缩液中含有蛋白,且浓度已达到了质谱分析的要求,可用于虫瘿组织中肚倍蚜唾液蛋白的浓缩。
2.1.2 聚丙酰胺凝胶电泳检测(SDS-PAGE) 经垂直板电泳检测,超滤膜浓缩样品的胶块,考马斯亮蓝染色时没有明显条带;真空冷冻干燥法浓缩液样品,考马斯亮蓝染色有微弱的蛋白条带,表明所收集肚倍唾液蛋白提取液的蛋白浓度较低。
2.1.3 液相色谱质谱联用分析(LC-MS/MS) 经LC-MS/MS 分析,真空冷冻干燥法浓缩样品的质谱图上有蛋白质峰(图1),表明提取的蛋白已经达到了质谱分析的要求,可以进行蛋白种类鉴定与分析;超滤膜浓缩法得到的产物没有蛋白质峰。
2.2 蛋白鉴定
考马斯亮蓝染色胶块没有出现明显的条带,因此选择做溶液酶解,将质谱分析结果与豌豆蚜蛋白数据库和拟南芥蛋白数据库分别进行比对检索,分别鉴定出5 种和7 种,共计12 种蛋白,分子量介于30.9~157.6 kDa,匹配的肽段数为1~4 条,编码氨基酸长度为277~1 421(表1)。经过文献检索与蛋白功能分析,在豌豆蚜蛋白库检索的5 种蛋白质中,其中编号ACYPI 006711 的为延伸因子蛋白,具有GTP 蛋白结合功能,该蛋白在角倍蚜(S. chinensis)的唾液和唾液腺中也被鉴定到;另有编号ACYPI 006969 的为Actin 蛋白,为细胞骨架结构功能蛋白,在角倍蚜唾液腺中也被鉴定到[14],其它的2 种分别为组蛋白、黏合连接蛋白,具有核小体DNA 结合和磷脂酸结合功能;另1 种为松脂蛋白或记忆蛋白,具有mRNA 分离或剪切功能。由于ACYPI 006711 和ACYPI 006969 蛋白在与肚倍蚜亲缘关系相近的角倍蚜唾液或唾液腺中存在(图2),并具有与虫瘿诱导相关的功能,因此可以判断从肚倍蚜虫瘿组织中鉴定的蛋白有很大的可能来自于肚倍蚜唾液,并与虫瘿的诱导和形成有关。而ACYPI007671、ACYPI003311 和ACYPI002474为唾液的特异蛋白,在唾液蛋白中占有较高的比例,推测它们也可能与虫瘿的形成有关,ACYPI007671和ACYPI003311 为特异结合蛋白,是完成生命活动的基本蛋白。对上述特异蛋白的功能研究,将是今后虫瘿形成机理研究的重点。从拟南芥蛋白数据库中鉴定出的7 种蛋白, 分别为跨膜蛋白、ATP 合成蛋白、热激蛋白、伴侣蛋白和磷酸羧化酶蛋白等,其功能包括磷脂酸结合、ATP 结合与合成、蛋白转运、蛋白乙酰化、卡尔文循环和CO2固定等,这些蛋白可能是在虫瘿组织切割过程中,从组织细胞间溶解的蛋白,其功能可能与寄主植物组织的基本组成或植物组织增生和生长等相关。

图1 从虫瘿组织提取的肚倍蚜唾液蛋白的LC-MS/MS 图Fig. 1 MS spectrogram of saliva proteins from gall tissue of K. rhusicola rhusicola
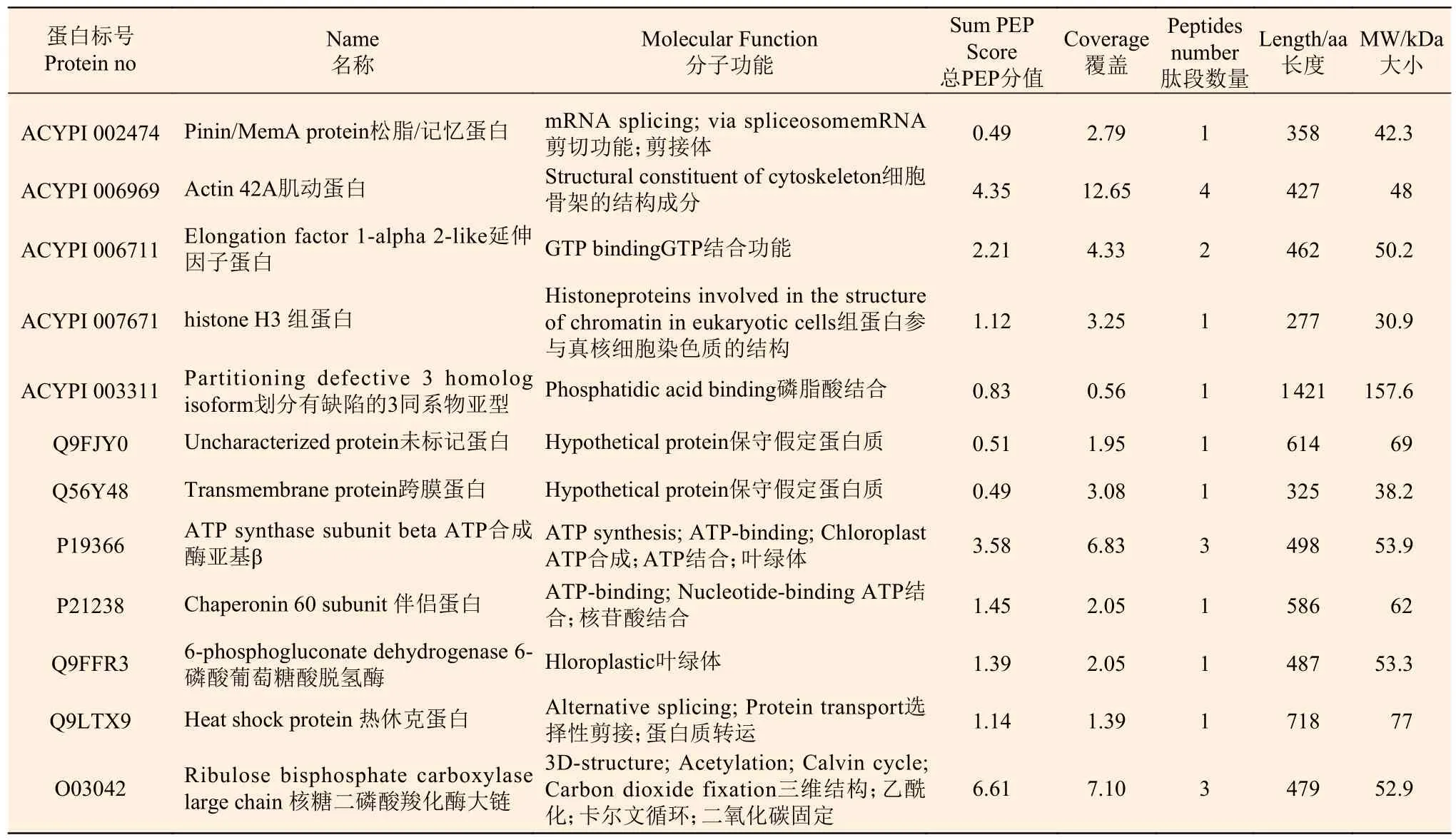
表1 从虫瘿组织中鉴定的所有蛋白种类及特征 Table 1 All protein types and characteristics of K. rhusicola rhusicola identified from gall tissue
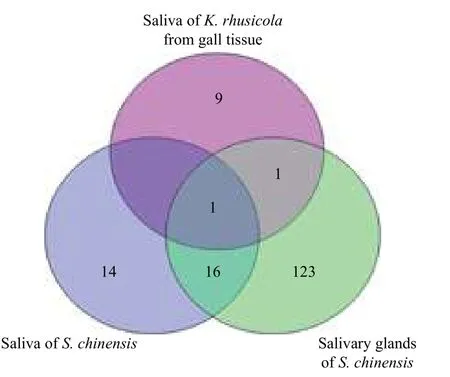
图2 肚倍蚜唾液蛋白与角倍蚜唾液和唾液腺蛋白的比较韦恩图Fig. 2 Venn diagram of saliva and salivary gland proteins identified from K.rhusicola rhusicola and S. chinensis
3 讨论
昆虫唾液的收集是唾液研究中最重要的环节,是唾液蛋白鉴定的基础。已有的对五倍子蚜唾液蛋白的研究包括采用双层膜夹营养液模拟蚜虫取食过程收集干母的唾液[15],或采取解剖干母唾液腺提取和鉴定蛋白[16],鉴定出的蛋白为唾液腺中贮存的蛋白或模拟取食注入营养液中的蛋白,并不是五倍子蚜自然取食注入虫瘿组织的唾液蛋白,唾液腺是唾液的合成和储存场所,五倍子蚜通过口针在虫瘿内壁取食时,会随着食物的不同注入不同种类的蛋白,目前还没有从虫瘿组织中鉴定倍蚜唾液蛋白的相关报道。本研究以肚倍蚜初期虫瘿为材料,根据肚倍蚜虫瘿结构和取食特性等,对植物组织中提取昆虫唾液蛋白的方法进行改进[17],成功从虫瘿组织中提取和鉴定了肚倍蚜部分唾液蛋白。
肚倍蚜干母在青麸杨叶片上取食,刺激叶片不正常增生形成囊状虫瘿,将干母包裹在封闭的虫瘿内,干母在虫瘿内壁继续取食,刺激虫瘿进一步增生膨大。干母和干雌(干母后代)口针很短,仅为0.3 mm 左右,一般只能在虫瘿内壁表层间取食[18-19]。本研究将虫瘿内壁切成小方块后,细胞间的唾液蛋白会溶解到缓冲液中,而瘿壁组织的蛋白由于有细胞壁的束缚,一般不会轻易溶解到缓冲液中,这样就避免了肚倍蚜唾液蛋白和虫瘿组织蛋白的混合或覆盖,从而可以提取到纯度较高的肚倍蚜唾液蛋白。
唾液蛋白提取液的浓缩是蛋白分析和鉴定的另一个关键环节。从肚倍蚜虫瘿组织中析出的肚倍蚜唾液蛋白,量不仅少且浓度低,需要经过浓缩才能达到质谱分析的要求,本研究分别采用超滤膜法与冷冻干燥法进行浓缩,结果表明,冷冻干燥法适合虫瘿组织内肚倍蚜唾液的提取,是唾液浓缩的有效方法。
对于刺吸式昆虫而言,其唾液通常是在唾液腺内合成和贮存,并在取食过程中通过口针将唾液蛋白注入寄主植物组织中。有研究表明,昆虫唾液的成分会由于食物的不同而变化,表明昆虫唾液中的酶类与食物的种类相互关联[20-23],因此,解剖唾液腺或采用双层膜夹营养液法模拟昆虫取食获得的唾液蛋白,与昆虫自然取食寄主植物分泌的唾液蛋白存在着差异。蚜虫唾液收集时采用的双层膜夹营养液法,其营养液的选择极大多数为蔗糖溶液或蒸馏水[24-26];而当肚倍蚜(干母)在虫瘿内壁刺吸取食时,食物来源为植物木质部或韧皮部筛管中的汁液。两种食物来源差异甚大,唾液的成分也将随之发生变化,其唾液蛋白种类也会有所不同。本研究从蚜虫取食的虫瘿组织中分离和鉴定唾液的蛋白,是蚜虫自然取食过程中分泌的唾液蛋白,可为研究昆虫与寄主植物互作提供依据。本研究从肚倍蚜取食的虫瘿组织中分离和鉴定到部分唾液蛋白,与已知的角倍蚜唾液蛋白( 31 种) 及唾液腺蛋白(141 种)进行比较分析(图2),结果显示与角倍蚜唾液腺蛋白存在1 个共有蛋白:ACYPI 006711;三者还存在1 个共有蛋白:ACYPI 006969。虫瘿组织中肚倍蚜唾液蛋白与角倍蚜唾液蛋白和唾液腺蛋白中共有蛋白的存在,反映了五倍子蚜唾液蛋白在唾液腺中合成和贮存、并通过模拟取食和自然取食将唾液蛋白注入营养液或植物组织的过程。
4 结论
本研究应用LC-MS/MS 方法从虫瘿组织中鉴定出12 种蛋白,其中编号为ACYPI 006711 的为延伸因子蛋白,在角倍蚜的唾液和唾液腺中也被鉴定到;编号为ACYPI 006969 的为Actin 蛋白,在角倍蚜唾液腺中也被鉴定到。表明从肚倍蚜虫瘿组织中鉴定的蛋白有很大的可能来自于肚倍蚜唾液,为深入探索致瘿昆虫唾液蛋白作用于寄主植物和虫瘿形成过程提供了新的方法和参考。

