云南核桃分心木黄酮提取及抗氧化性研究
何旭华 阚欢 黄陆繄 张娟 刘灿 刘云


摘 要:本研究采用超声波辅助乙醇提取云南核桃分心木黄酮,通过正交试验优化了提取工艺条件。选取AB-8大孔树脂对黄酮提取液进行纯化,并研究了纯化后黄酮提取液的抗氧化活性。结果表明,在乙醇浓度50%、料液比1∶50 g·mL-1和超声时间12 min时,黄酮得率为7.15%,纯度为48.35%。抗氧化活性试验中,黄酮浓度为2.5 mg·mL-1时,DPPH和ABTS自由基清除率分别达到90.68%和60.24%,铁离子还原力吸光值为0.456,即云南核桃分心木黄酮有较强的抗氧化性活性。
关键词:云南核桃;分心木;黄酮;提取工艺;纯化;抗氧化性
Abstract:The flavonoids of distracted wood from Juglans sigilata was extraction by ultrasound, and the extraction process was optimized by orthogonal experiment. AB-8 macroporous resin was selected to purification the flavonoids, and the antioxidant activity of the flavonoids was determined. The results show that the ethanol concentration 50%, the ratio of material to liquid 1∶50 g·mL-1, and ultrasonic time 12 min, the yield of flavonoids was 7.15% and the purity was 48.35%. In the antioxidant activity test, when the concentration of flavonoids was 2.5 mg·mL-1, the free radical scavenging rates of DPPH and ABTS reach 90.68% and 60.24%, respectively, and the absorption value of iron ion reducing power was 0.456, so the flavonoids of distracted wood have strong antioxidant activity.
Key words:Juglans sigilata; Distracted wood; Flavonoids; Extraction process; Purification; Antioxidant
中圖分类号:R284
云南核桃(Juglans sigilata)分心木,是胡桃科(Jualandaceae)核桃属(Juglans)植物核桃果仁之间的干燥木质隔膜,又称胡桃隔、胡桃夹、胡桃衣等,占核桃质量的4%~5%。核桃分心木体轻质脆且易折断,颜色呈棕色或浅棕褐色[1-2],味道苦涩、食性平和。新疆少数民族医学记载,分心木可改善体寒、肾虚的生理虚弱,且治疗多梦、遗精、遗尿、尿血、泄痢、牙龈出血、带下和口腔溃疡等多种疾病[3-4]。研究表明,核桃分心木富含多种生物活性成分,包括黄酮、有机酸、酚类、生物碱、油脂、皂苷、挥发油、氨基酸、鞣质、糖类、多肽及其他微量化合物,其中黄酮类化合物含量较高[5-9]。
黄酮类物质广泛存在植物中,是以α-苯基苯并吡喃酮为主体的一系列物质,被广泛应用在食品添加剂和治疗疾病方面,它能抑制人体产生有害的自由基,也能清除多余的自由基,可延缓衰老、抗肿瘤、预防心脑血管疾病和癌症[10]。相关研究表明,核桃分心木的水提液或醇提液能抗菌,所含黄酮皂苷物质具有较强的抗氧化效果,可改善小鼠的肾阳虚病症[11-13]。云南省作为全国最大的核桃生产基地,也是深纹核桃的原产地和高产区,其核桃具有种源独特、品质好、产量高、产值高、营养丰富、味道醇香等优点,深受大众欢迎[14-15]。分心木作为核桃副产物,开发利用不足,其有一定的药用价值和食用价值,富含多种营养成分。研究其抗氧化性能,以治疗疾病和开发天然的抗氧剂。
本文研究云南核桃分心木中黄酮的提取及工艺优化,并初步纯化黄酮提取液,考察纯化液对DPPH、ABTS自由基清除,以及铁离子还原力的抗氧化活性。为深入研究和开发利用核桃分心木提供参考依据,同时提高云南核桃副产物经济收益和资源利用率。
1 材料与方法
1.1 试验材料
核桃分心木,云南磨浆农业有限公司提供。AB-8大孔树脂,购自安徽三星树脂科技有限公司;芦丁标准品,购自上海源叶科技有限公司;1,1-二苯-2-苦基肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),购自合肥博美生物科技有限责任公司;亚硝酸钠、氢氧化钠、硝酸铝、无水乙醇(99.7%)、过硫酸钾、铁氰化钾、磷酸盐缓冲液、三氯乙酸、六水合三氯化铁,购自天津市风船化学试剂科技有限公司。以上试剂均为分析纯。
1.2 主要仪器
UV-2600紫外可见分光光度计,岛津仪器(苏州)有限公司生产;YB-250A型高速多功能粉碎机,永康市速峰工贸有限公司生产;SHZ-DⅢ循环水式多用真空泵,上海力辰邦西仪器科技有限公司生产:SB25-12DTDS超声波清洗机,宁波新艺超声设备有限公司生产;KH20R-Ⅱ台式冷冻高速离心机,湖南凯达科学仪器有限公司生产;2.5 L型冷冻干燥机,LABCONCO公司生产;RV3V旋转蒸发仪,艾卡仪器设备有限公司生产;DK-98-Ⅱ电热恒温水浴锅,天津市泰斯特仪器有限公司生产;DHG-9240A电热恒温鼓风干燥机,上海齐欣科学仪器有限公司生产。
2 方法
2.1 芦丁标准曲线的绘制
参照文献[16],方法稍做改动。精密称量10 mg芦丁标准品,溶解于30%乙醇并定容至100 mL。以0.1 mg·mL-1芦丁标准品作为母液,按浓度梯度分別配制浓度为0.000、0.005、0.010、0.020、0.030、0.040、0.050、0.060、0.070 mg·mL-1和0.080 mg·mL-1的标准溶液于10 mL容量瓶中,分别加入0.3 mL 5%(质量分数)NaNO2和10%Al(NO3)3,再加入4 mL 4%NaOH,每次加液间隔6 min,最后用30%乙醇定容至10 mL。均匀混合静置15 min,510 nm处测定样品吸光值,每组平行测定3次。
以芦丁标准品吸光值(Y)对芦丁浓度(X)进行回归分析,回归方程为Y=5.356 6X+0.086 6,R2=0.999 44,具有良好的线性关系,芦丁标准曲线具有较强的可靠性。所得芦丁标准曲线如图1所示。
2.2 总黄酮提取及测定
核桃分心木预处理:将云南核桃分心木分拣,清洗,铺于不锈钢托盘置50 ℃恒温干燥箱,干脆后经粉碎机粉碎,过80目筛保存于密封袋。
称1 g核桃分心木,用一定浓度乙醇溶解并置超声波中辅助提取,抽滤得黄酮粗提液,定容至50 mL,备用。参照标准曲线测定方案,取0.6 mL备用液于10 mL容量瓶测定分心木黄酮吸光值,将吸光值代入标准曲线方程算出黄酮浓度,利用得率方程(1)算出黄酮含量。
式(1)中,C-黄酮浓度,g·mL-1;V-黄酮提取液总体积,mL;M-分心木质量,g。
2.3 单因素试验
选取乙醇浓度、料液比、超声时间进行单因素试验,分析3个因素对黄酮得率的影响。试验设计见表1。
2.4 正交试验设计
以单因素试验结果为基础,设计三因素三水平正交试验,优化单因素对核桃分心木黄酮提取的影响,确定最优方案。试验设计如表2。
2.5 核桃分心木黄酮分离纯化试验
最优工艺下,称20 g分心木超声提取,抽滤,旋蒸浓缩,用型号为AB-8的大孔树脂以样液每3 s一滴进行洗脱纯化,按2.2方法测定纯化液黄酮含量,冷冻干燥得黄酮干重,按公式(2)计算黄酮纯度。
式(2)中,m-黄酮粗提物质量,g;M-纯化后分心木黄酮干重,g。
2.6 核桃分心木黄酮抗氧化性研究
2.6.1 DPPH自由基清除率的测定
用棕色容量瓶配制一定浓度的DPPH-乙醇溶液,参考Cheng等的方法[17],适当调整。分别取样品、DPPH-乙醇溶液2 mL于10 mL离心管,避光,37 ℃水浴30 min。在517 nm处测吸光值A1,无水乙醇代替DPPH-乙醇溶液测吸光值A2,无水乙醇代替样品液测吸光值A0,平行测3次,取平均值。按公式(3)计算DPPH自由基的清除率(RSA表示自由基清除活性)。
式(3)中,A0-空白吸光值,A1-样品吸光值,A2-无水乙醇代替DPPH-乙醇溶液吸光值。
2.6.2 ABTS自由基清除率的测定
参照文献[18]改进方案,将7 mmol·L-1 ABTS自由基与140 mmol·L-1过硫酸钾溶液于棕色容量瓶中等体积混合,静置反应12 h,即得ABTS自由基反应液。在734 nm处用无水乙醇稀释ABTS自由基反应液吸光值至0.700±0.02,避光现用。取2 mL样品溶液,2 mL ABTS自由基反应液于10 mL离心管,混合摇匀10 s,静置6 min后,于734 nm处测吸光值A1,样品用无水乙醇代替测吸光值A0,平行测定3次,取平均值。按公式(4)计算ABTS自由基的清除率:
2.6.3 铁离子还原力的测定
参照高行恩等[19-20]的方法适当调整,取2.0 mL样液于10 mL离心管,加入5 mL 0.2 mol·L-1磷酸盐缓冲液(pH=6.6)和5 mL 1%铁氰化钾溶液,混匀,50 ℃水浴反应30 min,降至室温后,加入5 mL 10%三氯乙酸,4 000 r·min-1离心10 min。分别取5 mL离心管上清液、蒸馏水和0.1%三氯化铁,均匀混合静置10 min,700 nm处测吸光值。
3 结果与分析
3.1 单因素试验结果与分析
3.1.1 乙醇浓度对云南核桃分心木黄酮得率的影响
乙醇浓度对云南核桃分心木黄酮得率的影响如图2所示。由图2可知,黄酮得率随乙醇浓度的增大呈先增大后急剧减小趋势,当浓度为40%时达到最大值3.38%。黄酮类化合物因结构不同而呈现不同的极性,依据相似相溶原理,极性越大提取物的杂质越多,黄酮得率越小;极性越小黄酮溶出量越少,得率越小。因此,选取40%乙醇时,黄酮得率最大。
3.1.2 料液比对云南核桃分心木黄酮得率的影响
料液比对云南核桃分心木黄酮得率的影响如图3所示。由图3可知,核桃分心木黄酮得率随料液比增加呈现上升趋势,当料液比为1∶70 g·mL-1时,核桃分心木黄酮的得率最大,其最大得率为2.80%。溶剂对分心木中的黄酮具有扩散作用,且溶剂体积越大,对核桃分心木中黄酮的扩散作用越大,而分心木中黄酮的扩散能力越强,黄酮得率越大。料液比为1∶60 g·mL-1和1∶70 g·mL-1时,黄酮得率相差较小,黄酮浓度接近饱和,考虑到成本及资源合理利用,最终选择黄酮提取的最佳料液比为1∶60 g·mL-1。
3.1.3 超声时间对云南核桃分心木黄酮得率的影响
超声时间对云南核桃分心木黄酮得率的影响如图4所示。由图4可知,核桃分心木黄酮得率随时间呈先增加后减少的趋势:当超声时间为6~12 min时,得率呈上升趋势;12~14 min时,呈下降趋势;超声时间为12 min时,有最大得率2.93%。核桃分心木中黄酮随超声时间延长向提取溶剂扩散并达到溶解平衡,因此提取量不断增加至最大值;超声时间越长,黄酮结构越易被破坏和氧化,导致提取量下降。此外,超声时间延长,会造成能源过度消耗,综合考虑超声时间应选择12 min。
3.2 正交试验
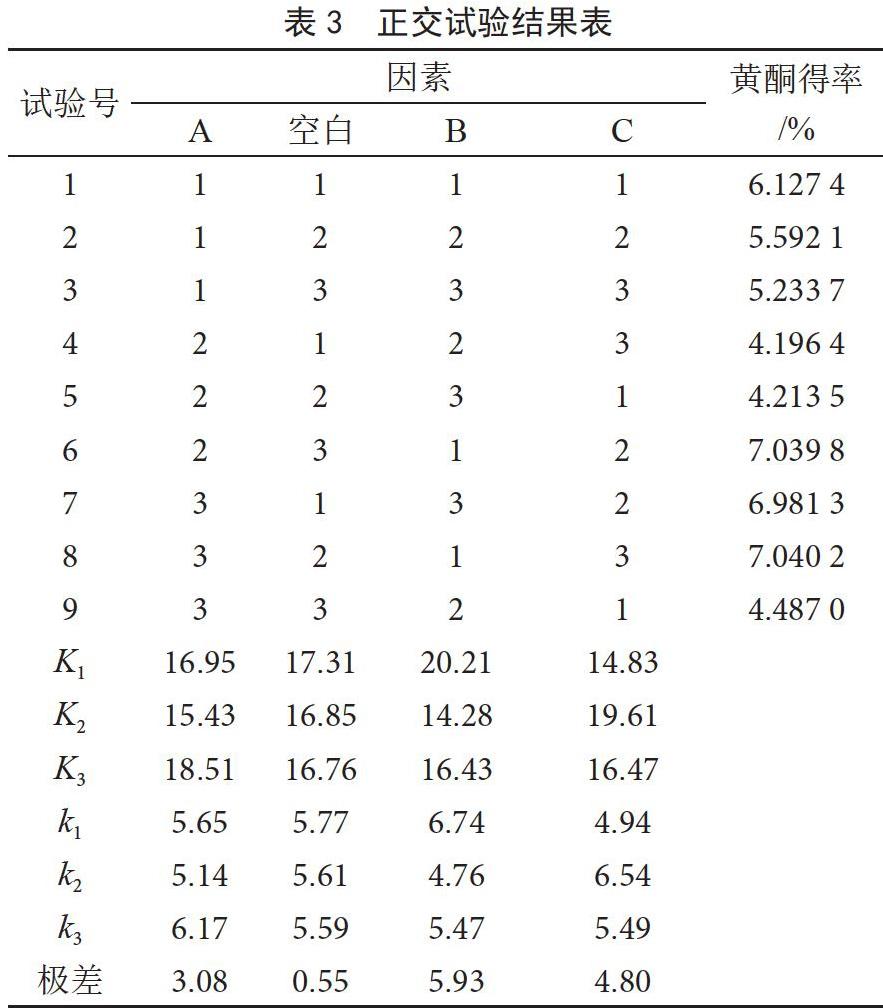
单因素基础上,以黄酮得率为指标,采用L9(34)正交试验设计表进行试验,试验结果见表3。
由表3可知,影响核桃分心木黄酮得率的主次顺序为B>C>A,最优工艺为A3B1C2,即乙醇濃度为50%、料液比1∶50 g·mL-1、时间12 min。
采用方差分析以减小试验误差,提高试验精准度,同时分析分心木黄酮提取受各因素影响的程度,见表4。利用显著性检验,查表得临界值F0.01(2,2)=99.00,F0.05(2,2)=19.00,所以对于给定的显著性水平,由表4可知,FA=26.05>F0.05(2,2),FB=99.19>F0.01(2,2),FC=65.28>F0.05(2,2),通过正交试验方差分析表可得,因素A、C对试验有显著影响,因素B对试验有非常显著的影响。
3.3 黄酮粗提物纯化
选取最优工艺,核桃分心木中黄酮经过纯化试验后,黄酮纯度为48.35%。
3.4 分心木抗氧化活性分析
以3.3纯化液为样品,DPPH、ABTS自由基清除率和铁离子还原能力为指标,进行黄酮抗氧化性研究,结果见表5。
由表5可知,分心木黄酮纯化液对DPPH、ABTS自由基和铁离子均有一定清除效果,在试验浓度范围内,黄酮浓度与自由基清除率呈正相关,随浓度增大而增大。不同黄酮浓度对DPPH和ABTS自由基清除效果不同,浓度在0.5 mg·mL-1,DPPH清除率比ABTS高35.688个百分点,铁离子还原能力吸光值为0.173。浓度在2.5 mg·mL-1时,DPPH自由基清除率高达90.681%,对DPPH自由基清除效果较强,对ABTS自由基清除率良好,清除率为60.236%。黄酮浓度在0.5~2.5 mg·mL-1时,吸光值从0.173增长到0.456,分心木黄酮的还原能力较强,抗氧化性较好。
4 结论
本文运用正交试验设计,优化云南核桃分心木黄酮提取,试验表明,乙醇浓度50%、料液比1:50 g·mL-1、超声时间12 min是云南核桃分心木黄酮的最优提取方案,得率为7.15%。粗提物经过AB-8大孔树脂纯化,纯度为48.35%。纯化液对DPPH、ABTS自由基和铁离子的抗氧化试验表明:云南核桃分心木黄酮有较高的抗氧化性,可制备天然的抗氧化剂,为开发核桃分心木黄酮药物奠定基础。
参考文献:
[1]王嘉佳,高山,何爱民,等.核桃分心木成分分析及其功能性研究进展[J].食品工程,2019(1):12-17.
[2]王丹,董红敬,杨鹏,等.分心木中化学成分的分离与鉴定[J].食品工业科技,2018,39(14):231-234.
[3]吐尔洪·吾买尔.维吾尔医药植物学(维吾尔文)[M].乌鲁木齐:新疆人民出版社,2004.
[4]穆塔力甫·艾力,阿吉·艾米提.维吾尔医常用草药(维吾尔文)[M].乌鲁木齐:新疆人民卫生出版社,2004:695.
[5]毕肯,阿不得克里木,韩艳春,等.核桃分心木化学成分的预试验研究[J].新疆医科大学学报,2010,33(9):1044-1046.
[6]韩艳春,维吾尔药新疆核桃分心木有效化学成分及其药理作用的研究[D].乌鲁木齐:新疆医科大学,2010.
[7]景援朝.分心木化学成分及其活性研究[D].济南:济南大学,2015.
[8]朱青梅.维吾尔药材核桃分心木化学成分、质量标准及其活性研究[D].乌鲁木齐:新疆医科大学,2015.
[9]张旭,曹丽娟,陈朝银,等.核桃隔开发利用的研究进展[J].湖北农业科学,2015,54(23):5793-5797.
[10]林国荣,吴磊,吴锦程.枇杷叶总黄酮的富集及其生物活性的研究[J].食品科技,2014,24(11):233-237.
[11]贺娜,耿树香,宁德鲁,等.云南核桃分心木氨基酸含量及综合评价[J].西南林业大学学报,2018,38(4):200-205.
[12]杨明珠,田新雁,肖朝江,等.核桃分心木化学成分与生物活性研究[J].天然产物研究与开发,2012,24(12):1707-1711.
[13]张天睿,杨爱玲,张天艺,等.分心木镇静催眠作用探究[J].中国药事,2017,31(8):960-964.
[14]陆俊,赵安琪,成策,等.核桃营养成分与生理活性及开发利用[J].食品与机械,2014,30(6):238-242.
[15]谢马宁.漾濞核桃甲天下独领风骚三千年[J].云南林业,2015,36(6):48-49.
[16]Somboonpanyakul P,Barbut S,Jantawat P,et al. Textural and sensory quality of poultry meat batter containing malva nut gum,salt and phosphate[J].LWT-Food Science and Technology,2007,40(3):498-505.
[17]Cheng Z,Moore J,Yu L. High-throughput relative DPPH radical scavenging capacity assay[J].Journal of agricultural and food chemistry,2006,54(20):7429-7436.
[18]李笑笑,张文斌,杨瑞金.超声处理核桃仁及其提取物的抗氧化性分析[J].安徽农业科学,2016,44(19):90-93.
[19]Ardestani A,Yazdanparast R. Antioxidant and free radical scavenging potential of Achillea santolina extracts[J].Food Chemistry,2007,104(1):21-29.
[20]高行恩,王洪新.不同提取方法对山药多糖含量及其体外抗氧化活性的影响[J].食品与发酵工业,2015,46(7):256-262.

