新型根管充填材料HiFlow的体外细胞毒性研究
戴怡茹 杨健
根管治疗经过预备和消毒,根管内仍可能存有病原微生物,根管充填是根管治疗的重要步骤,其最终目标是以生物相容性良好的材料严密充填根管,封闭根尖孔,占据病原微生物可能存在的空腔[1]。目前,临床上常用的根管充填材料为核材料和根管封闭剂[2]。根管系统的结构非常复杂,根管封闭剂的使用至关重要[3]。理想的根管充填材料不仅要有长久的封闭性、体积稳定不收缩、一定的抗菌作用、X线阻射性和不使牙变色等特点,同时要具有良好的生物相容性[4]。目前临床常用的根管封闭剂按其成分可分为:氧化锌丁香油类、氢氧化钙类、树脂类和近年来以iRoot®SP为代表的生物陶瓷类。以 iRoot®SP为代表的生物陶瓷类根管封闭剂具有良好的抗菌性、根尖封闭性和生物相容性[5-6],由于iRoot®SP 封闭剂的最佳加热温度尚无明确定论,产品说明书推荐使用单尖充填技术。EndoSequence®BC SealerTMHiFlow(HiFlow,Brasseler USA, 美国)是Brasseler USA公司专为使用热牙胶垂直加压充填法而设计的一种新型生物陶瓷类根管封闭剂。目前还没有关于HiFlow生物相容性的相关研究。本研究采用CCK-8法对比HiFlow、AH Plus、iRoot®SP、MTA 4 种根充材料对L929细胞的细胞毒性,评价HiFlow对L929细胞的细胞毒性作用。
1 材料与方法
1.1 主要材料和仪器
HiFlow(Brasseler USA,美国);AH Plus、MTA(Dentsply,德国);iRoot®SP(Innovative Bioceramix Inc,加拿大);L929细胞(南昌大学公卫实验室馈赠);胎牛血清(四季青);DMEM高糖培养基(Solarbio);胰蛋白酶、CCK-8试剂盒(TransGen Biotech);细胞计数板(QIUJING);超净台(AIRTECH);恒温培养箱(37 ℃、湿度95%、含5%CO2)(Thermo,德国);倒置相差显微镜(Optec);酶标仪(PerkinElmer,EnSpire,美国)。
1.2 细胞培养
将L929细胞复苏后接种于培养瓶中,加入含10%胎牛血清的DMEM高糖培养基,置于培养箱内培养48 h后换液,继续培养至细胞长满培养瓶底约80%~90%后用胰蛋白酶消化传代,继续培养至3~4 代。
1.3 浸提液制备
在无菌条件下将HiFlow、调和的AH Plus、iRoot®SP、调和的MTA置于模具中制成直径约5 mm,厚度约2 mm的圆片样本,每组根管充填材料制备4 个样本,置于培养箱内固化24 h。固化后的每组样本分别加入1 ml浸提介质(含10%胎牛血清的L929细胞培养基),置于培养箱内24 h后取出样本。浸提液用于CCK-8实验。
1.4 CCK-8实验
取处于对数生长期末的第3~4代细胞,用胰蛋白酶消化分散,使用细胞计数仪调整细胞密度为5×104个/ml,取24 孔板1块,以1 ml/孔接种细胞悬液,分别测定24、48、72、96、120 h细胞数目,每时段设4 个复孔,取均值绘制L929细胞生长代谢曲线。取96 孔板3 块,以100 μl/孔接种细胞悬液,将培养板置于培养箱内预培养24 h。镜下观察细胞贴壁后,弃液。在A组、B组、C组、D组分别加入100 μl各组样本浸提液至相应细胞培养孔中,E组(正常对照组)加100 μl细胞培养基,每组设4 个复孔,分别置于培养箱培养12、24、48 h后各取1 板,弃液,每孔加入100 μl细胞培养基和10 μl CCK-8试剂混合液,另设置4 孔为F组(空白组):加入100 μl细胞培养基和10 μl CCK-8试剂混合液。将培养板置于培养箱内孵育3 h。用酶标仪测定各实验组在450 nm处的吸光度,计算细胞相对增殖率。
1.5 细胞鉴定
各组根充材料浸提液培养L929细胞,分别于12、24、48 h后倒置显微镜观察细胞状态,并随机拍照记录48 h细胞形态变化。
1.6 统计学分析
所有检测均由一名辅助人员盲法完成,实验数据采用SPSS 19.0软件进行统计分析,采用单因素方差分析,双侧检验水准为α=0.05。
2 结 果
2.1 L929细胞生长曲线
72 h后,细胞增殖明显减缓(图 1)。

图 1 L929细胞生长代谢曲线

表 1 各组根充材料浸提液培养L929细胞12、24、48 h的A值
2.2 CCK-8实验
各组根充材料浸提液培养L929细胞12、24、48 h A值比较见表 1。不同根充材料浸提液培养L929细胞12、24、48 h细胞毒性总体差异有统计学意义(P<0.05);其中B组与A组、C组、D组差异均有统计学意义(P<0.05);12、24和48 h A组、C组和D组差异差异无统计学意义(P>0.05)。
各组根充材料浸提液培养L929细胞12、24、48 h细胞相对增殖率均值比较见图 2。
2.3 各组样本浸提液培养的L929细胞形态改变
培养48 h后倒置相差显微镜下观察细胞形态改变,结果如图 3。E组细胞为正常长梭形、多角形,牢固地粘附于培养皿底,排列较密集,折光性强,胞内结构清晰。A组、C组和D组细胞形态呈长梭形、多角形,牢固贴壁于培养皿底,排列较密集,折光性较强,胞内结构清晰。B组部分细胞形态改变为球形,部分细胞悬浮不贴壁,细胞数目较少,部分细胞出现核皱缩,部分细胞结构破坏有细胞碎片。
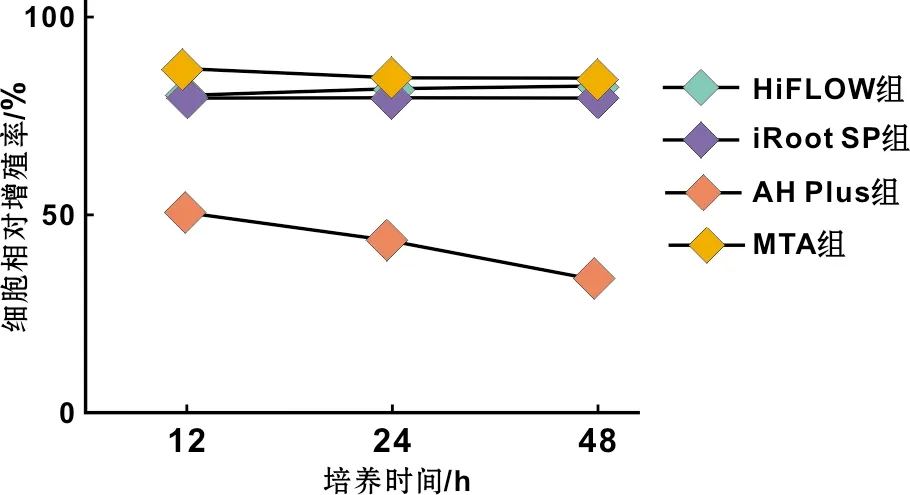
图 2 各组根充材料浸提液培养L929细胞12、24、48 h的细胞相对增殖率

图 3 L929细胞与各根充材料浸提液培养48 h的细胞形态(相差显微镜, ×200)
3 讨 论
由于根管峡部、侧支根管、根尖分歧等不规则区域的存在,根管解剖形态复杂,单纯核材料无法严密充填根管而导致根尖微渗漏的机会增加,根管封闭剂与核材料结合使用可获得严密的三维效果的充填,因此根管封闭剂在根管充填过程中发挥着重要作用。在根管充填过程中,尤其是使用热牙胶垂直加压充填法,根管封闭剂容易被推出根尖孔,与根尖周组织直接接触,其毒性作用的大小直接影响根尖周组织建立有利于愈合修复的环境。Oztan等[7]研究显示根管封闭剂材料固化过程中会释放物质至根尖周组织,Meryon[8]报道释放物质的量与材料表面积相关联。另外有研究[9]表明材料的释放物质可以用材料的浸提液来表示,而浸提液的细胞毒性即可模拟根管封闭剂固化过程中释放的物质对根尖周组织的毒性作用。根据以上结果,本实验按照ISO 10993-5:1999标准制备浸提液用于比较HiFlow、AH Plus、iRoot®SP、MTA的生物相容性。
细胞毒性实验具有敏感性高、简便和研究周期短等优点,四甲基偶氮唑盐微量酶反应色法(MTT法)是最早使用检测材料的细胞毒性的比色法,Cell Counting Kit-8比色法(简称CCK-8法)为MTT法的替代法,两者原理相同:将活细胞线粒体内的脱氢酶还原成甲臜,通过甲臜数量的检测就可以反映细胞的活性,不同在于MTT法甲臜产物不溶于水,检测需先用有机溶剂溶解,对细胞毒性高,而CCK-8法甲臜产物是水溶性的,对细胞基本无毒性,实验操作步骤少、周期短,能有效地减少实验过程中的污染,实验结果更加灵敏和稳定[10-11]。因L929细胞易获得、易存活且传代周期短,在细胞毒性实验中应用广泛。故本实验本研究采用CCK-8法评价HiFlow对L929细胞的细胞毒性。
CCK-8法显示各组根充材料浸提液培养L929细胞12、24、48 h A值均显示AH Plus的细胞毒性较HiFlow、iRoot®SP、MTA大,差异有统计学意义,这和以往将AH Plus的细胞毒性与MTA对比的研究结果一致,原因是AH Plus的主要成分是四氮六甲环和二甲酚A二环氧丙酯醚,A剂和B剂混合后四氮六甲环在水溶液环境中会分解为甲醛和胺,甲醛通过激活IL-6和IL-8基因的表达引起细胞变态反应使之存在一定的细胞毒性[12-14]。 HiFlow和iRoot®SP、MTA的细胞毒性类似,其12、24、48 h A值差异无统计学意义。MTA的主要成分为硅酸盐水泥,反应产物硅酸钙水合物(C-S-H)和氢氧化钙释放的Ca2+使其不论是对细胞还是骨均有良好的生物相容性,亦可促进成骨的发生,因此MTA的细胞毒性通常作为评价根充材料生物相容性的金标准[15-16]。iRoot®SP的主要成分为硅酸钙、磷酸钙、氢氧化钙等,磷酸钙和氢氧化钙反应产生羟基磷灰石和水,水促进硅酸钙水化反应生成C-S-H和氢氧化钙,在细胞容相性、组织相容性等方面均具有与MTA相当的良好生物相容性[17-18]。根管充填后尤其是在患牙根尖部狭窄区受到炎性破坏的情况下,极佳的流动性使得iRoot®SP容易超出根尖孔与根尖周组织长期接触,但iRoot®SP超充对患牙的愈合无明显影响[19],其良好的生物相容性有利于根尖周组织的健康。HiFlow与iRoot®SP的主要成分相同,仅粒度分布不同;与iRoot®SP相比在加热时表现出较低的粘度,且具有更好的X线阻射性,使其更适合用于热牙胶垂直加压充填法,加热温度150~220 ℃;Brasseler USA公司称其具有良好的生物相容性、与羟基磷灰石粘接性能、低收缩性、抗菌性、X线阻射性。由本实验可见HiFlow对L929细胞的细胞毒性作用与MTA、 iRoot®SP类似,其差异无统计学意义;小于AH Plus,其差异有统计学意义,认为可临床用于根管充填。临床广泛应用还需进一步的临床应用加以验证。

