四甲基丙烯酸酯季铵盐单体改性口腔复合树脂的细胞毒性研究
吴帆 王卫国 班晶浩 杨国利
临床研究表明树脂材料的远期的成功率较低,使用寿命较短[1]。造成树脂远期失败的最主要原因是树脂产生了继发龋。树脂充填物在口内使用过程中,变形链球菌等产酸和耐酸细菌积聚在牙齿和树脂填充物上,并渗入树脂与牙齿之间的微间隙,通过产酸造成牙釉质和牙本质脱矿[2]。牙本质脱矿后,唾液蛋白酶或内源性肽酶如基质金属蛋白酶(MMPs)和半胱氨酸组织蛋白酶会导致牙本质胶原基质的降解,从而在牙齿与树脂之间产生继发龋坏[3]。所以,产酸和耐酸细菌是造成树脂继发龋非常重要的一个因素,而研究出具有抗菌性能的树脂一直是研究的热点[4]。
含甲基丙烯酸酯基团的季铵盐(QAS)单体作为一种可聚合的抗菌材料,可以与树脂单体发生共价结合连接到树脂基质中[5]。QAS单体改性树脂抗菌作用的发挥不依赖抗菌材料的析出,而是通过树脂表面的正电荷及长链烷基发挥接触抗菌作用[6],所以改性材料具有稳定、持久的抗菌性,且理化性能不会因为抗菌材料析出而下降[7-8]。但是,基于抗菌单体改性的树脂材料在临床中成功的应用不仅依赖于其良好的抗菌性能及理化性能,还在很大程度上取决于其生物安全性能。目前大多数的QAS单体中仅含有一个或两个甲基丙烯酸酯(MA)基团,与树脂基质的反应活性和交联度均较低,导致改性树脂固化后残留单体增多,改性树脂的细胞毒性较净树脂高[9]。提高季铵盐单体中MA基团的数目可以提高改性树脂的交联度[10-11],有望降低树脂中单体的残留,从而提高其生物安全性。四甲基丙烯酸酯QAS单体具有4 个MA基团,有望改善改性树脂的生物安全性。本研究对其细胞毒性及其引起细胞毒性的机理进行了初步研究,为改善含抗菌单体的齿科功能性树脂材料的生物安全性、拓展其在深龋及牙髓保护方面的应用提供理论及实验支持。
1 材料及方法
1.1 材料
树脂单体双酚A甲基丙烯酸缩水甘油酯(Bis-GMA)、引发剂对二甲氨基苯甲酸乙酯(EDMAB)、树脂稀释单体双甲基丙烯酸二缩三乙二醇酯(TEGDMA)、催化剂樟脑醌(CQ)(Sigma-Aldrich公司,美国);四甲基丙烯酸酯季铵盐单体(TMHDB,西安赛尔美生物医药科技有限公司)。
1.2 方法
1.2.1 制备实验树脂 将Bis-GMA与TEGDMA按1∶1比例混合,置于磁力搅拌机上常温避光搅拌4 h;按照表 1中的比例加入CQ和EDMAB,继续常温避光搅拌2 h制成净树脂。按照表 1中的比例向净树脂加入TMHDB(TH组)常温避光搅拌4 h,未添加QAS单体的净树脂组为对照组(CO组)。

表 1 实验分组及树脂组成
1.2.2 树脂浸提液制备 将树脂滴入聚四氟乙烯模具(4 mm×10 mm×2 mm)中,两面压实载玻片,使用牙科光固化机(桂林市啄木鸟)每面光固化20 s,制成长条状树脂片。使用紫外线照射树脂片双面各30 min后,放入无菌离心管中,加入含10%胎牛血清的DMEM培养基(GIBCO公司, 美国)中于37 ℃浸提24 h,浸提标准为:树脂表面积/浸提液体积为1.25 cm2/ml(ISO 10993-12标准)。浸提完成后使用0.22 μm的过滤器除菌。未用树脂浸提的含10%胎牛血清的DMEM培养基为阴性对照组(CK组)。浸提液制备完成后,按照对半稀释的方法制备出5 个梯度浓度含树脂浸提液的培养基。
1.2.3 细胞培养 将冻存小鼠结缔组织成纤维细胞 L929,用含10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养基中37 ℃、5% CO2培养箱中复苏,培养,经过3 次传代,生长情况稳定。
1.2.4 CCK-8实验及细胞形态观察 取对数生长期的受试细胞系,胰蛋白酶消化后制成2.5×104个/ml的单细胞悬液。将细胞悬液接种于96 孔培养板,每组6 个复孔,每孔200 μl(即5 000 个细胞/孔),在 37 ℃含5% CO2的培养基中培养24 h使细胞贴壁,弃原培养液。TH组加入树脂浸提原液及其稀释液;CO组加入净树脂浸提原液及其稀释液;CK组为不含浸提液的细胞培养液。孵育1、3、5 d后,使用LAS V4.9相差三目显微镜(Lecia公司,德国)观察各组图像,并进行照相;向每个孔中加入20 μl Cell Counting Kit-8(CCK-8,APE BIO公司,美国)染料溶液,再孵育4 h[9]。使用酶标仪测量每个孔中溶液在450 nm处的吸光度。使用以下公式计算细胞的相对生长速率(RGR)。
1.2.5 细胞周期分析 将细胞以1×105个/ml的浓度接种于6 孔板中,孵育24 h使细胞贴壁并达到80%融合。TH组加入树脂浸提原液;CO组加入净树脂浸提原液;CK组为细胞培养液。孵育24 h后,收获漂浮细胞和附着细胞,用PBS洗涤2 次,并重悬浮。 用10 ml冷的75%乙醇在4 ℃下固定过夜后,用PBS洗涤细胞,随后在室温下用200 μl碘化丙啶(PI)(Sigma-Aldrich公司,美国)溶液染色30 min。 使用流式细胞术(Becton-Dickinson公司,美国)测定细胞周期分布,每个样本检测5 000 个细胞。
1.2.6 细胞凋亡及坏死的分析 将细胞以1×105个/ml的浓度接种于6 孔板中,孵育24 h使细胞贴壁并达到80%融合。TH组加入树脂浸提原液;CO组加入净树脂浸提原液;CK组为细胞培养液。孵育24 h后,收获漂浮细胞和附着细胞,用PBS洗涤2 次,并重悬浮。随后根据标准方法,在4 ℃用V-Alexa Fluor 488(Invitrogen公司,美国)和PI染色10 min。流式细胞仪分析存活、早期凋亡、晚期凋亡/坏死、及坏死细胞所占比例,每个样本检测5 000 个细胞。
1.2.7 细胞内活性氧(reactive oxygen species,ROS)水平分析 将细胞以1×105个/ml的浓度接种于6 孔板中,孵育24 h使细胞贴壁并达到80%融合。TH组分别加入树脂浸提原液;CO组加入净树脂浸提原液;CK组为细胞培养液。孵育3 h后,收获漂浮细胞和附着细胞,用PBS洗涤2 次,并重悬浮。将细胞用10 μmol/L DCFH-DA(上海翊圣生物)在37 ℃下染色20 min。 随后,分离细胞,用不含胎牛血清的培养基洗涤,并立即进行流式细胞术分析ROS水平,每个样本检测5 000 个细胞。
1.3 统计学分析
采用SPSS 17.0 统计学软件对所有数据资料进行统计学分析,行单因素方差分析,样本间的两两比较用Tukey 检验,P<0.05为差异有统计学意义。

图 1 L929细胞在不同浓度的树脂浸提液中培养1、3、5 d的形态及数目
2 结 果
2.1 细胞增殖分析
L929细胞在不同浓度的树脂浸提液中培养1、3、5 d的细胞数目见图 1。随着培养时间的延长,含有不同浸提液浓度的CO组和TH组的细胞数目均出现明显上升。培养第一天时,随着浸提液浓度的上升,细胞的数目在不断的减少;但在培养第三和第五天时,随着浸提液浓度的上升,细胞数目组间差异不明显。
L929细胞在树脂浸提原液中培养1、3、5 d后细胞的RGR见图 2。培养第一天时L929细胞在CO和TH浸提液中的RGR均较阴性对照组低,且差异具有统计学意义;在培养第三天TH组的RGR较CK组和CO组高,差异具有统计学意义;在培养第五天时CO组和TH组的RGR又较CK组低,其中CO组与CK组差异具有统计学意义。
2.2 细胞周期分析
CO组与TH组的G1期所占的细胞比例较CK组下降,而S期所占细胞比例较CK组增加,差异均具有统计学意义;CO组与TH组的G1和S期所占细胞比例无统计学差异;3 组的G2期细胞所占比例差异无统计学意义(图 3)。
2.3 细胞凋亡及坏死分析
L929细胞在不同培养基中的细胞凋亡及坏死分析结果见图 4。3 组活细胞、早期凋亡细胞以及晚期凋亡/坏死细胞所占比例之间无统计学差异。CO组在坏死细胞比例中高于CK组和TH组,差异有统计学意义。
2.4 ROS水平分析
L929细胞在不同培养基中的细胞凋亡及坏死分析结果见图 5。CK组几乎无ROS阳性细胞,而CO组与TH组ROS阳性细胞所占比例较CK组显著上升。CO组与TH组之间的差异无统计学意义。

图 2 L929细胞在不同培养液中的相对增殖速率
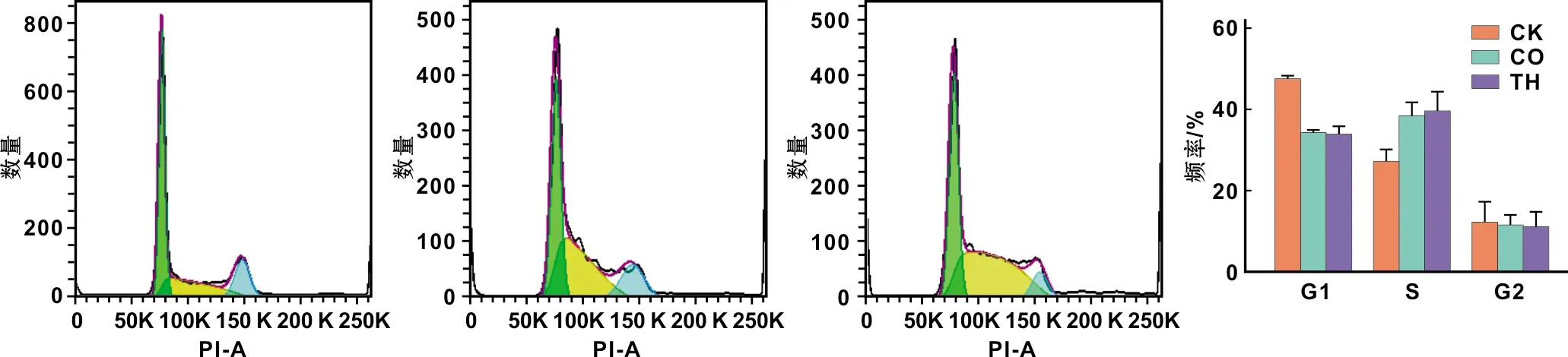
图 3 L929细胞在不同培养液中细胞周期分析(绿色: G1期; 黄色: S期; 蓝色: G2期)

图 4 L929细胞在不同培养液中凋亡及坏死分析
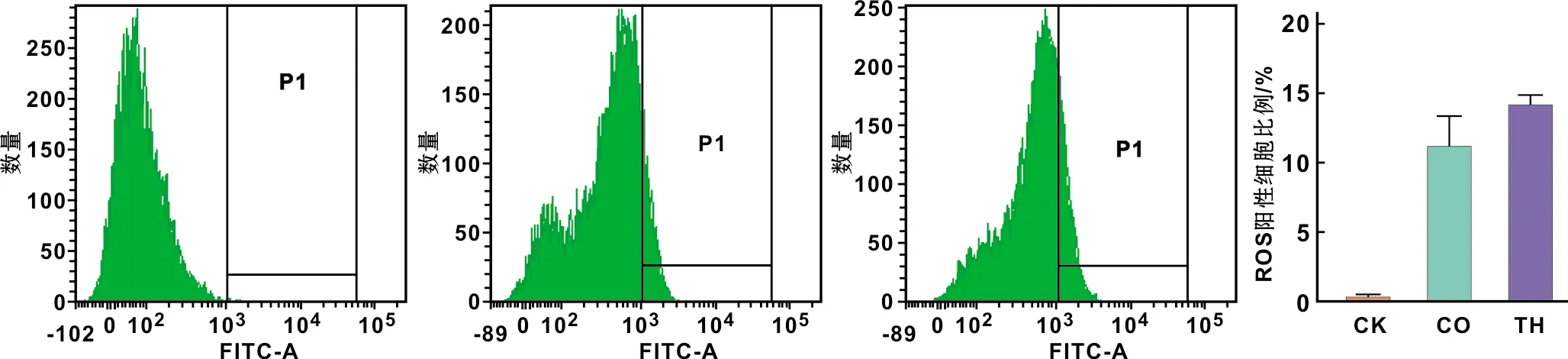
图 5 L929细胞在不同培养液中ROS水平分析
3 讨 论
基于季铵盐的抗菌材料已经运用于牙科树脂材料[12]、骨水泥[13]、缝合线和敷料[14]等多种生物医学材料的抗菌改性,并取得了令人满意的抗菌性能。季铵盐化合物的抗菌性能基于阳离子固定机理[15],主要依赖于带正电荷季铵基团吸引带负电荷的细菌,与细菌接触后季铵盐单体中的长链烷基可以穿透细胞壁并与细胞膜中磷脂双分子层发生反应,破坏细胞膜结构,导致细胞质外露,引起细菌死亡[16]。而真核细胞的细胞膜成分与细菌相似,也主要由磷脂双分子层组成,季铵盐从理论上来说也会对真核细胞包括人的细胞造成伤害[17]。此外,季铵盐单体中的可聚合甲基丙烯酸酯基团也可能是它细胞毒性的另一个来源。可聚合甲基丙烯酸酯基团是牙科单体的特征性基团,研究表明,常规的牙科甲基丙烯酸酯单体也具有一定的细胞毒性[18]。所以,研究并评估季铵盐单体改性功能材料的生物安全性至关重要。
在生物的代谢过程中,会产生超氧阴离子自由基、羟自由基和过氧化氢等一系列的活性氧[19]。细胞内的氧化还原处于一个动态平衡的状态,然而ROS大量产生时,超过细胞防御系统保护功能时,细胞内氧化还原平衡被打破,进而会对细胞产生不良的影响。研究表明齿科单体以及季铵盐单体引起细胞毒性的同时,伴随着细胞内ROS的过量产生以及氧化还原平衡的破坏[20]。本研究的结果表明CK组中ROS含量非常少,而CO组和TH组中ROS含量均显著上升,提示TMHDB与常规树脂单体类似,引起细胞毒性与氧化还原平衡的破坏有一定的关系。另一方面CO组与TH组ROS水平之间无统计学差异,说明了两种树脂浸提液对细胞ROS水平作用相似,TMHDB的添加并没有继续增加细胞内的ROS水平。
细胞内过量的ROS可以攻击细胞内生物大分子包括DNA、蛋白质及脂类等,引起DNA损伤,蛋白质合成受阻,当损伤程度较轻时,细胞可以通过调节细胞周期,使细胞获得足够的时间对DNA损伤进行修复、合成足够的蛋白质;当损伤程度较重时,细胞会通过凋亡或坏死发生死亡[21]。本实验通过对细胞死亡情况分析,可见CO组、TH组与CK组3 组活细胞、早期凋亡细胞以及晚期凋亡/坏死细胞所占比例之间均无统计学差异,仅CO组的坏死细胞比例高于其他两组。这说明净树脂浸提液以及含TMHDB的树脂浸提液对细胞的损伤程度都不重,并没有触发细胞凋亡信号引起细胞凋亡。细胞周期的结果显示CO组和TH组的S期所占细胞比例较CK组显著上升,G1期所占的细胞比例较CK组显著下降,这说明细胞在S期发生了阻滞。S期进行细胞DNA复制和蛋白质合成阶段,并完成染色体的复制。S期阻滞说明CO组以及TH组中DNA复制及蛋白质合成速率的下降,细胞需要更多的时间来合成DNA和蛋白质。CO组与TH组的G1和S期所占细胞比例无统计学差异;说明CO组和TH组两者对细胞周期的影响相似,向树脂中添加TMHDB并没有对细胞周期造成额外的不良影响。
细胞增殖分析是宏观层面上细胞活性的分析,可以直观的反应细胞的数量及增殖活性。本研究中所取的第一天、第三天和第五天这3 个观察点主要是对应于细胞生长曲线中的潜伏期、指数生长期和稳定期。细胞在经过一天左右的潜伏期后,即进入大量分裂的指数生长期,而5 d左右时细胞数量趋近于饱和到达稳定期。本研究中显微镜镜检及CCK-8结果表明均表明CO与TH组在第一天的细胞数量及RGR均明显小于空白对照组,且随着浸提液浓度上升,细胞数量及RGR在不断的减小。在培养第三天TH组的RGR较CK组和CO组高,其原因可能是TH组细胞较其他两组更早的进入了指数生长期,在第三天这个观察点时TH组细胞已经比其他两组进行了更多次数的分裂,造成在第三天时TH组细胞数量是最多的;而在培养第五天时CO组和TH组的RGR又较CK组低,其中CO组与CK组差异具有统计学意义则说明在稳定期时CO和TH组的细胞数量仍较CK组少,而CO组显著小于CK组,这主要还是因为树脂浸提液对稳定期的细胞总数量造成了一定的影响,但树脂浸提液对细胞增殖的影响是短期且非致命的,培养时间延长后细胞通过自身调节可以消除浸提液对细胞增殖带来的部分不利影响。
综上所述,本研究可以得到以下结论:树脂浸提液的确会造成一定的细胞毒性,但这种细胞毒性是短期、可控的,可以通过细胞的自身调节来消除,并没有造成细胞凋亡等严重的后果;CO组与TH组在ROS水平,细胞周期,细胞凋亡以及细胞增殖速率中均无明显差异,TMHDB单体的添加并没有增加树脂的细胞毒性。

