澳大利亚农药原药审批化学资料要求和审查要点
申继忠
(上海艾农国际贸易有限公司,上海 200122)
根据澳大利亚APVMA(澳大利亚农药和兽药管理局)有关规定,现将原药审批需要提交的数据和信息以及审查要点分述于下。
1 使用说明
APVMA据此对原药持有人的使用说明进行评估。确定所提交申请的活性成分是用于农药和/或兽药化学品的活性成分。
2 制造商的名称和地址
APVMA据此审查原药制造商的名称和地址(法规依据:Regulations 15(1)(e) and (f),and 17C(1) item 2 and item 3),以确定:⑴ 所述的制造商名称和地址对于所评估的原药是否正确;⑵ 所述的制造商名称和地址是实际的生产设施地址,而不仅仅是邮政地址;⑶ 生产厂址是否包括原药的实际生产,在指定的地点是否进行了重大的化学转化,放行前对批次进行最终质量控制测试的实验室,或放行原药供应的仓库,不能被视为原药的制造商。
3 通用名称
APVMA需要明确如下问题:⑴ 对所有活性成分,在医药和毒物统一调度标准(SUSMP)中是否有相关条目,活性成分名称是否与SUSMP提供的相称(在某些情形下SUSMP提供一个笼统的类目,而不是一个特定的活性成分名称);⑵ 仅对农药活性成分而言,声明的通用名称是否与澳大利亚农药通用名称标准一致,或与国际标准化组织(ISO)颁布的农药通用名称一致,或与FAO和WHO的国际农药标准联席会议(JMPS)发布的标准中的通用名称一致。
有时需要考虑如何定义活性成分。如某些合成的化合物混合物(如生物烯丙菊酯)或从天然来源提取的化合物(如除虫菊提取物),外消旋混合物(如烯虫酯)或以异构体为主的(如精异丙甲草胺)活性物质都需要准确定义其活性成分。
4 化学名称
无论对农药或兽药,APVMA都要求明确:⑴是否有IUPAC化学名称;⑵ IUPAC化学名称是否正确;⑶ 如果没有IUPAC化学名称,那么是否有关于该成分的如下信息(按顺序说明):①在Agvet Code第7部分(Section 7)中的标准;②在Agvet Code第6E部分(Section 6E)中的标准;③对兽药,是否有如下标准(按顺序):英国药典(British Pharmacopoeia),或英国药典(兽药),或欧洲药典或美国药典;④对农药,是否有FAO/WHO农药标准联席会议发布的农药标准;⑤对农药,是否有APVMA标准;⑥是否有CAS化学名称,CAS名称可作为IUPAC名称的补充。
5 分子量和分子式
APVMA需要确认分子式和分子量与活性成分的化学结构一致,尤其是对新化合物(之前未在澳大利亚批准的),此项更重要。
6 化学结构
APVMA需要确认化学结构与活性成分一致,尤其是对新化合物,此项更重要。
7 化学结构解析
APVMA对农药和兽药活性成分的结构解析信息(如红外光谱、质谱或核磁共振谱)均进行评估:光谱数据是否能确证所提出的活性成分化学结构。
这些信息也作为生成新活性成分数据档案的一部分。新的活性成分还可能需要更多的数据。对于现有的活性成分,这些信息应该随时可得。
8 理化性质
APVMA评估新的农药和兽药活性成分的以下物理化学特性:⑴ 活性成分是原药(TC)或者母药(TK),母药也通常被称为生产浓缩物(为了稳定性或易于处理,活性物质可以用合适的溶剂或固体稀释剂稀释);⑵是否采用适当的方法测试并提供了活性成分的相关物理和化学性质数据(如外观、手性、多态性、熔点/沸点、溶解性、分配系数、蒸汽压、水解、酸解离常数pKa),安全性质数据(如闪点、自动点火温度、热分解、氧化、腐蚀、或爆炸性能);⑶活性成分是否为纳米材料(有意设计成在1个或多个维度上尺寸在1~100 nm的材料);⑷ 是否有已发表的分析测试方法[如OPPTS (新名称:OCSPP,即Office of Chemical Safety and Pollution Prevention)、OECD、JMAFF、CIPAC、药典等]或提供验证数据以支持不同的(新的)分析方法。如果对已发布的方法有改动,也需要提供一些验证数据。
APVMA力求确保准确地报告活性成分的相关物理和化学特性,以便在对活性成分的其他评估中可以依赖这些特性。
理化性质数据的用途很多。如活性成分正辛醇-水的分配系数(Log Kow)是3.5,说明此物质有脂溶性。LogKow可作为一种筛选指标,决定是否需要进行额外的试验(如进行额外的环境研究,或修改动物产品MRL值)以满足安全、药效和贸易标准要求。
9 稳定性
APVMA评估了新的活性成分的稳定性,包括农药和兽药活性成分。要求的具体细节:⑴ 稳定性研究的条件是否有报告(如贮藏温度、湿度、包装材料),在实际贮藏的可能条件下,这些条件是否合适。⑵ 单个批次原药的稳定性结果。理想情况下,对于兽药活性成分,按照VICH GL3进行至少3批至少小规模的试验。对于农药活性成分,应按照APVMA指南提供至少一批的检测。也可以提供有效的科学证明,以证明有理由提供更少批次的结果,或证明不需要提供稳定性数据。⑶ 建议的包装材料对活性成分稳定性的影响。可以提供适当的科学论据,说明包装是惰性的,不太可能与活性物质发生反应。⑷ 存储中活性成分的含量是否有显著变化(通常为大于5%)。如果大于5%,是否可以接受。⑸ 储存前后的结果是否仍然符合成分声明(DoC)或活性成分标准。如果不符合,提供适当的理由。⑹ 储存后相关杂质或毒理杂质是否有显著增加(对于农药活性成分,含有活性成分的化学产品是否有可能被归类为日期受控的)。从安全角度看,这些增加是否可以接受。⑺ 储存过程中是否产生了新的杂质(如降解产物)。从安全角度看,这些新杂质是否可接受。⑻ 活性组分的光稳定性是否已确定。如果没有确定,理由是什么。⑼ 活性成分对外界因素(酸、碱、氧化、还原、光、热、接触金属或金属盐)的稳定性是否已确定。如果没有,提供适当的理由。⑽ 如果相关,活性成分的纳米特性在储存后是否受到影响。⑾ 在正常存储条件或申请人指定的替代条件下,稳定性数据是否足以得出活性成分在(或将在)两年的复测期间内保持稳定的结论。如果没有,提供适当的理由。
制造商有责任确保产品的所有组分在用于制造制剂产品时都在有效期内,并保证使用这些材料生产的制剂产品在其产品的保质期内始终符合其预期用途(即满足药效要求)。
对于已批准的活性成分的新来源,通常不需要进行存储稳定性测试,因为在活性成分初始批准时已建立了稳定性数据。
10 制造方法
APVMA需要评估农药或兽药新活性物质的生产方法。大多数已经获得批准的农药活性物质的新来源(或新的生产地点),或非药典的兽药活性物质通常也需要生产过程信息。对于按照认可的药典标准(并符合兽药注册技术国际协会VICH GL18残留溶剂限制)生产的已获登记的兽药活性物的新来源,通常不需要生产过程信息。如果认定有必要确定该活性物质是否满足安全标准,APVMA将要求有关该药典活性物质新来源的制造过程的信息。
关于制造的如下信息是完整评审所需要的:
⑴ 生产工艺描述、反应方案和流程图是否准确地描述了化学反应的顺序,所有的反应和纯化步骤、起始原料和催化剂的数量、反应温度和压力、pH是不是指向所申请的活性成分。⑵ 如果活性成分是单一立体异构体或是一个或多个异构体的富集,异构体在生产过程中是否有反转的可能。⑶ 商业化生产的批次大小(如kg/d,可以是一个范围)是多少。⑷ 在生产过程描述中,是否存在任何潜在的污染物或有毒的重要化学品(如重金属催化剂或硫酸二甲酯)。⑸在生产过程中是否有一个或多个净化步骤(如重结晶)。这些步骤是否会引入潜在的杂质(如溶剂)。⑹如果相关,是否有意将任何组分添加到活性组分中(如添加溶剂获得母药,或加入抗氧化剂作为稳定剂)。⑺ 针对某些兽药活性成分,活性成分是否灭菌,如果有,用什么方法,它是否适合该目的。⑻ 是否有返工步骤,它是否对活性成分的质量有潜在的负面影响。⑼ 在制造过程中是否有赋予活性成分纳米特性的步骤。
APVMA评估这些信息的目的是确保制造商能够使制造过程处于控制之中,并且能够制造出一致的和可接受质量的产品。
如果已知具有毒理学重要意义的化合物(如氰化物盐、硫酸二甲酯或重金属催化剂)在生产过程中被用作试剂、溶剂或催化剂,除了在批次分析中测试这些化合物作为杂质的水平之外,还可能需要提供在生产过程中采取的最大限度减少最终产品中这些化合物残余水平的详细措施。
申请活性成分的批准始终需要提供包含DoC或规格的数据,以便对存在的任何杂质的数量、类型和批次间的一致性进行评估,以确定活性成分的质量。
对制造过程进行评估,以确保所述步骤能够制造出符合成分声明(DoC)的活性物质,即保证活性成分含量最高、异构成分(如适用)和杂质的含量水平最低。这有助于确定活性物质的安全标准,进而确定使用该活性物质制造的制剂产品的安全性和有效性达到标准要求。作为评估的一部分,评估者必须考虑在申请人提出的合成过程中使用的原材料和形成的任何中间体的性质和毒性,以及该过程是否充分控制了任何可能产生的杂质的水平。
例如,二噁英是在高温或高pH过程中为制造某些有机氯农药而可能形成的有毒杂质。化学评估员需要检查建议的合成途径和条件,以确定是否有产生二噁英的风险,是否有适当的控制或净化步骤,以减少最终活性成分中存在二噁英的风险。
11 质量控制
当考虑生产某个活性成分的制造过程时,APVMA需要评估质量控制手段。
农药和兽药有效成分的制造:⑴ 是否有原料规格。是否有可能通过任何原材料将毒性显著的杂质引入到原药中。此处的原料规格是指生产活性成分的合成过程中使用的前体化学品的验收标准。前体的纯度直接影响活性成分的纯度和组成。⑵ 对任何分离的中间体是否有适当的质量控制。⑶ 在生产过程中是否有需要特定控制的关键步骤,是否有适当的措施来提供这种特定控制(如将温度或pH保持在一定范围内)。
APVMA评估这些信息的目的是确保在生产过程中使用的有效成分的质量控制措施适合于持续生产除可接受质量的有效成分的目的。
12 杂 质
APVMA需要评价农药和兽药原药的杂质:⑴杂质的绝对含量(如g/kg)或相对于活性成分的百分比(w/w)是多少。⑵ 杂质中是否有其他活性成分(如莠去津中的西玛津)。⑶ 活性成分是否有异构体(杂质)。⑷ 对杂质的可能来源(如未反应的起始原料或中间产物,反应副产物)是否进行了讨论,这些讨论是否令人信服。
以上都与制造过程产生的杂质评估相关的一般问题。此外,还要关注重要杂质,是否所确定和定量的杂质都超过了1 g/kg(0.1%w/w)。
特别重要的是毒理学重要杂质(相关杂质):⑴活性成分中是否存在任何具有毒理学和/或生态毒理学意义方面的相关杂质,包括小于1 g/kg的含量。具有重要毒理学意义的相关杂质名单在APVMA网站有公布,也可参考APVMA的相关标准或药典专著。⑵ 在生产过程中是否有任何已知具有毒理学问题的化合物(如硫酸二甲酯)被用作试剂、溶剂或催化剂。⑶ 毒理学和/或生态毒理学上重要的杂质是已知的还是新的。如果是新的,活性成分的毒理学评估允许的最大限度是多少。
重要杂质(相关杂质)举例:某些有机磷农药(如二嗪磷、马拉硫磷)可能含有与活性成分不同的毒性大得多的杂质,或与活性成分具有不同的毒理学终点。
对于一种新的活性物质,任何毒理学上显著的杂质都将以适当的最大限量包含在APVMA标准中。
随后批准的活性成分的新来源必须符合APVMA标准,包括任何毒理上显著杂质的最高含量。
关于原药组成和活性成分纯度的说明:
纯度:活性成分的含量,以百分比或g/kg或g/L表示。纯度可以按照所提供的原药为基础表示,也可以通过修正来表示(如以干重为基础)。
组成:活性成分中存在的有关杂质的性质和数量。这些杂质可能是在制造过程中没有充分反应的起始物质,在制造过程中发生的化学副反应的产物,或者起始物质中存在的杂质。
当新的活性成分或现有活性成分的新的来源获得批准时,根据提供的批次分析数据对DoC或规格进行评估。DoC或规格也可与任何相关标准进行比较(如APVMA标准和/或FAO/WHO农药规格联席会议JMPS的农药活性成分规格,或兽医活性成分药典)。一旦一种活性物质的新生产地点被批准,该活性物质的组成(DoC)或规格就会记录在案。
需要注意的是,活性成分必须在任何时候都符合相关标准和对该活性来源进行评估时批准的组成细节。
13 组分声明(DoC)或规格
APVMA评估农药和兽药的原药组成或规格。
对农药,需要明确:⑴ 是否有FAO/WHO活性成分规格。建议的规格是否与FAO/WHO规格一致。⑵ 是否规定了活性成分的最低纯度。⑶ 相关时,是否规定了异构体组成(如S/R异构体比例)。⑷ 如果活性成分是一种母药,其纯度是否以干重为基础并符合APVMA标准,或是否提供了适当的理由。⑸ 批次分析中所有有关/重要杂质的最大含量为1 g/kg (0.1%,w/w)或更高。⑹ 活性成分是否符合或解决上述一般要求中的相关问题。
有效成分规格的一般要求:⑴ 是否缺少任何行政类型的详细信息(如制造商名称和工厂地址、活性成分通用名称、批准人的签名和日期)。⑵ 是否有适当的化学品名称(如果相关的话,包括公司的产品代码)、CAS注册号码。
14 批次分析
APVMA评估农药原药的批次分析。
如果某个特定的信息没有被提供或某个标准未被满足,APVMA则考虑申请人是否提供了一个适当的理由或科学论据。
农药活性成分:是否提供了至少5个批次的最近生产和分析的商业规模的有效成分分析结果(分析日期在申请日期前5年之内)。这是为了确保批次分析结果与将提供的活性成分的组成和纯度相关。如果部分或全部批次分析的历史超过5年,将给予适当的理由。
如果没有商业批次的分析数据,中试批次分析所用样品是否与商业规模批次生产工艺相同。
计算的质量平衡是否为98%~102%。
有效成分是否符合或解决下面“一般要求”中的相关要点。
一般要求:⑴ 批次分析所用样品是否来自拟申请的生产场地。⑵ 是否包括生产批号、生产日期和分析日期的详细信息。Agvet法典要求申请人在法定期限内保留批次信息文件,包括在上面两个项目中列出的细节。⑶ 批量大小是否与拟申请的制造工艺规模一致。⑷ 活性成分含量是否符合建议的成分声明(DoC)或规格。⑸ 在相关的情况下,异构体的组成是否符合要求。⑹ 所有相关的/重要的杂质限量是否都合规。⑺ 是否所有毒理学意义的杂质/相关杂质都合规。⑻ 如果产品组成声明(DoC)/规格不合规,是否提供了有效的科学理由和/或提供了其他数据予以说明。
APVMA评估这些信息的目的是确保指定的制造商能够制造出始终如一的符合DoC/规格和任何其他标准的活性成分。这有助于确定活性成分是否满足安全标准,以及使用活性物质的产品是否满足安全和有效性标准。
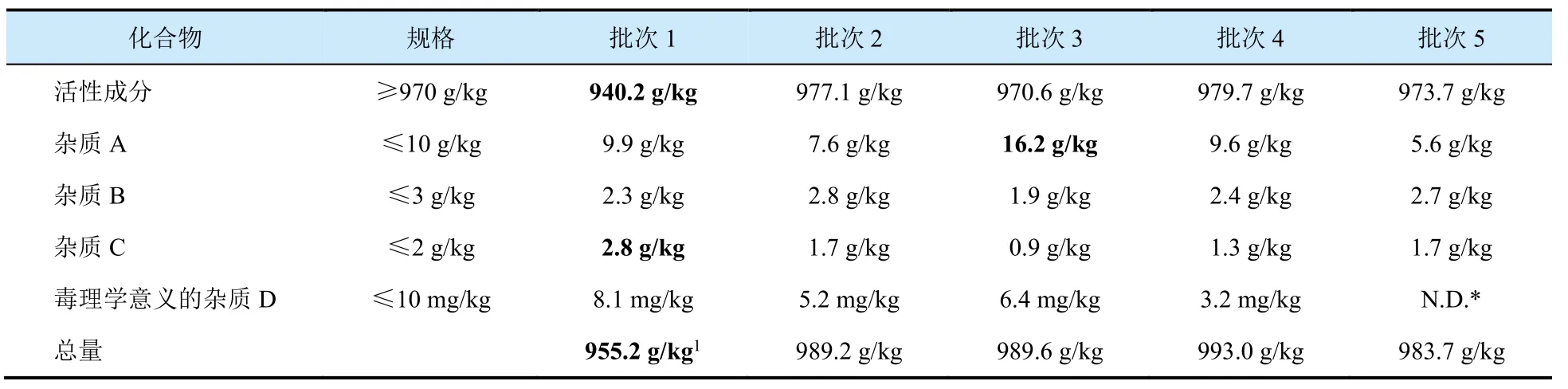
表1 活性成分批次分析数据摘要信息
15 分析方法及验证
APVMA需要评估有效成分的分析方法和验证数据。若缺乏特定信息或分析方法不能满足APVMA标准要求,可能要求申请人提交一个适当的理由或科学依据。
测定活性成分纯度的分析方法是否是已发布的“监管方法”(如CIPAC、AOAC和药典方法)。如果测定活性成分纯度的分析方法不是公开的“监管方法”,是否提供了方法的完整细节和相关验证数据。
对色谱方法(如高效液相色谱、气相色谱)或非色谱方法(如定量核磁qNMR、原子吸收分光光度法AAS),所提交的验证数据是否按照APVMA有关指南充分验证了活性成分分析方法的选择性、线性、范围和精密度(如果基质效应可能是一个影响因素的话,还包括准确度,如母药的情形)。对毒理意义的重要杂质再加上准确度和检测限(LoD)和定量限(LoQ)。
对于结构上与活性物质相关但是未被指定为有毒理学意义的杂质,通常认为在很多情况下无法获得参考标样。对这些杂质的定量有时可以通过与活性成分相关的面积归一化方法来实现。
活性成分的纯度是如何定量的(如外标法或内标法),它是否符合分析目的。如果相关,是否提供了活性成分的空白、标样和样品色谱图和/或光谱图,以证明没有干扰峰/信号。测定活性成分纯度的分析方法是否也用于测定杂质的含量(包括具有毒理意义的杂质),是否能够满足杂质的检测和定量要求。如果没有,是否提供了一种或多种独立的分析方法来检测和定量杂质。
杂质(包括具有毒理学意义的杂质)是如何定量的(例如有或无修正因子的外标法,面积归一化法)。对具有毒理学意义的重要杂质,所提交的验证数据是否能充分证明方法的选择性、线性、精密度、准确度、检测限(LoD)和定量限(LoQ)。
如果相关,分析活性组分纳米特性的分析方法是否有详细验证数据。如果相关,是否提供了分析方法转移(借用)研究的细节和验证。
APVMA评估这些信息的目的是确保分析方法适用于目的,以便制造商使用的分析结果可以被认为是可靠的。
对于原药组成和有效成分含量解释如下:纯度是活性物质的含量,以百分比(%)或g/kg或g/L表示。纯度可按所提供的原药为基准表示,或经修正(如按干重)。组成:活性成分中存在的相关杂质的性质和数量。这些杂质可能在制造过程中没有完全反应的原料,在制造过程中由化学副反应的产物产生的杂质,或者是原料中存在的杂质。
当新的活性成分或现有活性物质的新的来源获得批准时,基于提供的批次分析数据对DoC或规格进行评估。DoC或规格也与其他任何相关标准(例如APVMA标准和/或FAO/WHO关于农药规格的联席会议标准,或兽药药典标准)进行比较。新来源的活性物质一旦被批准,该活性物质的组成(DoC)或规格则被存入档案。
16 包 装
APVMA需要评估活性成分的包装。与活性成分接触的容器的尺寸和详细的材料组成是否有详细规定。是否使用了其他的辅助包装材料(secondary-type packaging material)。
17 APVMA要求提供分析参考标样
APVMA一般要求下列新的农药或兽药化学成分的分析参考标准提交给国家分析参考实验室(隶属于国家测量研究所NMI):⑴ 1 g纯活性组分的分析参考标准,或活性成分的同分异构体的混合物,同分异构体可以分开,每个异构体分别提供1 g的参考标准;⑵ 100 g原药样品(即用于产品制造的活性成分,必须指定百分含量);⑶ 对活性成分中存在的(如果有的话)的每一种有毒理学意义的制造杂质提供10 mg的分析参考标准;⑷ 为满足(强制执行)最大残留限量要求,对残留物定义中包含的活性物质的每个代谢物需要提交100 mg的分析参考标准。
APVMA已经建立了一个相当可观的由NMI存储的参考标样库。这些标准物质通常被国家残留物调查(NRS)用于分析食品样品中的农药或兽药残留物,特别是在商业上可能没有参考标准可购的情况下。
该参考资料库的维护有助于国家农药和兽药化学品注册制度的有效运行,并最终通过确保符合澳大利亚和海外MRLs要求来支持澳大利亚农产品的出口。
这里对分析标准材料的要求数量只是一个指南,在某些情况下,更少量的材料也是可以接受的。
在某些情况下,不需要提供参考标准,但可以提供有效的论据,例如如下情形,不需要提供分析参考标准:⑴ 微生物活性成分;⑵ (目前或将来不可能)在粮食作物或动物上使用的产品;⑶ 如果没有推荐或要求MRLs;⑷ 如果通常不使用活性成分标准对活性成分进行分析,或使用商业上广泛可获得的标准对活性成分进行分析的。
18 APVMA活性成分标准
农业化学品的标准通常规定有效成分的最低纯度、相关的异构体组成,以及相关杂质的最大含量,包括毒理学意义的重要杂质。活性成分的毒理学特征直接与它的纯度和毒性有关杂质相关。在可能的情况下,APVMA试图使其标准与FAO/WHO农药规格联席会议(JMPS)发表的农药规格保持一致。
19 非规定条件
根据农药兽药法第23(1)(b)条,APVMA可以在适当的情况下对活性成分的批准施加额外条件。
APVMA施加额外条件的目的是为了力求确保拟批准活性成分的安全性得到满足。可能的额外条件包括要求原材料从特定的制造商采购,或生产达到某个特定的规格的活性成分。

