儿童髓鞘少突胶质细胞糖蛋白抗体相关脱髓鞘病57 例临床特征及预后分析
孙 红 谭建敏 刘静临 李紫妍 蒋 艳 袁 萍 马建南 吴 鹏 钟 敏 罗媛媛 蒋 莉 李秀娟
重庆医科大学附属儿童医院神经内科 儿童发育疾病研究教育部重点实验室 国家儿童健康与疾病临床医学研究中心 儿童发育重大疾病国家国际科技合作基地 认知发育与学习记忆障碍转化医学重庆市重点实验室 儿科学重庆市重点实验室(重庆 400014))
髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)是少突胶质细胞膜蛋白表面的一种糖蛋白,存在于中枢神经系统髓鞘最外层,目前功能未完全明确,可能因其高度免疫原性在中枢神经系统中成为自身免疫抗体和细胞免疫反应的靶点而起作用[1]。近年来,MOG 抗体相关脱髓鞘病不断被报道,并有多种命名,如MOG抗体病、MOG谱系障碍、MOG脑脊髓炎等。目前认为,MOG抗体相关脱髓鞘病在儿童期主要以急性播散性脑脊髓炎(acute disseminated encephalomyelitis,ADEM)最为常见,成人则以视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorder,NMOSD)[2]、视神经炎(optic neuritis,ON)多见。儿童MOG抗体相关脱髓鞘病多见,有报道在儿童急性脱髓鞘综合征中有1/3 的患儿存在MOG 抗体阳性[3]。目前对儿童MOG 抗体相关脱髓鞘病的临床特点及预后仍在不断研究中。本文通过对57 例18 岁以下MOG抗体阳性相关脱髓鞘病患儿的临床资料的回顾,分析其临床特征和预后,并探讨复发危险因素,进而提高对儿童MOG抗体相关脱髓鞘病的认识。
1 对象与方法
1.1 研究对象
回顾性分析2014 年1 月至2019 年10 月,于重庆医科大学附属儿童医院神经内科住院治疗的中枢神经系统脱髓鞘病患儿的临床资料。研究对象入选标准:①年龄<18岁;② 临床诊断为中枢神经系统脱髓鞘疾病中任意一种,如ADEM、多发性硬化(multiple sclerosis,MS)、NMOSD、ON、横贯性脊髓炎(transverse myelitis,TM)、临床孤立综合征(clinical isolated syndrome,CIS)等;③血清MOG抗体阳性;④临床资料完整。
根据临床表型将纳入病例分为ADEM组、NMOSD组、CIS组、ON组及尚未能分类者组。并根据其随访的结果,将随访病例分为复发组、未复发组。
1.2 方法
1.2.1 临床资料收集 回顾性收集患儿初次发生中枢神经系统脱髓鞘事件的临床资料,包括患儿的一般情况、临床表现、辅助检查、治疗情况等。并随访患儿急性期后治疗情况、临床表现、影像学表现、血清MOG抗体滴度及复发情况。
1.2.2 MOC抗体测定 患儿血液和/或脑脊液样本均送至重庆金域医学检验所采用基于细胞的间接免疫荧光法(cell-based assays,CBA)检测MOG抗体。
1.2.3 MOG抗体相关脱髓鞘病的临床表型诊断 以2012 年版国际儿童多发性硬化研究小组(IPMSSG)修订标准的ADEM[4]、2015年版NMOSD国际共识[5]、ON[4,6]、TM以及其他未能分类疾病。
1.2.4 随访及预后判断 通过专病门诊进行随访,末次随访截止时间为2019 年10 月31 日。对其中随访6个月以上的患儿进行预后分析。其中从首次发作开始超过30 天或在诊断ADEM 的情况下超过90 天的临床发作或新的MRI病变视为疾病新的活动证据[7],即为复发。随访时采用扩展残疾状态量表(expanded disablelity status scale,EDSS)对其急性期及治疗后好转期、后期进行评分以评估患儿病情严重程度及恢复情况。
1.3 统计学分析
采用SPSS 23.0统计软件进行数据分析处理。符合正态分布的计量资料以均数±标准差表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;两组间比较采用两独立样本t检验。非正态分布计量资料以中位数(四分位数范围)表示,组间比较采用秩和检验。计数资料采用例数(百分比)表示,组间比较采用χ2检验或Fisher 精确概率法检验;多组间两两比较采用Bonferroni法,根据实际情况校正检验水准。相关性分析采用Spearman秩相关进行检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况及临床特征
符合纳入标准的MOG 抗体相关脱髓鞘病57 例,男28例、女29例;中位起病年龄7.3(5.2~10.5)岁(1 岁7 月龄至15 岁3 月龄)。35 例(61.4%)起病两周内有前驱事件,其中前驱感染34例,疫苗接种者1例。主要以发热(20例,35.1%)、头晕头痛(10例,17.5%)、视力障碍(8例,14.0%)症状起病。见表1。所有患儿急性期中位EDSS评分为3.0(1.8~4.5)。
57例患儿中,ADEM 28例、NMOSD 14例、ON 5例,MOG抗体与抗NMDAR抗体同时阳性的患儿5例,另有5 例(8.8%)尚不能明确分类。各临床表型之间临床特征的比较见表1。
所有患儿均在急性期行腰椎穿刺术,32例(56.1%)患儿急性期有核细胞数量增多(16~420)×106/L,中位数73(23.5~139)×106/L,其中68.8%以单核细胞增多为主。22例(38.6%)蛋白水平稍增高(0.46~2.81)g/L,中位数0.59(0.51~0.72)g/L,所有患儿糖和氯化物均正常。
49例患儿在首次发作时即行血清MOG抗体检测,48 例阳性,血清MOG 抗体滴度1:10~1:320,其中1 例患儿首次发作时血清MOG抗体为阴性,复发时血清MOG 抗体滴度阳性。另外8 例患儿首次脱髓鞘事件发作时未行MOG抗体检测,复发时发现血清MOG抗体阳性。49例患儿中,47例患儿同时行脑脊液MOG抗体检测,仅33 例示阳性,脑脊液MOG 抗体阳性患儿滴度1:1~1:320。将同一患者血清与脑脊液MOG抗体滴度对比发现,脑脊液MOG 抗体滴度低于血清MOG抗体滴度(Z=2.06,P=0.039)。且所有患儿血清和脑脊液水通道蛋白-4(aquaporin-4,AQP-4)、髓鞘碱性蛋白(myelin basic protein,MBP)抗体均为阴性。7例患儿因有明显认知损害及意识内容障碍行自身免疫性脑炎抗体检测,其中5 例患儿脑脊液抗NMDAR阳性。
57例患儿均在急性期完善头颅MRI,其中5例患儿于外院行头颅MRI,无法溯源分析,故仅对52例患儿进行统计分析。其中50 例(96.2%)患儿有明确颅内病灶,双侧受累者(35例)占67.3%。病灶主要表现为多发片状或斑片状长/稍长T1及长/稍长T2信号,T 2 Flair 高/稍高信号影,见图1。以大脑白质受累最常见,其次基底节、丘脑、脑干受累较为多见,小脑、皮层灰质、海马等颅内病灶相对少见。
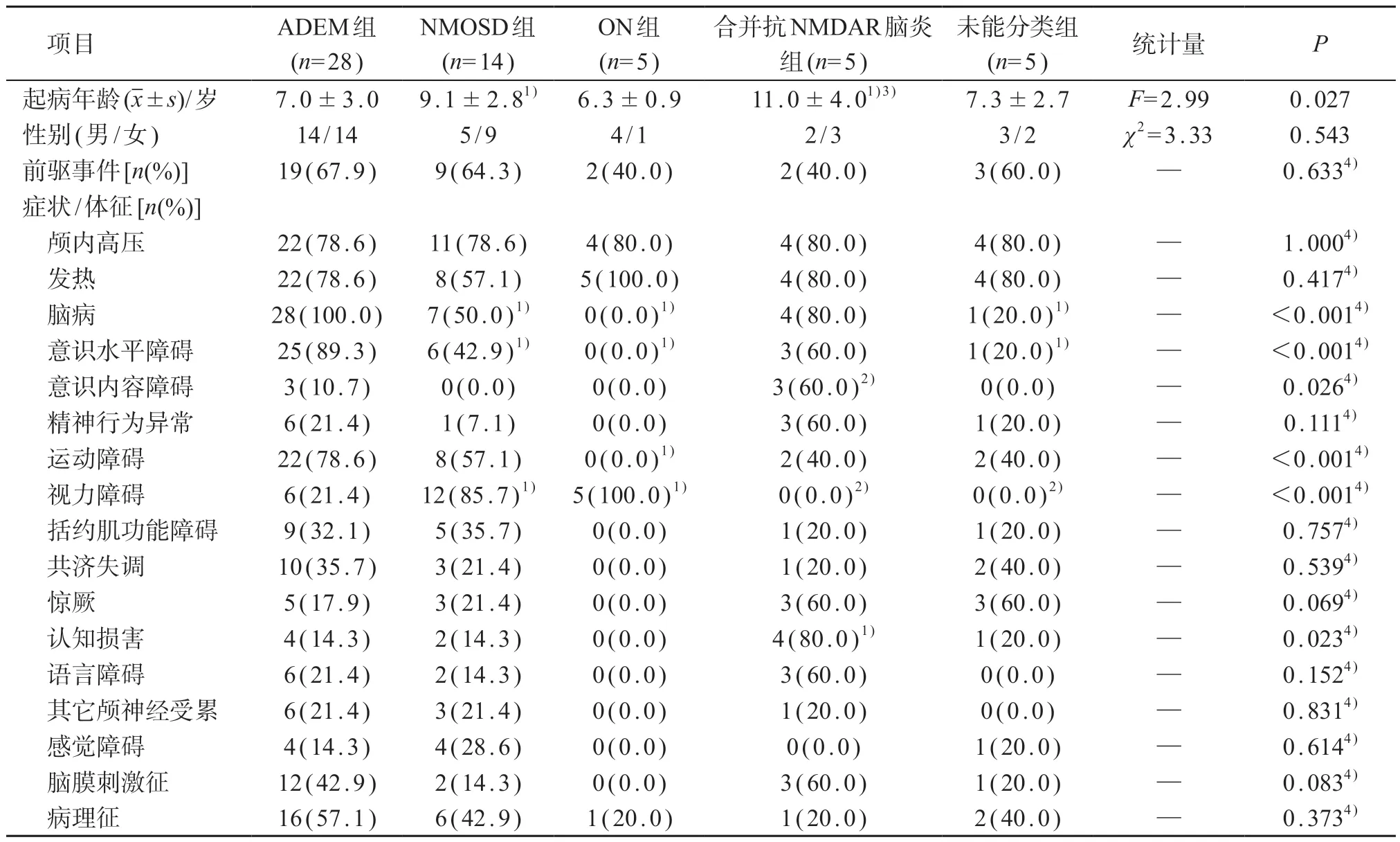
表1 各临床表型MOG抗体相关脱髓鞘病患儿临床特征比较[n(%)]
16 例患儿完善视神经MRI,提示视神经增粗或信号改变12 例(75.0%),其中8 例有视力障碍的临床表现。视神经受累的12 例患儿中,视交叉受累6 例(50.0%)。37例患儿行脊髓MRI,11例(29.7%)见脊髓病灶(均有脊髓受累临床表现),均为长节段受累(图1);26 例未见明显异常(其中14 例有脊髓受累临床症状)。
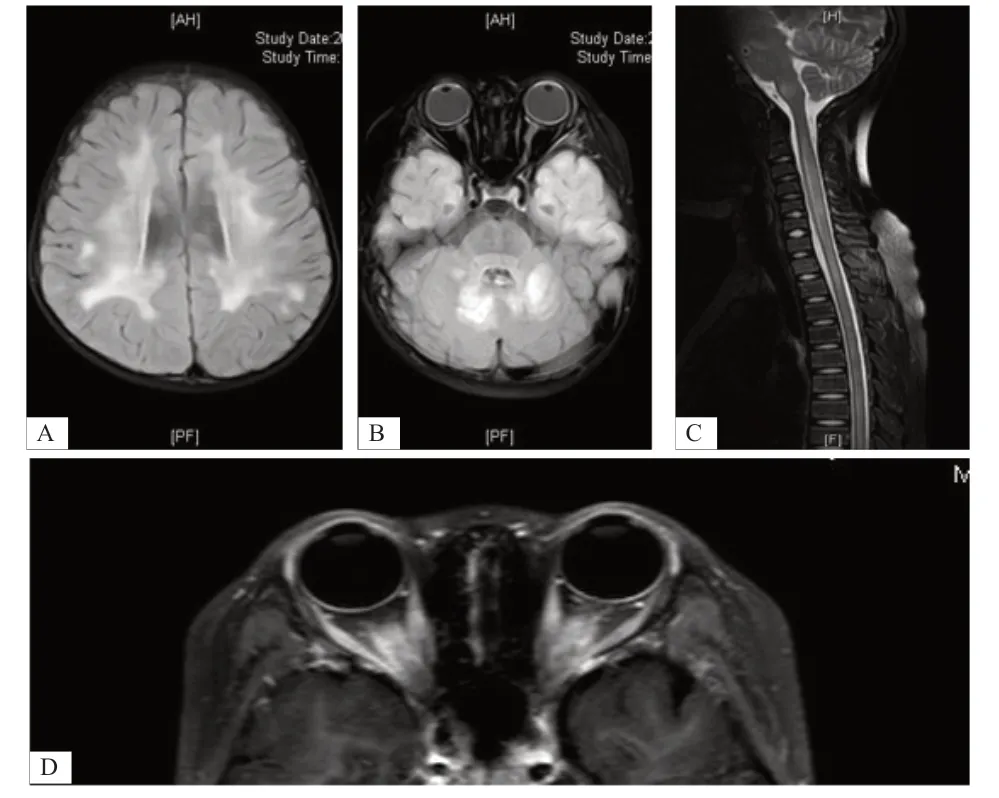
图1 MOG 抗体相关脱髓鞘病患儿MRI 图像
2.2 治疗及预后
在患儿首次发病急性期主要以大剂量糖皮质激素(甲基泼尼松龙,每日10~20 mg/kg)和/或静脉注射免疫球蛋白(IVIG,1~2 g/kg)冲击治疗,其中两者联合治疗患儿40例(70.2%),单用激素冲击治疗者9例(15.8%),单IVIG治疗者6例(10.5%)。1例(1.8%)患儿在使用糖皮质激素与IVIG治疗后疗效欠佳,添加二线免疫抑制剂利妥昔单抗联合治疗。52.6%的患儿在起病2周内使用激素冲击治疗或IVIG。所有患儿中位住院时间为15.0(10.5~19)天,经治疗后病情均好转,治疗后出院时中位EDSS评分0.0(0.0~2.0),较急性期显著降低(Z=5.79,P<0.001)。出院继续予以泼尼松(每日1~2mg/kg)口服治疗15~30天,并根据临床、影像学恢复和MOG 抗体滴度情况逐渐减量至停用,总疗程至少6个月。
57 例患儿中随访时间超过6 个月者29 例,未满6个月者25例,失访者3例,无死亡病例。对随访满6个月的患儿进行预后分析,随访中位时间为12(9~19.5)月。其中14 例患儿有复发,复发时间在初次起病后5.5(3.0~7.3)月,复发次数1~3次,复发患儿平均起病年龄为(6.9±2.8)岁,男女比例1:0.8,年复发率(annualized relapse rate,ARR)中位数为0.0(0.0~0.9)。未复发患儿15 例,平均起病年龄(7.5±2.6)岁,男女比例1:1.5,与复发患儿相比较,起病年龄(t=0.52,P=0.606)、男女比例(P=0.466)差异无统计学意义。14 例复发患儿中,7 例复发诊断为NMOSD,3 例为ADEM-ON,4例为MDEM。
对复发患儿和未复发患儿首次发作时临床表型和临床特征进行对比分析发现,复发患儿较未复发患儿急性期更容易出现发热,且急性期IVIG或大剂量激素冲击治疗时间距首次起病超过2周患儿更容易出现复发,差异均有统计学意义(P<0.05)。见表2。复发患儿中位随访时间为18.0(13.0~39.5)月,未复发患儿为10.0(7.0~12.0)月,差异有统计学意义(Z=2.86,P=0.004)。
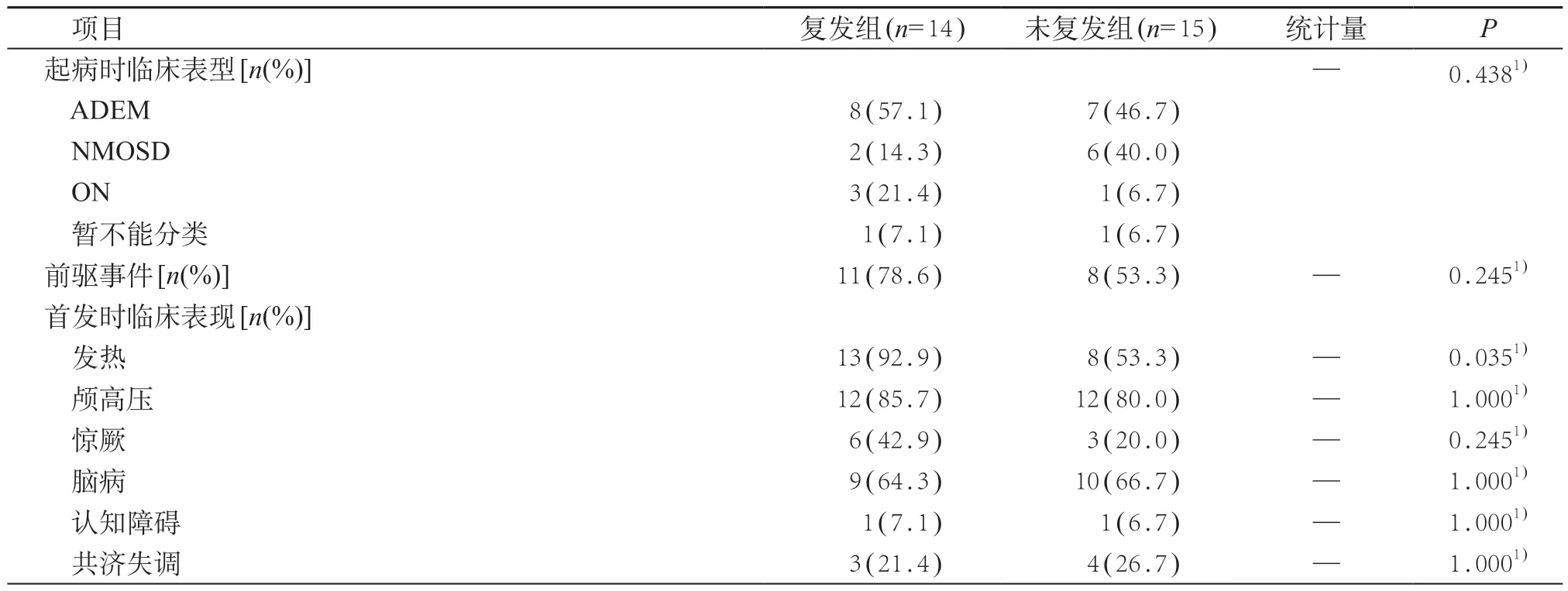
表2 29例随访超过6个月的复发、未复发患儿临床特征比较

续表(2)
2.3 MOG抗体与疾病严重程度及预后的相关性分析
急性期MOG抗体滴度范围为1:10~1:320,急性期EDSS评分为3.0(1.8~4.5),两者之间相关性无统计学意义(r=-0.24,P=0.097)。
随访的14 例复发患儿中,8 例首次发作时未行MOG抗体检测,故无法准确分析血清MOG抗体滴度是否在复发患儿和未复发患儿中具有差异。但在随访过程中发现3例患儿经治疗后血清MOG抗体有转阴,其中2 例患儿在MOG 抗体转阴后的继续随访过程中检测出血清MOG抗体再次转为阳性,并且1例伴有新的临床发作或出现新的MRI 病变。另外,4 例患儿在出现新的临床发作或新的MRI 病变时,MOG 抗体滴度较上次随访时升高。但同时也发现9例患儿随访中MOG 抗体滴度较前明显增高时,临床和影像学上并没有新的疾病活动的证据;并且还有2例患儿在MOG抗体滴度降低时,出现临床发作和/或影像学证据表明患儿疾病复发。
3 讨论
57 例MOG 抗体相关脱髓鞘病患儿中,起病年龄7.3(5.2~10.5)岁,男女比例1:1.04,与既往研究相似[8-10],且无明显性别趋势。61.4%的患儿在起病前有上呼吸道感染表现,1例患儿起病前有疫苗接种。本研究发现,发热是儿童MOG 抗体相关脱髓鞘病病程中最常见的临床症状之一,75.4%的患儿有发热,尤其是其中6 例患儿起病较隐匿,主要以不明原因反复发热不伴或仅伴神萎至少持续2周后才出现明显神经系统症状,最后影像学异常,并发现其血清MOG抗体为阳性。这和成人MOG 抗体相关脱髓鞘病多以神经功能障碍起病不同,提示在临床工作中,排除其他可能病因的不明原因反复发热伴神萎儿童,需警惕该病可能,可检测血清MOG抗体和头颅MRI检查,以帮助其早期诊断和治疗。
MOG 抗体相关脱髓鞘病临床表型多样且部分重叠[3]。在本研究中也发现57 例患儿中临床表型以ADEM 最为常见,其次为NMOSD,且ADEM 患儿较NMOSD 患儿更年幼,这和既往研究得到的结论相似[3,11]。小年龄且明显具有脑病症状的患儿要高度警惕MOG 抗体阳性的ADEM,而对大年龄以视力障碍为主要表现的患儿,要高度警惕MOG 抗体阳性的NMOSD或ON。本研究中还包含了5例MOG抗体合并抗NMDAR 阳性患儿,与其他单纯MOG 抗体阳性患儿相比,他们的认知损害及意识内容障碍更为突出。最近的一项研究显示大约有11.9%的MOG抗体阳性患儿合并抗NMDAR 脑炎,其与单纯的MOG 抗体相关脱髓鞘疾病不同的是,合并抗NMDAR 脑炎患儿存在明显脑炎相关症状,尤以精神行为或认知功能障碍最为常见[12]。目前尚不清楚MOG抗体与抗NMDAR之间的相关性,但有研究认为可能与少突胶质细胞中含有NMDAR相关[12-13]。
影像学结果显示,67.3%的患儿头颅MRI提示双侧受累,且以皮层下白质、基底节、丘脑、脑干受累多见,且ADEM患儿较NMOSD患儿更容易出现双侧病灶、白质受累、基底节受累,这可能与本研究纳入病例大多为ADEM有关,因为ADEM患儿典型的头颅MRI特征就表现为累及双侧皮层下白质、基底节、脑干、丘脑等区域的多灶性病变[14-15]。视神经受累在各临床表型之间无明显差异,但是本研究中影像学视神经受累患儿中,50.0%提示视交叉受累,这与部分研究认为MOG抗体阳性的ON患者视神经病变多累及视神经前段的结果不一致[6,16]。但也有研究结果提示MOG抗体阳性ON患者的MRI表现可延纵向扩展影响整个视觉通路,累及视交叉和视束[16]。因此,MOG抗体阳性的ON患者中视神经受累常见范围尚需进一步大样本研究。
多数研究发现血清MOG 抗体阳性率更高,且血清滴度常高于脑脊液抗体滴度,血清MOG 抗体阳性对诊断MOG抗体相关脱髓鞘病更有意义[17-19]。本研究同样发现,47 例首发时同时行血清及脑脊液MOG抗体检测的患儿,血清MOG 抗体滴度普遍高于脑脊液抗体滴度,且有14例患儿血清抗体阳性而脑脊液抗体阴性,充分表明,在MOG抗体相关脱髓鞘病的诊断及随访中,血清抗体更有临床意义。
对于MOG抗体滴度与疾病发生发展和严重程度之间的关系仍然是国内外学者关注的热点。有研究显示,在成年人中血清高MOG 抗体滴度与更严重的临床表型有关,如双侧视神经炎[20]。而在儿童中,现无直接证据证明ADEM等严重临床表型与高MOG抗体滴度有关[3,21-22],有研究发现疾病活动期MOG 抗体滴度大多高于疾病缓解期[3],MOG 抗体的持续存在与患儿复发或预后较差有关,而抗体的短暂存在则是单相性病程的特征[10,18,23]。因此多数学者认为,连续MOG抗体监测对临床有重要的指导意义。本研究中,血清MOG 抗体滴度与急性期患儿EDSS 评分无明确相关性,提示MOG 抗体滴度的高低无法预测急性期疾病严重程度。因部分患儿首次发作时未行MOG 抗体检测,以及随访时间尚短,目前本研究无法统计分析血清MOG 抗体滴度与复发是否存在明确相关性。但本研究中有4例患儿复发(新的临床发作和/或新的MRI病变)时MOG抗体滴度较稳定期明显升高,1例患儿随访中抗体转阴后再次转阳时出现复发,提示当MOG抗体较前明显增高或阴转阳时需警惕复发可能。但本研究中9例患儿MOG抗体滴度较前增高时,临床和影像学上并没有新的疾病活动的证据,2 例患儿在MOG抗体滴度降低时出现复发,均提示MOG抗体滴度不能准确评估或预测病情的稳定或复发。MOG 抗体与疾病严重程度及疾病进展的相关性尚需进一步前瞻性、大样本研究。
目前对于MOG抗体相关脱髓鞘病治疗主要采用IVIG和/或大剂量糖皮质激素冲击治疗,大部分患者在急性期后恢复较好。但也有研究表明,高达45%的人会留下严重残疾[2,24-27]。本研究发现大部分患儿急性期经IVIG或大剂量激素冲击治疗后恢复较好,部分患儿可有复发,复发率约为48.3%。这与其他研究结果一致[28-29]。甚至相关研究认为80%MOG抗体阳性的脱髓鞘患者会复发,且随着观察时间的延长,单相病程患者的比例会下降[26]。本研究中复发患儿平均随访时间也较未复发患儿更长,因此,随访时间短可能影响复发率的判断。另外,本研究中,首次发作时具有发热表现可能与其复发有关,早期使用(首次起病2周内)IVIG或大剂量激素冲击治疗可能减少其复发。
综上所述,儿童MOG 抗体相关脱髓鞘病临床表型多样,ADEM最为常见,其次为NMOSD。MOG抗体可以与抗NMDAR 同时存在,与单纯MOG 抗体阳性患儿相比,常伴有明显认知损害、意识内容障碍。儿童MOG抗体相关脱髓鞘病常以非特异性的发热起病,且其在病程中最为常见,应高度重视。MOG抗体的检测血清较脑脊液对诊断更有意义。急性期尽早IVIG和/或大剂量激素冲击治疗能有效改善患儿急性期残疾症状,大部分患儿呈单相病程,预后好。但部分患儿 有复发,首次发作时有发热症状、超过首次起病2周后才使用IVIG和/或大剂量激素冲击治疗可能与复发有关。

