YAP基因对HPV感染宫颈癌细胞TGF-α及EGFR表达的调节作用
邢孔芸,陈玉蓉,李 庆,黎先萍,王 霞,蔡月红,吴文婷,罗 庆
宫颈癌在全球范围内居于妇科肿瘤发病率第二位,国际癌症研究机构(international agency for research on cancer,IARC)统计,在2012年有52.8万妇女被诊断患有宫颈癌,导致了该年26.6万妇女死亡[1]。宫颈癌对于女性、家庭甚至社会都造成了极大的危害。据临床数据统计显示,绝大多数宫颈癌患者存在人乳头瘤病毒(human papillomavirus,HPV)感染情况,同时HPV也被认为是导致宫颈癌产生的首要因素[2]。HPV感染的终生风险超过75% ,然而HPV影响到宫颈癌发生发展的具体机制并不明确,因此在宫颈癌疾病的发生以及发展过程中,对相关因子水平进行检测非常关键,已发展成为临床研究的热门课题。YES相关蛋白(yes associated protein,YAP)是Hippo信号通路中的靶基因,属于一种原癌基因,在哺乳动物中,YAP的功能主要在肿瘤细胞中实现,在肿瘤细胞的增殖、耐药、侵袭、转移以及抗凋亡中都发挥着重要作用。有研究发现Hippo信号通路能够激活转化生长因子α(transforming growth factor α,TGF-α)及表皮生长因子受体(epidermal growth factor,EGFR)的表达[3],已有研究证实,EGFR以及TGF-α在宫颈癌细胞的增殖以及生长构成中具有非常重要的作用[4]。该研究对EGFR以及TGF-α蛋白在HPV亚型阳性宫颈癌细胞以及HPV阴性宫颈癌细胞中的表达情况进行分析,探讨HPV感染后宫颈癌细胞的相关分子机制的改变,并对YAP蛋白影响HPV感染阳性患者EGFR以及TGF-α表达调节作用进行分析。
1 材料与方法
1.1 材料
1.1.1细胞来源 HPV-16(+)Ca Ski人宫颈癌细胞、HPV(-)C33a人宫颈癌细胞、HPV-18(+)C4-1人宫颈癌细胞、本研究所涉及细胞均购自中国科学院细胞库。
1.1.2主要试剂 RPMI1640培养基、胎牛血清购自美国Gibco 公司;免疫组化试剂盒购自上海碧云天生物技术有限公司;总RNA提取试剂盒购自日本TAKARA公司;SuperReal荧光定量试剂盒以及总RNA逆转录试剂盒购自上海天根生化科技有限公司;牛血清白蛋白(BSA)购自上海碧云天生物技术有限公司;YAP单克隆抗体、EGFR单克隆抗体、TGF-α单克隆抗体以及GAPDH单克隆抗体购自美国Abcam公司;YAP抑制剂Vertepofin购于美国MCE公司。
1.2 方法
1.2.1细胞免疫组织化学法检测HPV(+)及HPV(-)宫颈癌细胞中YAP、TGF-α及EGFR的表达 分别将Ca Sk细胞、 C4-1细胞以及C33a细胞以1×104个/ml的密度种于无菌盖玻片上,待细胞贴壁后,洗片、固定,在浓度为0.5 %的聚乙二醇辛基苯基醚中进行孵育,封闭一段时间后加入一抗,调整合适温度后过夜,洗片后将二抗加入,然后进行染色处理,完成染核后进行苏木精复染,然后将其放在仪器中进行检测。每个视野观察细胞,进行评分:1分:阳性染色细胞数≤25%;2分:阳性染色细胞数占>25%~<50%;3分:阳性染色细胞数≥50%。根据染色强度评分:0分:无染色;1分:淡黄色;2分:黄色;3分:棕黄色。等级表达是两者之间的乘积0~1分为阴性(-),2~5分为弱阳性(+),5~9分及为阳性()。阳性细胞所占总细胞百分比进行判定。
1.2.2Western blot 检测 HPV(+)及HPV(-)宫颈癌细胞中YAP、TGF-α及EGFR蛋白的表达 对宫颈癌Ca Ski细胞、C4-1细胞及C33a细胞进行蛋白常规提取,进行蛋白定量、定性检测,然后进行配胶、电泳等操作,完成转膜后使用BSA进行封闭,然后加入一抗,调整温度后过夜,进行洗膜处理,将二抗加入,调整温度过夜,然后进行显影工作液配置,进行观察。
1.2.3Vertepofin 对宫颈癌细胞增殖的影响 分别给予HPV(+)宫颈癌Ca Ski细胞、C4-1细胞YAP抑制剂Vertepofin 10 μmol/L,将细胞接种于6孔板,每24 h台盼蓝染色后细胞计数,绘制细胞生长曲线。
1.2.4Western blot 检测 Vertepofin干预后YAP、TGF-α及EGFR蛋白的表达 宫颈癌Ca Ski细胞、C4-1细胞分别给予Vertepofin干预后48 h,进行蛋白常规提取,然后进行蛋白定性、定量测定,进行配胶、电泳、转膜处理,使用BSA封闭液进行封闭,将一抗加入后过夜,进行洗膜处理,然后将二抗加入,调整合适温度进行孵育过夜,加显影工作液后进行观察。
1.2.5Realtime PCR检测Vertepofin干预后YAP、TGF-α及EGFR mRNA的表达 宫颈癌Ca Ski细胞、C4-1细胞分别给予Vertepofin干预后48 h后,然后进行总RNA提取,并将其转为cDNA,取PCR产物15 μl置于琼脂糖凝胶中,浓度为1.2%,其中含有溴化乙啶0.5 μg/ml,进行常规电泳分离,图像处理在凝胶成像仪中进行,对各组目的基因的表达情况进行观察,然后对各电泳条带进行灰度分析,后进行20 μl反应体系配置,mRNA表达情况根据Super Real荧光定量试剂盒说明进行检测,引物序列见表1。

表1 引物序列及扩增片段长度
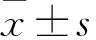
2 结果
2.1 细胞免疫组化法检测人宫颈癌细胞YAP、TGF-α、EGFR结果通过免疫组化在镜下的结果可以发现,HPV(+)的2组细胞Ca Ski与C4-1其YAP、TGF-α、EGFR的表达均高于HPV(-)的细胞C33a。其中Ca Ski细胞YAP(+)及EGFR(+)细胞比例较C33a提高(P<0.05),YAP()、TGF-α()及EGFR()细胞比例高于C33a细胞(P<0.05)。C4-1细胞中TGF-α(+)及EGFR(+)细胞的比例高于C33a细胞(P<0.05),而YAP()、TGF-α()及EGFR()细胞比例高于C33a细胞(P<0.05),见表2、图1。
2.2 Western blot检测人宫颈癌细胞YAP、TGF-α、EGFR结果通过比较发现,在HPV(-)的C33a细胞中,YAP及EGFR呈低表达状态,YAP及EGFR的表达在HPV(+)的Ca Ski及C4-1细胞中高于C33a细胞(P<0.05)。3组细胞的TGF-α表达差异无统计学意义(P>0.05),见图2。
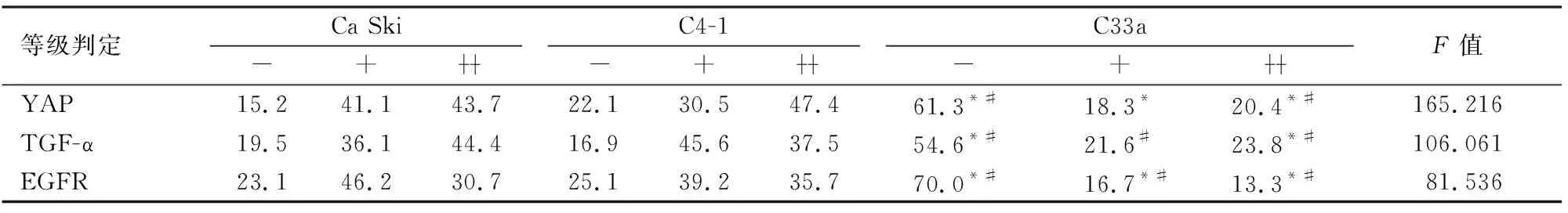
表2 人宫颈癌细胞YAP、TGF-α、EGFR表达的比较(%)

图1 YAP、TGF-α和EGFR在三种细胞株中的表达 ×400

表3 Vertepofin干预后三组细胞增殖抑制的比较(×104)
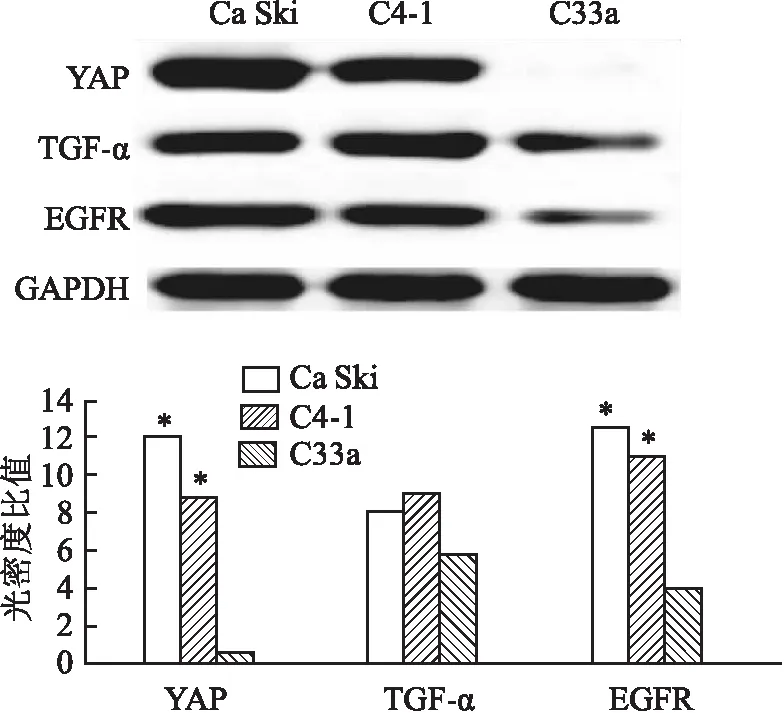
图2 不同宫颈癌细胞中YAP、TGF-α及EGFR蛋白表达差异
2.3 YAP抑制剂Vertepofin干预对宫颈癌细胞细胞生长曲线的改变对C33a细胞、Ca Ski细胞及C4-1细胞进行YAP抑制剂Vertepofin处理,并进行连续细胞计数,结果显示,C4-1和Ca Ski细胞中,加入Vertepofin后6 d,细胞增殖速度出现了的下降,较未加入Vertepofin组差异有统计学意义。在未加入Vertepofin前,C33a细胞的增殖速度低于HPV(+)的Ca Ski细胞及C4-1细胞,加入Vertepofin后,C33a细胞的增殖速度在第8天较未加入Vertepofin组出现了的降低。但总体而言,Vertepofin对于HPV(+)细胞的增殖抑制作用高于HPV(-)细胞,见表3。
2.4 Western blot检测YAP抑制剂干预后宫颈癌细胞中YAP、TGF-α、EGFR蛋白表达结果通过结果发现,在HPV(+)的Ca Ski及C4-1细胞中YAP的表达高于C33a组,并且给予YAP抑制剂后,在抑制HPV(+)的Ca Ski及C4-1细胞中YAP蛋白的同时,也会抑制TGF-α及EGFR的表达(P<0.05),给予C33a细胞Vertepofin后,仅有EGFR的表达出现了抑制(P<0.05),见图3。

图3 Vertepofin干预后对于宫颈癌细胞中YAP、TGF-α及EGFR蛋白表达的影响与 Vertepofin(-)比较:*P<0.05
2.5 RT-PCR检测宫颈癌细胞YAP、TGF-α、EGFR mRNA在YAP抑制剂干预后表达结果进行抑制剂干预,对HPV(+)宫颈癌细胞YAP、TGF-α、EGFR mRNA定性及定量的比较发现,当给予Vertepofin后,在YAP mRNA被抑制的同时,TGF-α及EGFR的表达也出现了抑制(P<0.05),但在C33a细胞中除了EGFR的表达被抑制(P<0.05),YAP及TGF-α的表达均无改变(P>0.05),见图4。
3 讨论
最初在果蝇中发现Hippo/YAP信号通路对于不同种类细胞增殖可以起到调节作用[5]。Hippo信号通路的主要下游效应物为YAP。在乳腺癌中,永生化乳腺上皮细胞MCF1-A的致癌转变受过度表达的YAP诱导,对于颗粒细胞肿瘤细胞增殖可以起到显著刺激作用[6]。据临床数据统计显示,在宫颈癌的发生、发展过程中高危HPV亚型起到非常重要的作用,但是,目前对于高危HPV病毒调控宫颈癌相关因子的作用机制并无统一定论。曾有研究指出,当宫颈癌细胞HT3被HPV病毒感染后,会加快HT3的增殖速度,且伴有YAP、磷酸化YAP升高情况,在将YAP基因经siRNA敲除后,可抑制由HPV病毒感染所导致的肿瘤细胞增殖[7]。这一结果可以看出,宫颈癌细胞HPV病毒感染的重要介质包含YAP。本研究显示,在HPV(+)的宫颈癌细胞中,YAP的表达增高,YAP(+)、()细胞比例高于C33a(P<0.05),在本研究中进一步证明了YAP与HPV感染宫颈癌的联系。Vertepofin是一种苯卟啉单环酸A,在研究中发现其可以抑制YAP的活性,研究指出,给予对紫杉醇耐药的PDX细胞Verteporfin,对患者采用紫杉醇联合维替泊芬治疗可抑制YAP产生,进而提高抗肿瘤效果[8]。本研究中,给予宫颈癌细胞YAP抑制剂Verteporfin干预,抑制mRNA以及YAP的蛋白表达,且HPV阳性宫颈癌细胞增殖速度降低,结果说明,对于HPV阳性宫颈癌患者抑制YAP表达可抑制其肿瘤细胞增殖,同时这种抑制效果在HPV(+)宫颈癌细胞中较HPV(-)宫颈癌细胞中更为明显。
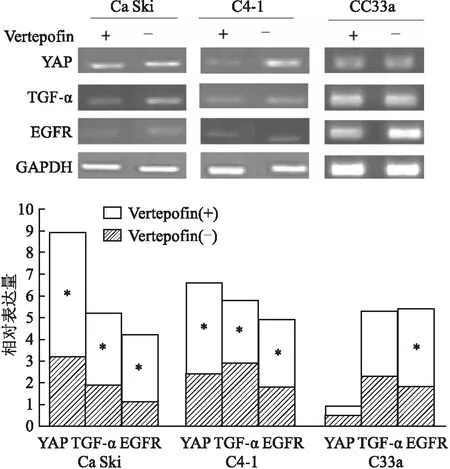
图4 Vertepofin干预后对宫颈癌细胞YAP、TGF-α及EGFR mRNA的影响与Vertepofin(-)比较:*P<0.05
在进一步研究YAP蛋白调节HPV(+)的宫颈癌的相关机制中,我们对YAP与TGF-α及EGFR的关系进行了探讨。研究证实在肿瘤发生及发展过程中与TGF-α有着密切联系[9]。EGFR可携带于多种肿瘤细胞中,且可以形成期配体家族,因此认为其家族成员可能在肿瘤微环境旁分泌以及自分泌信号转导。有研究[10-11]指出,在基底乳腺癌细胞MDA-231中检测EGFR配体的表达,其中AREG/TGF-α和HBEGF为表达最高的配体,当抑制TGF-α的表达后,细胞增殖降低,血管生成减少,肿瘤生长变慢。本研究发现,通过对宫颈癌细胞检测TGF-α及EGFR的表达发现,HPV(+)的Ca Ski与C4-1细胞中,与HPV(-)C33a细胞比较,TGF-α与EGFR的表达升高,说明是否感染HPV与宫颈癌中TGF-α与EGFR的表达情况有着密切联系。YAP作为重要的致癌基因,在肿瘤细胞以多种形式存在,当抑制YAP的表达后,肿瘤细胞的增殖、凋亡、侵袭等都会随之受影响[12]。本研究中,在对HPV(+)宫颈癌细胞进行检测时发现,存在EGFR、TGF-α以及YAP表升高情况,而这一升高在HPV(-)的C33a细胞中并未发现。HPV感染宫颈癌细胞EGFR以及TGF-α表达与YAP蛋白的关系,用YAP抑制剂Verteporfin干预,结果发现,当给予YAP抑制剂Verteporfin后,在HPV(+)宫颈癌细胞中,伴随着YAP蛋白的被抑制TGF-α及EGFR蛋白及mRNA的水平均出现了不同程度的抑制,而在HPV(-)的宫颈癌细胞中仅出现了EGFR基因的下调,说明YAP基因在HPV(+)宫颈癌细胞中对肿瘤细胞的抑制作用及对TGF-α及EGFR的调节作用更加显著。
本研究初步证明,在HPV病毒感染宫颈癌细胞后,可调高YAP表达,且同时出现EGFR、TGF-α升高情况,在对YAP基因表达进行抑制后,可同时降低EGFR、TGF-α表达,证明YAP对HPV病毒感染的宫颈癌细胞中EGFR以及TGF-α表达可起到正调控作用,可以通过抑制YAP的表达在HPV病毒感染的宫颈癌治疗中靶向TGF-α及EGFR,为宫颈癌治疗提供新的靶点和治疗途径。

