伊枯草菌素A对草莓腐败菌的抑制效果研究
王晓琼,毕秀芳*,谢晓凤,邢亚阁,李明元
1西华大学食品与生物工程学院,成都 610039;2宜宾西华大学研究院,宜宾 644000
近年来我国草莓产业发展迅猛,据农业部统计数据显示,2010年我国草莓的播种面积为11.7万公顷,产量达200万吨[1]。草莓中富含糖类、蛋白质、氨基酸等多种营养物质,具有清热消暑、健脾和胃、润肺止咳、补益气血等功效,有“水果皇后”的美称[2]。但草莓皮薄多汁,贮运过程中表皮极易破损而遭受微生物的侵染导致腐烂变质,并且草莓收获时间较为集中,货架期比较短[3]。目前,草莓最常见的保鲜方法是低温冷藏、化学保鲜剂相结合的处理方法,化学保鲜剂虽有较好的防腐保鲜效果,但一些化学保鲜剂长期使用会产生抗药性致病菌菌株[4],且很多化学合成物质有污染环境和危害健康等缺陷,甚至对人体有致畸、致癌、致突变毒性[5]。因此,随着生活水平的提高,人们趋向于追求广谱、高效、低(无)毒、无污染的果蔬天然保鲜剂的开发利用。
伊枯草菌素A是由枯草芽孢杆菌发酵产生的一种环脂肽类化合物,具有抑菌谱广、抑菌能力强、无毒安全和不易引起耐药性等优点,是一种极具研究和开发潜力的生物杀菌剂[6]。同时,Sun等[7]研究发现经口服的抗菌肽对小鼠无急性毒性作用;Dey等[8]对伊枯草菌素A安全性进行评估,发现伊枯草菌素A能抑制体内肿瘤生长。伊枯草菌素A等脂肽类表面活性剂主要作用于病原菌细胞膜的磷脂双分子层,改变细胞膜通透性和功能性,从而抑制病原微生物的生长[9]。近几年,有少量研究利用伊枯草菌素A发酵液进行果蔬采后腐败控制。Ambrico等[10]研究了BacillussubtilisET-1发酵上清液对绿霉和青霉的抑制效果,发现抑菌圈直径随着伊枯草菌素A浓度的增加而增加,且伊枯草菌素A可显著抑制病原菌侵染后柠檬和草莓的病害。Arroyave等[11]发现9种病原菌对BacillussubtilisEA-CB0015发酵液表现出不同的敏感性,发酵液中的伊枯草菌素A和fengycin C对Colletotrichumacutatum和B.cinerea的抑菌效果较好。这些研究为伊枯草菌素A在果蔬采后病害防治中的应用提供了一定理论支撑。此外,脂肽类化合物是一种新一代有价值的抗菌药物,随着抗菌肽研究的不断深入和技术的进步,如何将其应用于果蔬保鲜已成为研究热点。本文研究了伊枯草菌素A对草莓腐败菌的抑制作用,为草莓的病害防治提供了新的方向。
1 材料与方法
1.1 材料与试剂
F.fujikuroi由本实验室保藏,菌种编号为FusariumfujikuroiXHF11312 30.01,分离自四川草莓腐败果实表面;B.cinerea购自中国农业微生物菌种保藏管中心(China Agricultural Microbial Species Preservation Center,ACCC),菌种编号为ACCC.37271,菌种斜面均于4 ℃条件下贮藏。
氯化钠(分析纯,国药集团化学试剂有限公司);脱氢乙酸钠(湖北海顺达食品科技有限公司);纳他霉素(浙江一诺生物科技有限公司);伊枯草菌素A(2.59 mg/mL,中国科学院成都生物研究所提供);马铃薯葡萄糖琼脂(北京奥博星生物技术有限责任公司)。
1.2 仪器与设备
HNY-2102C立式智能恒温培养振荡器(天津欧诺仪器股份有限公司);GI54DWS立式自动压力蒸汽灭菌器(致微(厦门)仪器有限公司);SW-CJ-2F型双人双面净化工作台(苏州安泰空气技术有限公司);SGSP-02电热恒温隔水式培养箱(黄石市恒丰医疗器械有限公司);DS-11A数显电导率仪(上海雷磁创益仪器仪表有限公司);TGL-16冷冻离心机(湖南湘仪赛德仪器有限公司);UV-2200紫外分光光度计(上海美谱达仪器有限公司);BL23光学显微镜(上饶天策莱光仪器有限公司)。
1.3 实验方法
1.3.1 菌种的活化与菌悬液的制备
将试管中的F.fujikuroi和B.cinerea于无菌环境接种至PDA平板上,在28 ℃恒温箱中培养24~48 h,培养出灰葡萄孢霉备用。将活化后的菌种用无菌生理盐水稀释,制成浓度为106~107CFU/mL的菌悬液。
1.3.2 不同抑菌剂的制备
用无菌水分别配制浓度为1、3、5、7.5、10、12.5、15、17.5、20、22.5、25、27.5、30 mg/mL的脱氢乙酸钠和纳他霉素溶液,浓度为0.032 4、0.037 0、0.043 2、0.051 8、0.064 8、0.086 3、0.129 5、0.259 mg/mL的伊枯草菌素A溶液,并用0.22 μm微孔过滤膜除菌待用。
1.3.3 抑菌实验
抑菌实验采用滤纸片定量加药法[10]。将1 mL菌悬液在PDA平板上涂布均匀,再将灭菌后的滤纸片(直径:6 mm)用无菌镊子平贴于涂布后的PDA平板上,每个平板放置3~6个纸片,每个纸片上再滴加10 μL抑菌液,且纸片间间距均匀。处理后的平板在28 °C恒温箱中培养48 h,测定各平板抑菌圈直径,确定最小抑菌浓度(MIC)。
吸取不同剂量最小抑菌浓度的抑菌剂(100~300 μL)于30 mL PDA培养基混合震摇均匀,再吸取1 mL菌悬液涂布均匀,于28 ℃恒温条件下培养48 h后观察是否有菌,以确定三种抑菌剂的最小用量。所有步骤不同时间重复三次。
1.3.4 抑菌剂处理对腐败菌细胞膜通透性的影响及显微镜结构变化
吸取最小用量的抑菌剂于20 mL悬浮液中,混匀。再取1 mL加入抑菌剂的菌悬液于载玻片上,盖上盖玻片,置于光学电子显微镜下放大4×10倍观察菌体形态,并保存图像。细胞膜通透性的测定参考Zhang[11]的方法并稍加修改,将以上悬浮液在10 000 rpm下离心10 min去除菌体,取上清液于紫外分光光度计260和280 nm处测定吸光值(A260和A280)。由于核酸和蛋白质分别在260 nm和280 nm处有最大吸光值,因此在此波长下的吸光值变化可用来估测核酸和蛋白质的含量[14]。实验重复三次,并以加无菌水的菌悬液为空白对照。
1.3.5 数据统计分析
试验数据采用Origin 8.5进行统计并绘图;采用SPSS 25.0软件进行统计分析,组间数据采用单因素方差分析(ANOVA),显著水平为0.05,当P<0.05时差异显著,结果以标记字母(a、b、c)表示,不同字母表示有显著差异性。
2 结果与分析
2.1 不同抑菌剂对草莓腐败菌的抑菌效果
2.1.1 三种抑菌剂对两种草莓腐败菌的初步抑菌效果判断
由图1可知,F.fujikuroi在PDA平板上的生长分布密集,少量点状分布;B.cinerea则为点状均匀分布于平板上。经过三种抑菌剂处理后,两种草莓腐败菌平板上每个纸片周围均有抑菌圈的形成,且肉眼可见,表明脱氢乙酸钠、纳他霉素和伊枯草菌素A三种抑菌剂对F.fujikuroi和B.cinerea的生长均有抑制作用。此外,从图1中的抑菌圈大小以及抑菌浓度可初步判断伊枯草菌素A具有较强的抑菌能力,存在较强的优势。
2.1.2 不同浓度的脱氢乙酸钠的抑菌效果
由图2可知,3 mg/mL的脱氢乙酸钠对F.fujikuroi产生明显的抑菌作用,抑菌圈直径达到14.44 mm,随着浓度的增加,抑菌效果逐渐增强。Li等[15]等研究发现脱氢乙酸钠能够抑制饲料中F.fujikuroi的生长,最低抑菌浓度为80 mg/kg。对于B.cinerea,0~17.5 mg/mL的脱氢乙酸钠无明显抑菌作用,提高浓度到20 mg/mL时出现抑菌圈,抑菌直径为6.84 mm,随着脱氢乙酸钠浓度的增加,抑菌作用增强。Wang等[16]研究发现脱氢乙酸钠对B.cinerea有较明显的抑制作用,0.5 mg/mL的脱氢乙酸钠抑菌率达到93.2%。脱氢乙酸钠有广谱的较强的抗腐败菌能力,主要通过渗透进入微生物的细胞壁,干扰细胞内各种酶体系而产生抑菌作用[15]。结果表明脱氢乙酸钠对F.fujikuroi的抑菌效果比对B.cinerea更好。

图1 不同抑菌剂对F.fujikuroi与B.cinerea的抑菌效果Fig.1 Antibacterial effect of different bacteriostatic agents on F.fujikuroi and B.cinerea注:a(5 mg/mL)、b(15 mg/mL)、c(0.051 8 mg/mL)分别为脱氢乙酸钠、纳他霉素和伊枯草菌素A三种抑菌剂处理F.fujikuroi的效果图,a1(25 mg/mL)、b1(30 mg/mL)、c1(0.037 0 mg/mL)为三种抑菌剂处理B.cinerea的效果图。Note:The a (5 mg/mL),b (15 mg/mL) and c (0.051 8 mg/mL) were the effects of sodium dehydroacetate,natamycin,and iturin A on F.fujikuroi,respectively.The a1 (25 mg/mL),b1 (30 mg/mL) and c1 (0.037 0 mg/mL) were the effect diagrams of the antibacterial agents for B.cinerea.
2.1.3 不同浓度的纳他霉素的抑菌效果
由图3可知,7.5 mg/mL的纳他霉素开始对F.fujikuroi产生明显的抑菌作用,抑菌圈直径达到14.76 mm,且随着浓度的增加抑菌效果逐渐增强。对B.cinerea,0~17.5 mg/mL的纳他素无明显抑菌作用,提高浓度到20 mg/mL时出现抑菌圈,抑菌圈直径为8.21 mm,同时随着浓度的增加,抑菌作用增强。Li等[17]研究发现0.25 mg/mL的纳他霉素对青霉的抑制直径为19 mm,可以有效地抑制腐败菌的生长。纳他霉素的作用机理是通过与细胞膜里的甾醇,特别是麦角固醇形成复杂的复合物,改变细胞渗透性,从而抑制和杀灭真菌[18]。结果表明纳他霉素对F.fujikuroi的抑菌效果比对B.cinerea更好。

图2 脱氢乙酸钠对草莓腐败菌的抑菌效果Fig.2 Antibacterial effect of sodium dehydroacetate on strawberry spoilage bacteria
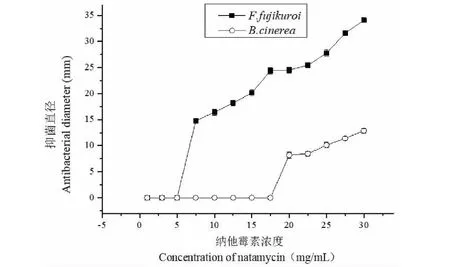
图3 纳他霉素对草莓腐败菌的抑菌效果Fig.3 Antibacterial effect of natamycin on strawberry spoilage bacteria
2.1.4 不同浓度的伊枯草菌素A的抑菌效果
由图4可知,0.051 8 mg/mL的伊枯草菌素A开始对F.fujikuroi产生明显的抑菌作用,抑菌圈直径为8.41 mm。对B.cinerea,0.037 0 mg/mL的伊枯草菌素A产生明显的抑菌作用,抑菌圈直径为10.43 mm。随着伊枯草菌素A浓度的增加,F.fujikuroi和B.cinerea的抑菌圈直径逐渐增大,但是,当伊枯草菌素A浓度增加到0.064 8 mg/mL时,随着浓度的增加,伊枯草菌素A对F.fujikuroi与B.cinerea的抑菌作用趋于平缓,0.064 8~0.259 0 mg/mL之间抑菌圈直径分别只增加了0.45 mm和0.69 mm。Gu等[19]研究发现1mg/mL粗伊枯草菌素A溶液在黄瓜灰霉病菌的PDA平皿上可形成1~2 mm的抑菌带,对灰腐败菌有一定的抑制效果。Gong[20]研究发现100 μg/mL 伊枯草菌素A对F.fujikuroi孢子抑制率为100%,50 μg/mL时抑制率为97.51%。伊枯草菌素A对细胞的破坏是通过在真菌细胞膜上形成小孔,使离子从小孔中通过使膜的通透性发生变化实现抑菌作用[21]。因此,伊枯草菌素A对F.fujikuroi的抑菌效果比对B.cinerea更好。

图4 伊枯草菌素A对草莓腐败菌的抑菌效果Fig.4 Antibacterial effect of iturin A on strawberry spoilage bacteria
以上实验结果表明,三种抑菌剂对两种草莓腐败菌均有抑制效果,且随着浓度的变大,F.fujikuroi和B.cinerea的抑菌圈直径也相应增加。当三种抑菌剂的浓度较低时,对于两种菌的抑菌效果较差,可能是由于低浓度中的抑菌剂量少,对于腐败菌菌落数的作用数量有限。而且抑菌纸片的直径为6 mm,低浓度下产生的抑菌直径太小(抑菌圈直径<6 mm),不能观察到。随着抑菌剂浓度的增加,抑菌剂量有效作用的腐败菌菌落数量也相应增加,抑制效果更好。
2.2 抑菌剂的最小用量
脱氢乙酸钠、纳他霉素和伊枯草菌素A对F.fujikuroi和B.cinerea的最小抑菌浓度和最小用量如表1所示,通过实验结果可知伊枯草菌素A对F.fujikuroi和B.cinerea的MIC分别为0.051 8 mg/mL和0.037 0 mg/mL,远低于脱氢乙酸钠和纳他霉素的MIC,同时最小用量均低于300 μL,结果表明三种抑菌剂的敏感性为伊枯草菌素A>纳他霉素>脱氢乙酸钠。

表1 三种抑菌剂的对F.fujikuroi和B.cinerea的最小抑菌浓度和最小用量Table 1 Minimum inhibitory concentration and minimum dosage of three bacteriostatic agents against F.fujikuroi and B.cinereal
2.3 抑菌剂处理对腐败菌紫外吸收物质渗漏的影响
2.3.1 抑菌剂处理后对腐败菌核酸渗漏的影响

图5 抑菌剂处理对腐败菌核酸渗漏的影响Fig.5 Effect of bacteriostatic treatment on nucleic acid leakage of spoilage bacteria注:图中大写、小写字母分别表示不同抑菌剂对F.fujikuroi和B.cinerea的显著性差异(P<0.05),下同。Note:Uppercase and lowercase letters indicated the significant difference of F.fujikuroi and B.cinerea treated by different bacteriostatic agents,respectively (P<0.05),the same below.
细胞正常代谢必须依靠一个完整的细胞膜结构,当细胞膜遭到破坏时,胞内的一些磷酸盐、碳酸盐、DNA与RNA等均会先后从细胞膜中释放出来,而这些核内物质在260 nm处有很强的紫外吸收[22-23]。因此,可以通过检测菌悬液的紫外吸收来推测菌体细胞膜完整性的变化。不同抑菌剂处理后两种草莓腐败菌内核酸物质泄露情况如图5所示,脱氢乙酸钠、纳他霉素和伊枯草菌素A处理后,F.fujikuroi内的核酸泄漏量均从0.027分别增加至0.241、0.182和0.275,而B.cinerea内的核酸泄漏量均从0.036增加至0.459、0.215和0.242。以上结果说明三种抑菌剂均能破坏细胞膜,使胞内ATP及核酸物质泄露而导致吸光值增大,并且不同抑菌剂处理同一腐败菌,核酸变化差异显著(P<0.05)。抑菌剂处理后菌悬液中核酸含量增加,可能是由于抑菌剂破坏了腐败菌细胞的细胞壁,使得核酸流入菌悬液[24]。
2.3.2 抑菌剂处理后对腐败菌蛋白质渗漏的影响
不同抑菌剂处理后两种草莓腐败菌内蛋白质泄露情况如图6所示,脱氢乙酸钠、纳他霉素和伊枯草菌素A处理后,F.fujikuroi内的蛋白质泄漏量均从0.016分别增加至0.155、0.167和0.213,而B.cinerea内的蛋白质泄漏量均从0.027增加至0.359、0.141和0.211。不同抑菌剂处理同一腐败菌,蛋白质变化差异显著(P<0.05)。Wang[25]研究发现2%荆芥原液和2%荆芥提取物溶液处理2.5 min后,腐败菌的菌悬液胞外蛋白的质量浓度大约增加了49 μg/mL和62 μg/mL。抑菌剂处理后菌悬液中蛋白质含量增加,可能是由于抑菌剂造成细胞质中蛋白质的外泄。细胞膜破损后,细胞内容物外渗,细胞吸胀受损甚至死亡从而达到抑菌作用[23]。

图6 抑菌剂处理对腐败菌蛋白质渗漏的影响Fig.6 Effect of bacteriostatic treatment on protein leakage of spoilage bacteria
由不同抑菌剂处理后腐败菌悬浮液的紫外吸收物质的增加可知,三种抑菌剂均可通过破坏细胞膜、增大菌体细胞膜的通透性以及完整性从而使细胞内容物外渗,细胞吸胀受损甚至死亡,达到抑菌目的。
2.4 三种抑菌剂处理后草莓腐败菌的显微镜结构变化

图7 最小抑菌剂用量处理后F.fujikuroi和B.cinerea细胞结构变化Fig.7 Changes in cell structure of F.fujikuroi and B.cinerea after treatment with minimal inhibitor注:图片编号中首位A、B、C、D分别代表脱氢乙酸钠、纳他霉素、伊枯草菌素A和空白对照处理;次位1和2分别代表MIC最小用量和大于最小用量(本次实验一取400 μL)处理;三位F和B分别表示F.fujikuroi和B.cinerea(4×10倍)。Note:The first digits A,B,C and D in the picture number represented the treatments of sodium dehydroacetate,natamycin,iturin A and the control respectively;The second digits 1 and 2 respectively represented the minimum dosage and greater than the minimum dosage of MIC (400μL) for processing;The three digits F and B represented F.fujikuroi and B.cinerea (4×10 times),respectively.
如图7所示,三种抑菌剂最低浓度最小用量的处理使F.fujikuroi和B.cinerea原本的菌丝由连贯变得断裂,破碎成条状。随着抑菌剂的增加,菌丝断裂破碎得更加彻底甚至菌丝破碎成块状,而对照组菌丝表面光滑、平整、细长。目前,其他研究同样发现抑菌剂会导致孢子菌丝分离,菌丝断裂。Zhou等[26]研究发现12.5 mg/mL的桂枝提取液使青腐败菌丝畸形,底端及末端肿大,而50 mg/mL的桂枝提取液使青霉病菌菌丝顶端肿大,甚至断裂,内容物外渗,得出高浓度的桂枝提取液对青腐败菌丝的生长代谢有明显的抑制作用。因此,抑菌剂通过改变细胞膜稳定性,导致细胞结构受损,菌丝体断裂,从而达到抑菌效果。
3 结论
以草莓中两种常见的腐败菌(F.fujikuroi和B.cinerea)为实验菌,研究不同浓度的脱氢乙酸钠、纳他霉素、伊枯草菌素A对草莓腐败菌的抑菌效果。通过三种抑菌剂对F.fujikuroi和B.cinerea的最低抑菌浓度和最小用量分析,得出抑菌敏感性伊枯草菌素A >纳他霉素>脱氢乙酸钠。并通过处理后蛋白核酸泄露实验证实了三种抑菌剂均是通过改变细胞膜通透性,引起胞内核酸、蛋白质等物质流出,达到抑菌效果。然而,现有研究是草莓的体外抑菌,未来研究可通过草莓保鲜实验来确定伊枯草菌素A的抑菌效果。

