microRNA-199a-5p对口腔鳞状细胞癌细胞上皮间质转化及侵袭转移的影响机制*
卢静, 李杰, 张莹, 吴栋材
(1.北京市朝阳区中医医院 口腔科, 北京 100020; 2.北京大学第一医院 口腔科, 北京 100034)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是全球第六大最常见的恶性肿瘤[1-2],美国每年报告有超过30万例新病例[3]。尽管OSCC治疗(包括手术、化学或放射治疗)已取得进展,但由于局部复发和淋巴结转移,OSCC的5年生存率仍低于60%[4]。因此,迫切需要研发治疗OSCC的潜在分子靶标。核因子κB(nuclear factor kappa-B,NF-κB)/激酶β(IKKβ)的抑制剂是IKK复合物的关键催化亚基,对激活NF-κB至关重要[5-6]。IKKβ可通过IKK介导的磷酸化诱导的IκB抑制剂降解来激活NF-κB二聚体,从而使NF-κB二聚体进入细胞核并激活特定的靶基因表达[7]。在OSCC中,NF-κB的激活诱导上皮-间质转化,NF-κB的高表达与肿瘤的侵袭和转移相关[8-9]。抑制IKKβ可降低SCC-25细胞的细胞侵袭性,可能对OSCC治疗有用[10]。MicroRNA(miRNA)是一类小的非编码RNA,通过与靶基因mRNA的3′-非翻译区(3′-UTR)结合,在转录后水平上负调控基因的表达[11,-13]。miR-22通过靶向包含3′NLR家族吡啶结构域抑制OSCC中的细胞增殖、迁移和侵袭[14]。miR-199a-5p通过靶向IKKβ/NF-κB信号通路抑制OSCC细胞中的细胞侵袭和迁移,表明miR-140-5p在OSCC的临床诊断和治疗中可能具有潜在价值。本研究即探究MicroRNA-199a-5p对口腔鳞状细胞癌细胞上皮间质转化及侵袭转移的影响机制。
1 资料与方法
1.1 资料
1.1.1细胞 SCC-25、CAL-27、TCA-8113、SCC-4 OSCC和293细胞系获自美国典型培养物保藏中心。
1.1.2分组 将离体培养的SCC-25、CAL-27、TCA-8113、SCC-4 OSCC和293口腔鳞状细胞癌细胞分为空白对照组(n=24)、NC模拟组(n=24)和miR-199a-5p模拟物组(n=24)。
1.2 方法
1.2.1逆转录定量聚合酶链反应(RT-qPCR) 根据说明书制备miRNA,NanoDrop 2000分光光度计确定总RNA的浓度和质量。使用PrimeScript RT试剂盒合成cDNA进行miRNA逆转录,TRIzol试剂分离总RNA,用SuperScript III第一链合成系统反转录,在ABI PRISM 7300序列检测系统上进行miRNA和mRNA的qPCR分析。20 μL PCR包括2 μL cdNA和10 μL 2X qPCR混合物、250 nmoL/L浓度的正向引物(1 μL)、反向引物(1 μL)和6 μL ddH2O,将反应混合物在95 ℃变性30 s,进行40个循环,分别是95 ℃ 10 s和60 ℃ 30 s。用于RT-qPCR分析的引物,见表1。细胞中的miR-199a-5p和核因子κB激酶抑制剂(IKKβ)的表达分别标准化为U6和GAPDH的表达。
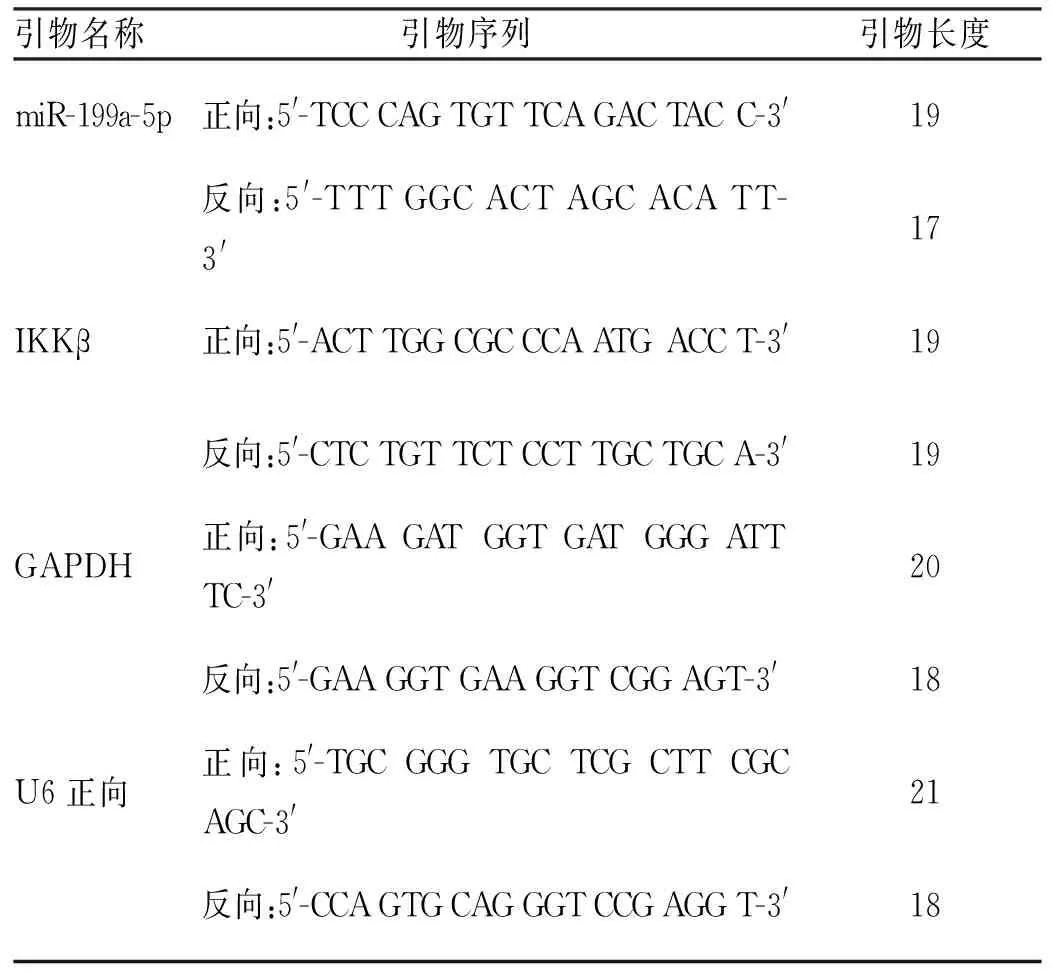
表1 RT-qPCR分析引物序列Tab.1 RT-qPCR analysis of primer sequences
1.2.2细胞培养和转染 SCC-25、CAL-27、TCA-8113、SCC-4 OSCC和293细胞在Dulbecco改良的Eagle培养基中培养,其中添加了10%胎牛血清(含100 m mol青霉素和100 ng/L链霉素),在37 ℃和5%CO2的气氛中。正常口腔黏膜细胞系用作对照,并维持在口腔角质形成细胞培养基中,补充1%角质形成细胞生长因子和上皮生长因子混合物置于37 ℃和5%CO2中。miR-199a-5p模拟物,模拟阴性对照(模拟NC组)为miR199a-5p抑制剂和NC抑制剂,购自上海基因制药有限公司。miR-199a-5p模拟物,5′-CCC AGU GUU CAG ACU ACC UGU UC-3′;模仿NC,5′-CGG TGU GUU CAG ACU ACC UGU UC-3′。miR-199a-5p抑制剂,5′-AAC AGG TAG TCT GAA CAC T-3′;NC抑制剂,5′-TAA CAC GTC TAT ACG CCC A-3′。为了诱导IKKβ的过表达,通过PCR扩增了IKKβmRNA的编码结构域序列,将其插入pcDNA 3.0载体以增强其表达,名为pcDNA-IKKβ;空的pcDNA3.1用作阴性对照(NC)。接种TCA-8113和SCC-4细胞(1.0×106/孔),并在六孔板中过夜生长;第2天时,使用Lipofectamine 2000试剂将细胞与miR-199a-5p模拟物(50 nmoL/L)、miR-199a-5p抑制剂(100 nmoL/L)或NC(100 nmoL/L),而Oligofectamine转染试剂则按照制造商的规程使用miR-199a-5p模拟物(50 nmoL/L)+2 μg pcDNA-IKKβ转染48 h。
1.2.3细胞增殖、凋亡和周期分析 将TCA-8113和SCC-4细胞(5×103/孔)接种在96孔板中过夜。转染后24、48和72 h,将CCK-8溶液添加到细胞中,并在37 ℃下再孵育2 h。使用酶标仪在450 nm处测量吸光度,流式细胞仪确定细胞周期分布。
1.2.4蛋白质印迹实验 根据核和细胞质蛋白提取试剂盒进行核和细胞质蛋白的提取和分离,BCA法测定总细胞蛋白的浓度。蛋白质样品(40 μg/泳道)在8%SDS-PAGE凝胶上进行分析,通过电印迹转移到聚偏二氟乙烯膜上。在室温下用5%脱脂牛奶将膜封闭1 h,与抗IKKβ的一抗孵育[总p65蛋白(Total p65)、核磷酸化(p-)p65、NF-κB(IκB)-α抑制剂、磷酸化核因子κB抑制蛋白α(p-IκB-α)、组蛋白H3、β-肌动蛋白和α-微管蛋白以及E 盒结合锌指蛋白 1(ZEB1)Twist相关蛋白1(TWIST1)、波形蛋白(Vimentin)、E-钙黏蛋白(E-cadherin)、甘油醛-3-磷酸脱氢酶(GAPDH)]在4 ℃过夜。在室温下与相应的辣根过氧化物酶偶联的山羊抗兔或山羊抗大鼠二抗孵育1 h后,使用增强的化学发光法检测条带套件。使用ImageJ软件分析感兴趣谱带的强度,β-肌动蛋白和α-微管蛋白被用作细胞质蛋白的内部对照。组蛋白H3蛋白用作核蛋白的内部对照,每个实验重复3次。
1.2.5NF-κB活性测定 将TCA-8113和SCC-4细胞以5×104个细胞/孔的浓度接种在6孔板中,使细胞附着过夜,在每个孔中分别用pGL4.32载体20 ng pRL-TK载体共转染;6 h后,将细胞用PBS洗涤,用miR-199a-5p模拟物和pcDNA-IKKβ转染24 h,用PBS洗涤细胞,使用荧光素酶测定试剂盒定量荧光素酶活性。
1.2.6Transwell分析 将TCA-8113和SCC-4细胞接种到24孔板中16~18 h,用相关质粒转染细胞,并继续培养18~24 h。使用带有Matrigel(用于入侵)或不带Matrigel的Transwell室插入物进行Transwell迁移和侵袭分析。转染后,将细胞接种到插入片段的上腔中(TCA-8113为6×104细胞,SCC-4为8×104细胞)。200 μL无血清RPMI 1640培养基,在插入物底部添加600 μL含20%FBS的无血清RPMI 1640培养基。将TCA-8113细胞培养36 h进行迁移,培养48 h进行侵袭实验,将SCC-4细胞迁移48 h并侵袭72 h;迁移或侵袭的细胞用结晶紫染色并用显微镜照相。
1.3 统计学方法

2 结果
2.1 miR-199a-5p在人OSCC细胞和细胞系中的表达
与正常口腔上皮细胞比较,在OSCC细胞中miR-199a-5p表达下调(P<0.01,图1A);与无淋巴结转移的细胞(n=12)比较,在有淋巴结转移的OSCC细胞(n=28)中miR-199a-5p表达降低(P<0.05)。OSCC细胞SCC-25、cAL-27、TCA-8113和SCC-4中miR-199a-5p下调(P<0.05,图1B)。

注:(1)与正常口腔上皮细胞比较,P<0.01;(2)与HOK组比较,P<0.05。图1 miR-199a-5p在人OSCC细胞和细胞系中的表达Fig.1 Expression of miR-199A-5p in human OSCC cells and cell lines
2.2 miR-199a-5p模拟物转染细胞对miR-199a-5p表达的影响
RTPCR分析显示,与TCA-8113和SCC-4细胞的空白对照组比较,用miR-199a-5p模拟物转染后,miR-199a-5p的表达上调,差异有统计学意义。见表2。CCK 8分析表明,与模拟NC转染的细胞比较,miR-199a-5p模拟物转染抑制了细胞活力(表3),在TCA-8113和SCC-4细胞中观察到的凋亡诱导。流式细胞仪分析的结果表明,miR-199a-5p的过表达通过提高TCA-8113和SCC-4细胞中G0/G1期的细胞百分比而导致G0/G1期停滞。miR-199a-5p通过诱导细胞凋亡和细胞周期停滞而部分降低了生存能力(图2)。

表2 miR-199a-5p模拟物转染细胞促进miR-199a-5p的表达上调(n=24)Tab.2 Expression of miR-199a-5p was significantly up-regulated after transfection with miR-199a-5p mimics(n=24)
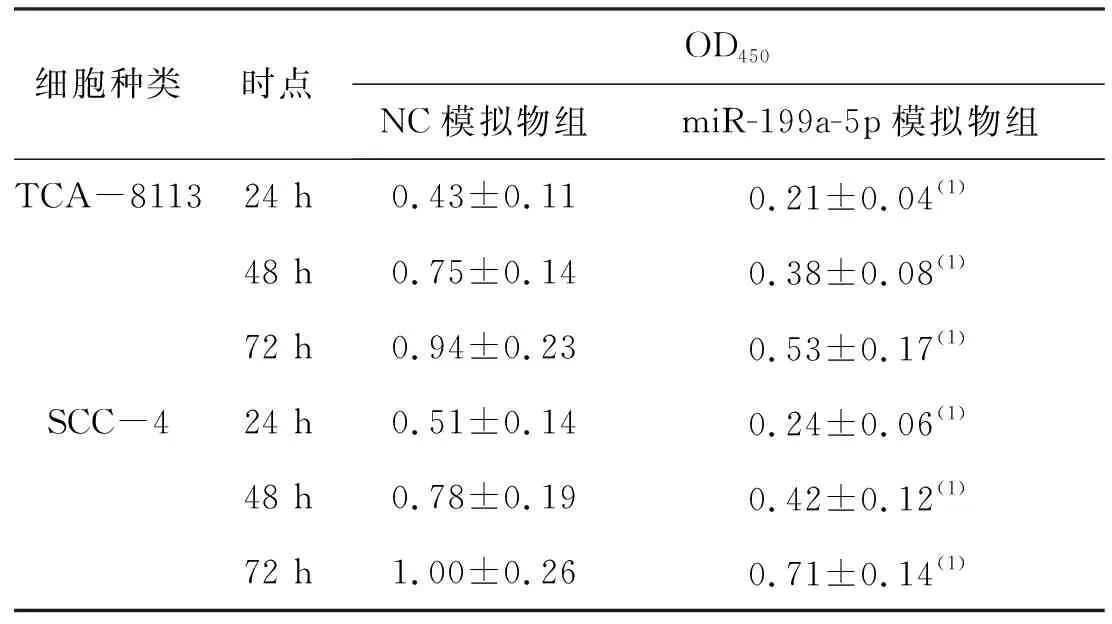
表3 miR-199a-5p模拟物转染细胞抑制细胞活力(n=24)Tab.3 miR-199a-5p mimic transfected cells inhibited cell activity(n=24)
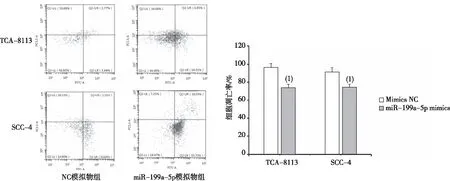
注:(1)与NC模拟物组比较,P<0.05。图2 miR-199a-5p模拟物促进TCA-8113和SCC-4细胞凋亡Fig.2 Apoptosis of TCA-8113 and SCC-4 cells promoted by miR-199a-5p mimics
2.3 miR-199a-5p对IKKβ表达的影响
如图3所示,在miR-199a-5p过表达后,蛋白水平的IKKβ表达下调,但在TCA-8113和SCC-4细胞中敲低miR-199a-5p后,IKKβ的表达上调。

注:(1)与NC模拟物组比较,P<0.05。图3 miR-199a-5p过表达对TCA-8113和SCC-4细胞中IKKβ表达水平的影响Fig.3 Effect of miR-199a-5p overexpression on IKKβ expression level in TCA-8113 and SCC-4 cells
由于在OSCC肿瘤样品中miR-199a-5p被下调,因此IHC在OSCC肿瘤细胞和邻近细胞中也检测到IKKβ的表达水平,表明miR-199a-5p可通过靶向IKKβ来发挥抑癌作用。miR-199a-5p模拟物抑制了pIκB-α的水平,而IKKβ的过表达逆转了miR-199a-5p模拟物在TCA-8113和SCC-4细胞中的这些抑制作用(图4A、表4和表5)。miR-199a-5p通过下调IKKβ抑制了NF-κB途径的激活。miR-199a-5p模拟物在蛋白质水平上均抑制了p65表达,p65的过表达抑制了ZEB1、TWIST1、E-钙黏蛋白和波形蛋白的表达(图4B、表6),减轻miR-199a-5p对OSCC细胞的迁移和侵袭的抑制(图5、表7),表明miR-199a-5p诱导的EMT取决于p65的表达。

图4 miR-199a-5p抑制IKKβ介导的NF-κB途径活化从而抑制EMTFig.4 Activation of IKKβ-mediated NF-κB pathway inhibited by miR-199a-5p

表4 TCA-8113干预后pIκB-α、IKKβ和Total p65蛋白水平Tab.4 Comparative analysis of pIκB-α, IKKβ and total p65 after TCA-8113

表5 SCC-4干预后pIκB-α、IKKβ和Total p65蛋白水平比较Tab.5 Comparative analysis of pIκB-α, IKKβ and Total p65 after SCC-4

表6 TCA-8113干预后ZEB1、TWIST1、Vimntin、E-cadherin和GAPDH蛋白水平Tab.6 Comparative analysis of ZEB1, TWIST1, Vimntin, E-cadherin and GAPDH levels after TCA-8113 intervention

表7 TCA-8113干预后ZEB1、TWIST1、Vimntin、E-cadherin和GAPDH蛋白水平Tab.7 Comparative analysis of ZEB1, TWIST1, Vimntin, E-cadherin and GAPDH levels after SCC-4 intervention

注:(1)与空白对照组相比较,P<0.05。图5 miR-199a-5p抑制TCA-8113和SCC-4细胞的侵袭和转移(200×)Fig.5 Invasion and metastasis of TCA-8113 and SCC-4 cells inhibited by miR-199a-5p(200×)
3 讨论
头颈部鳞癌复发和转移是其预后较差的主要原因,有早期广泛淋巴结转移的倾向。EMT是上皮细胞来源的恶性肿瘤细胞获得迁移和侵袭能力的重要生物学过程。EMT已经被证明在恶性肿瘤的侵袭转移中发挥至关重要作用。microRNA是一种内源性非编码小RNA,是许多生理和病理过程的基因表达的重要调控者。microRNA可能通过影响细胞表型来调控EMT过程中的细胞状态。miRNA在OSCC中可作为致癌基因或抑癌基因。miR-199a-5p在人类多种类型的癌症中均被下调[11-13,19]。miR-199a-5p下调了其靶基因在不同类型肿瘤中的表达,包括CD44、GSK-3β和结缔细胞生长因子。IKKβ是IKK复合物的催化亚基,是NF-κB信号通路的抑制剂。IKKβ在不同类型的癌中起癌基因的作用。IKKβ通过抑制上皮细胞中线粒体途径的凋亡来促进肿瘤的发展[9]。IKKβ促进前列腺癌细胞的增殖和迁移,抑制其凋亡[14]。IKKβ充当某些miRNA的下游分子,以介导miRNA在不同肿瘤类型中的作用,包括miR-429和miR-497。本研究使用在线信息工具可预测IKKβ是miR-199a-5p的靶标,发现细胞系和OSCC细胞中的IKKβ水平高于HOK细胞和匹配的相邻细胞中的IKKβ水平。在肿瘤细胞中miR-199a-5p和IKKβ之间存在负相关。IKKβ的过表达逆转了miR-199a-5p在OSCC细胞中表达增强引起的抑制作用。这表明miR-199a-5p通过靶向IKKβ发挥其抗肿瘤作用。
NFK-κB是重要的核转录因子,由一个复杂的体系组成。NF-κB在肿瘤的抗凋亡机制中起着至关重要的作用。NF-κB的激活在人类几种类型肿瘤的发病机理中很重要。在OSCC中,NF-κB具有组成性活性,参与促进OSCC细胞的侵袭,这表明抑制NF-κB的活性可能构成治疗OSCC侵袭性的有前途的治疗方法。miR-92b的上调会加速肿瘤的生长,这种作用可能与OSCC中NF-κB信号通路的激活有关[20]。本研究发现miR-199a-5p的上调通过抑制IKKβ降低了关键NF-κB通路蛋白的水平。miR-199a-5p抑制IKKβ以抑制NF-κB活性,因此抑制OSCC细胞的恶性肿瘤。NF-κB与口腔鳞癌的发生、发展和侵袭密切相关。NF-κB的激活是肿瘤细胞抵抗TNF介导的细胞凋亡的重要机制,而抑制NF-κB的激活可以导致肿瘤细胞的大量凋亡。通过基因治疗来抑制NF-κB的活性,再辅以常规的化疗将有望成为一种治疗口腔鳞癌的有效方法。
综上所述,miR-199a-5p在OSCC细胞和细胞系中下调。还证明了miR-199a-5p通过抑制IKKβ发挥肿瘤抑制作用,后者抑制NF-κB途径的激活,从而抑制口腔鳞状细胞癌细胞上皮间质转化和侵袭转移。这表明,miR-199a-5p可能是预后预测和治疗策略的潜在靶标。

