颅外段椎动脉夹层的超声诊断及漏误诊原因分析
鄢磊,陈晓宇,叶小剑,阮琴韵,徐荣全
随着中青年脑卒中发病率逐年上升,临床对其日益重视,颈动脉夹层导致的脑卒中占比达20%。颈动脉夹层主要为颈内动脉夹层和椎动脉夹层(VAD)。颈动脉夹层是中青年脑卒中的常见病因,其中椎动脉夹层(VAD)是导致中青年后循环缺血的重要原因之一[1]。在中青年脑卒中中VAD的比例高达 10%~25%。2015 年中国颈部动脉夹层诊疗指南建议对年轻、尤其是无常见脑血管病危险因素的缺血性脑卒中患者进行颈动脉夹层筛查[2]。由于 VAD 的临床症状缺乏特异性,影像学成为了重要的诊断依据。2015 年中国颈部动脉夹层诊疗指南强调,目前尚无评估颈动脉夹层的单一金标准,在急性缺血性脑卒中、暂时性脑缺血发作(TIA)的患者中,尤其是中青年患者,颈部血管超声可作为筛查手段(Ⅰ类推荐,C 级证据)[2]。颈部血管超声可通过二维超声观察颅外段椎动脉的管壁厚度、腔内透声及有无斑块,通过彩色多普勒血流成像(CDFI)技术观察椎动脉血流情况以及病变近心端和远心端的频谱改变。本研究回顾性分析颅外段VAD 的超声声像图特征,探讨颅外段VAD 的超声表现和漏误诊原因。
1 资料与方法
研究对象:收集2014 年1 月至2019 年12 月我院行颈部血管超声检查并经数字减影血管造影(DSA)或计算机断层摄影血管造影(CTA)或高分辨率磁共振血管成像(MRA)检查确诊的颅外段VAD患者21 例。
仪器与方法:使用Philip IU22、GE E8 和Toshiba Apollo 500 等彩色多普勒超声仪,探头分别为9L 线阵探头(频率3.0~9.0 MHZ)和C5-2 腹部凸阵探头(频率2.0~5.0 MHZ),应用血管检查模式。患者取仰卧位,头颈部略仰伸并充分暴露颈部,常规检测双侧颈动脉、椎动脉及锁骨下动脉全程,观察颅外段椎动脉走行情况、管腔内回声,有无狭窄以及频谱形态和阻力指数。
VAD 分型方法和依据:参照刘玉梅等[3]、Robertson 等[4]和Perry 等[5]对椎动脉夹层的分类,并根据血管结构特征将VAD 分为双腔型、壁内血肿型、闭塞型和动脉瘤型四型:(1)双腔型VAD 类同经典夹层动脉病变,病变段管腔呈现真假两腔;(2)壁内血肿型VAD,病变段血管撕脱内膜下见血栓样结构填充;(3)闭塞型VAD,病变段血管可见管腔内及撕脱内膜下斑块样或血栓样结构填充;(4)动脉瘤型VAD,病变段血管内膜撕脱的同时,管壁向外呈瘤样扩张。
2 结果
2.1 一般资料
21 例颅外段VAD 患者,其中男11 例,女10 例,年龄25~67 岁,中位年龄39 岁。自发性VAD 19 例(90.48%),创伤性VAD 2 例(9.52%)。既往有高血压6 例、冠心病3 例、高脂血症6 例、吸烟者5 例。临床表现为脑梗死8 例、头晕头痛6 例、颈部疼痛4 例及无症状3 例。
2.2 病变累及部位
椎动脉的分段采用解剖学分段法[6]:V1段为横突孔前段,V2段为椎间孔段,V3段为第2 颈椎(C2,又称枢椎)横突孔与第1 颈椎(C1,又称寰椎)横突孔之间,V4为硬膜下段,其中V1段至V3段为颅外段,V4段为颅内段。本研究中单纯V1段9 例,单纯V2段2 例,10 例患者为复合病变,累及V1段至V2段或V1段至V3段。
2.3 超声结果
21 例VAD 患者具体分型:双腔型4 例(19.05%),壁内血肿型11 例(52.38%),闭塞型6例(28.57%)。超声诊断符合率约33.33%(7/21),漏误诊率约66.67%(14/21),其中5 例闭塞型VAD均误诊为单纯椎动脉闭塞,5 例壁内血肿型VAD 误诊为单纯椎动脉狭窄,2 例双腔型VAD 及2 例壁内血肿型VAD 漏诊。
具体超声所见:(1)双腔型VAD 病变段管腔内可见膜性回声将管腔分为真假两腔,真腔内血流变细明亮,假腔内血流缓慢或反向,表现为红蓝血流相间或分层血流(图1),频谱多普勒显示真腔变窄处血流速度增高,其近心段阻力指数明显增高或远心段阻力指数明显减低。(2)壁内血肿型VAD 病变段多个节段管壁增厚,累及前或后壁,也可同时累及前后壁呈现螺旋形撕裂,撕脱内膜下以低回声为多见,壁内血肿增厚明显者伴有局部真腔变细(图2),壁内血肿型真腔变窄处血流频谱变化类同双腔型。(3)闭塞型VAD 病变段管腔内可见低回声填充并中央线样膜性回声,CDFI 示管腔内未见血流信号。
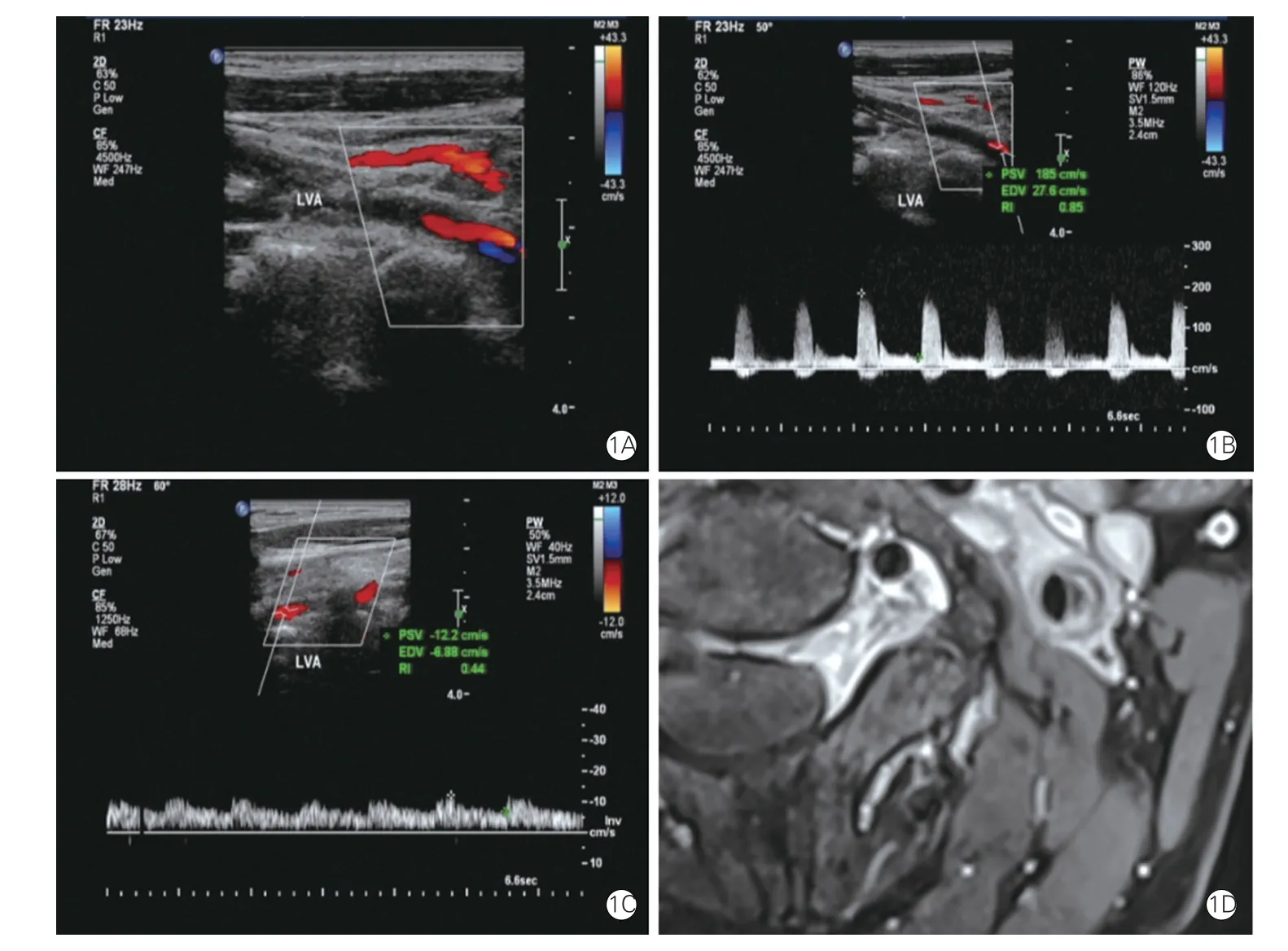
图1 一例45 岁的男性VAD 患者的超声及MRA 图像
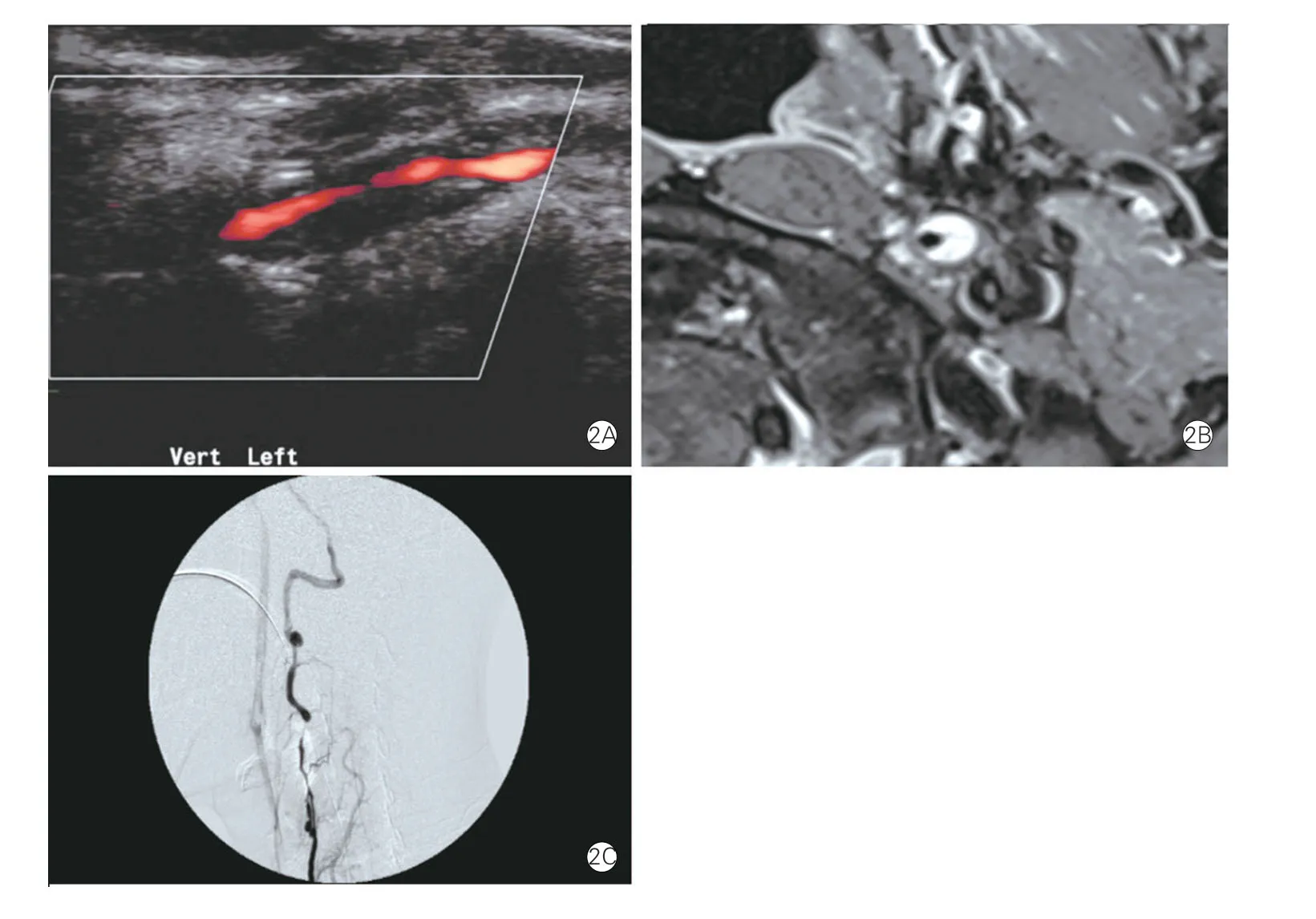
图2 一例35 岁的男性VAD 患者的超声、MRA 和DSA 图像
3 讨论
椎动脉V1至V3段位于颅外,仅需常规血管超声进行扫查,而V4 段受颅骨限制需联合经颅多普勒彩超进行扫查,故本研究主要针对颅外V1至V3段的VAD 进行分析。VAD 是导致中青年后循环缺血的重要原因之一[1]。本研究中患者的中位年龄为39 岁,其中17 例(80.95%)患者年龄≤ 45 岁。目前根据诱发原因可将VAD 分为自发性和创伤性[2],本研究中19 例为自发性。自发性VAD 多伴有快速扭头、打喷嚏、用力咳嗽、擤鼻涕、颈部按摩及某些体育活动等诱发因素[7-8]。创伤性VAD 通常由严重的钝器伤和穿透性外伤造成[5]。VAD 的临床症状缺乏特异性,以头痛、头晕或颈部疼痛多见[4],可有走路不稳,恶心、呕吐等其他后循环脑缺血症状[10],也可无任何症状。
动脉夹层病变可发生于动脉任何部位,且多为数个节段同时受累。本研究中10 例患者为多节段复合病变。Bartels 等[13]研究发现,V1段远端和V2段近端是颅外段椎动脉夹层最常见的发病部位。本研究中所有病例均累及V1段或V2段,与既往研究一致。
VAD 是由椎动脉内膜或内中膜破裂或中膜滋养动脉出血造成[14]。双腔型VAD 的形成机制为动脉内膜或内-中膜撕裂致管壁病理性分层将管腔分为真假腔,真腔血流在动脉压力下流入假腔,假腔内血流方向依据夹层撕裂口的数目而定,可以处于缓慢流动状态或反向。双腔型VAD 超声主要表现为病变段管腔内分隔真假两腔的细线样膜性回声,彩色多普勒超声表现为分层样或红蓝相间血流。本组病例中,双腔型VAD 仅4 例,其中2 例漏诊,分析其漏诊原因为夹层累及范围较局限,仅累及V2段的第2~3 颈椎间隙的椎动脉,且管腔内的内膜撕裂征象不明显,即线样膜性结构显示模糊,继而在灰阶超声判断不清的情况下,未合理调节彩色多普勒超声观察分层血流状况;此漏诊病例提示超声医师应逐节段地对椎动脉全程进行二维及彩色多普勒超声扫查,并合理调节仪器以清晰显示管腔内结构。
如果双腔型VAD 的假腔内逐渐形成血栓,即为壁内血肿型VAD,也有研究认为壁内血肿是管壁滋养血管破裂出血所致[15]。无论何种成因,壁内血肿型VAD 病变段原始管外径增宽,同时由于撕脱内膜下血栓形成,可以在超声上显示病变节段管壁的增厚,增厚管壁以低回声为多见,撕脱内膜如果呈螺旋形撕裂可以在单一长轴切面上呈现累及前后壁的“斑块状”改变,其表面可见内膜样高回声覆盖;壁内血肿增厚明显者可伴有局部真腔变窄且血流速度增高,病变段的近心段阻力指数明显增高或远心段阻力指数明显减低。本研究中壁内血肿型VAD 漏误诊7 例,其中误诊5 例,漏诊2 例。误诊的5 例壁内血肿型VAD 均诊断为单纯椎动脉狭窄,因不同病因所致的椎动脉狭窄治疗方法[16]不同,故应尽量识别壁内血肿型VAD 所致的狭窄。5 例壁内血肿型VAD 误诊的原因可能是椎动脉自身管径小,较难观察到壁内血肿表面撕裂的内膜,既往研究认为血肿表面高回声的内膜是辨别夹层的重要征象[17],但壁内血肿的“斑块状”表现与低回声斑块确实较难鉴别,即便是血池内造影成像也无法明确鉴别。2 例壁内血肿型VAD 漏诊的原因是:(1)病变部位为V3段,其解剖位置较高且被部分骨性遮挡,无法对所有患者进行清晰的超声检查;(2)超声医师未测量近心段血流频谱而无法提示远心段病变。
当壁内血肿型VAD 假腔内血肿不断增大直至堵塞真腔或导致真腔血流不畅、瘀滞、血栓形成致闭塞则形成闭塞型VAD。其超声表现与动脉粥样硬化性闭塞相似,管腔内均为实性回声填充且无血流信号,前者管腔内回声相对均匀,以低回声为主,中央可见撕脱内膜形成的线样膜性回声,同时患者年龄偏小,发病突然,其他部位血管可以不存在病理改变;后者管腔内回声相对不均匀且患者年龄较大、病史较长,其他部位血管可存在斑块或内膜增厚等病理改变。5 例闭塞型VAD 误诊的原因是:(1)超声医生询问病史不够详细,未综合考虑患者年龄因素;(2)对闭塞型VAD 特征性的超声声像图缺乏认识,未注意管腔中央有无细线样膜性回声(撕脱的内膜回声)以及未附加观察其它部位血管情况。
动脉瘤型VAD 的成因是真腔内血流在动脉压力作用下冲击薄弱的管壁使其向外瘤样扩张,有研究认为动脉瘤型VAD 常常发生在颅内段,可能是由于颅内段动脉壁较颅外段薄,肌层和外膜厚度只有颅外段动脉的2/3 且外弹力膜发育不全,滋养血管少[18]。本研究病例较少,且着重于颅外段椎动脉,因此缺乏动脉瘤型VAD 的病例观察,有待后续研究进一步完善。
总之,超声诊断颅外段VAD 有一定价值,但漏误诊率较高。线样膜性回声是识别椎动脉夹层的重要超声征象。当椎动脉内出现狭窄、闭塞及频谱异常且为年轻患者时需警惕夹层的可能。
利益冲突:所有作者均声明不存在利益冲突

