浙江地区猪圆环病毒2型检测及遗传变异分析
徐丽华,蓝胜芝,余 斌,李军星,张鹏超,李宝臣,苏 菲,袁秀芳,*
(1.浙江省农业科学院 畜牧兽医研究所,浙江 杭州 310021;2.浙江诗华诺倍威生物技术有限公司,浙江 杭州 310018)
猪圆环病毒病是由猪圆环病毒2型(porcine circovirus type 2,PCV2)引起的一种猪传染病及相关疾病综合征,主要包括仔猪先天性震颤、断奶仔猪多系统衰竭综合征、成年猪皮炎肾炎综合征、猪繁殖障碍和呼吸道疾病综合征等[1]。该病1991年首先发现于加拿大,2000年我国首次报道该病发生,现已呈全国流行,个别猪场在暴发本病时死淘率可达40%以上[2],严重阻碍了我国养猪业的发展。
PCV2属于圆环病毒科圆环病毒属,其基因组大小为1 766~1 768 bp,主要编码3个开放阅读框(open reading frame,ORF),即ORF1、ORF2和ORF3,其中ORF1和ORF3主要编码与病毒复制相关的复制酶,ORF2主要编码病毒的核衣壳蛋白(Cap)[3]。根据欧盟猪圆环病毒病委员会的分类方法,PCV2可分为PCV2a、PCV2b和PCV2c这3种基因亚型,其中PCV2c仅存在于丹麦且与猪圆环病毒病无关,PCV2a和PCV2b均已经被证实与猪圆环病毒病有关[4]。我国学者Wang等[5]对我国多个省份采集的PCV2样品进行分类鉴定和亚型区分,首次报道了国内PCV2d和PCV2e这2种基因亚型。PCV2b取代PCV2a成为优势基因型,再逐渐向PCV2d变异,说明PCV2一直处于不断变异中[6]。
本研究采用PCR方法对2018年采集自浙江省不同地区疑似PCV2感染的猪病料样品进行PCV2检测并对分离株进行全基因组克隆、转化和序列分析,以探讨浙江省PCV2的分子流行病学变化动态和变异趋势,从而为PCV2防治和免疫预防等提供一定的理论依据。
1 材料与方法
1.1 病料采集
病料采自2018年浙江杭州、嘉兴、湖州、宁波、绍兴、金华、衢州、温州、台州和丽水等地区疑似PCV2感染的猪血液、肺脏、脾脏、淋巴结等样品,保存于-70 ℃冰箱备用。
1.2 试剂和仪器
病毒基因组DNA提取试剂盒购自上海申能博彩生物科技有限公司(L0t0507);TaqDNA聚合酶、1 000 bp DNA Marker、dNTPs等均购自生工生物工程(上海)股份有限公司;胶回收试剂盒、pMD19-T载体均购自宝生物工程(大连)有限公司;无水乙醇、琼脂糖、胰蛋白胨、酵母浸出物、氨苄西林等化学试剂均为国产或进口分析纯。全自动样品快速研磨仪购自上海净信科技;凝胶成像系统和酶标仪均购自美国Bio-RAD;高速冷冻离心机购自德国Biofuge fresco。
1.3 引物设计
根据Genbank中登录的PCV2分离株的全基因序列,利用Primer Premier 5.0软件设计PCV2检测引物(PCV2)和全基因组测序引物(PCV2-1039、PCV2-867),由生工生物工程(上海)股份有限公司合成,引物序列见表1。

表1 PCR引物Table 1 Primers for PCR reaction
1.4 样品处理
从-70 ℃冰箱中取出临床病料(肺脏、脾脏和淋巴结)各0.1 g,置于Eppendorf管中,加入pH 7.0 PBS缓冲液0.5 mL,用全自动样品快速研磨仪碾磨成匀浆,离心后取上清,按照病毒DNA提取试剂盒说明书操作提取DNA模板,于-20 ℃冰箱保存。
1.5 样品PCR检测
用上述提取的病毒DNA作为模板,以F1、F2为引物,采用PCR方法检测样品中的PCV2。反应体系:上、下游引物各1.25 μL,DNA模板 2.5 μL,10× PCR Buffer 2.5 μL,dNTPs 2.0 μL,TaqDNA聚合酶0.2 μL,补足ddH2O至25 μL。反应条件:95 ℃ 5min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 45 s,35个循环;72 ℃延伸10 min。反应完成后,取5 μL PCR产物经1.2%琼脂糖凝胶电泳检测,用BIO-RAD成像系统观察拍照。
1.6 全基因组扩增、克隆及测序
选取PCV2检测阳性的样品DNA,用PCV2-1039和PCV2-867引物分别进行扩增。反应体系和反应条件同1.5。反应完成后,取5 μL PCR产物经1.2%琼脂糖凝胶电泳检测,用BIO-RAD成像系统观察拍照。将PCR产物分别进行凝胶电泳并切胶,用琼脂糖凝胶回收试剂盒纯化后,连接至pMD-18T Vector载体,转化到LB平板(氨苄青霉素抗性)。挑取单菌落,分别接种至LB溶液(氨苄青霉素抗性)中,用2对测序引物分别进行菌液PCR鉴定,鉴定正确后选取3~4个阳性克隆送生工生物工程(上海)股份有限公司测序。
1.7 序列分析
利用DNAStar软件和MEGA 6.0进化树分析软件,分别将PCV2全基因组和ORF2基因序列与GenBank中登录的16株参考毒株序列进行对比分析,推导其氨基酸序列的同源性,并绘制系统进化树。
2 结果与分析
2.1 样品PCV2检测
临床疑似病料经PCR扩增后,凝胶电泳结果显示扩增出约469 bp大小的条带,与预期片段大小相同(图1)。
2.2 临床疑似病料检测结果

M,1 000 bp DNA Marker;1~7,临床样品;8,PCV2阳性对照;9,PCV2阴性对照。M,1 000 bp DNA Marker;1-7,Clinical samples;8,PCV2 positive control;9,PCV2 negative control.图1 PCV2 PCR扩增结果Fig.1 PCR amplification of PCV2
采集的329份病料经检测,90份样品为PCV2阳性,阳性率27.4%。如表2所示,宁波、丽温台(丽水、温州、台州)地区PCV2阳性率最高,分别为52.0%和45.7%;衢州地区PCV2阳性率最低,为11.8%。

表2 浙江省不同地区疑似病料中PCV2阳性率Table 2 PCV2 positive rate of suspected diseases in different regions of Zhejiang Province
如表3所示,329份样品中,保育猪样品数最多,肥育猪样品数最少。各阶段猪样品中,肥育猪样品PCV阳性率最高,达68.8%。

表3 浙江省猪场中不同生长阶段猪群PCV2阳性率Table 3 Positive rate of PCV2 in pigs at different growth stages in Zhejiang Province
2.3 PCV2全基因组分析
从90份阳性病料中选取7份扩增PCV2全基因序列,均得到1 039、867 bp这2条条带,与预期大小相符合(图2)。
2.4 PCV2全基因组测序
将PCR产物连接转化后,进行序列测定,最后所得22个拼接序列,大小均在1 766~1 768 bp,其中有1株为1 766 bp,15株为1 767 bp,6株为1 768 bp。登录NCBI下载16个PCV2参考毒株序列(表4),并进行序列比对,结果表明22个序列均为PCV2全基因组序列。
表4 PCV2参考毒株信息Table 4 reference strain information of PCV2
2.5 PCV2全基因组核苷酸序列同源性比较
应用DNAStar软件将分离株序列与参考序列进行比对分析。结果表明,相同样品不同阳性克隆的PCV2全基因组核苷酸序列同源性为98.8%~100.0%;不同样品之间核苷酸序列同源性为93.3%~99.8%;与16个参考毒株核苷酸序列同源性为93.5%~99.8%;与疫苗猪SH(HM038027)、LG(HM038034)和SZ(AY181948)核苷酸序列同源性为93.7%~98.1%(图3)。
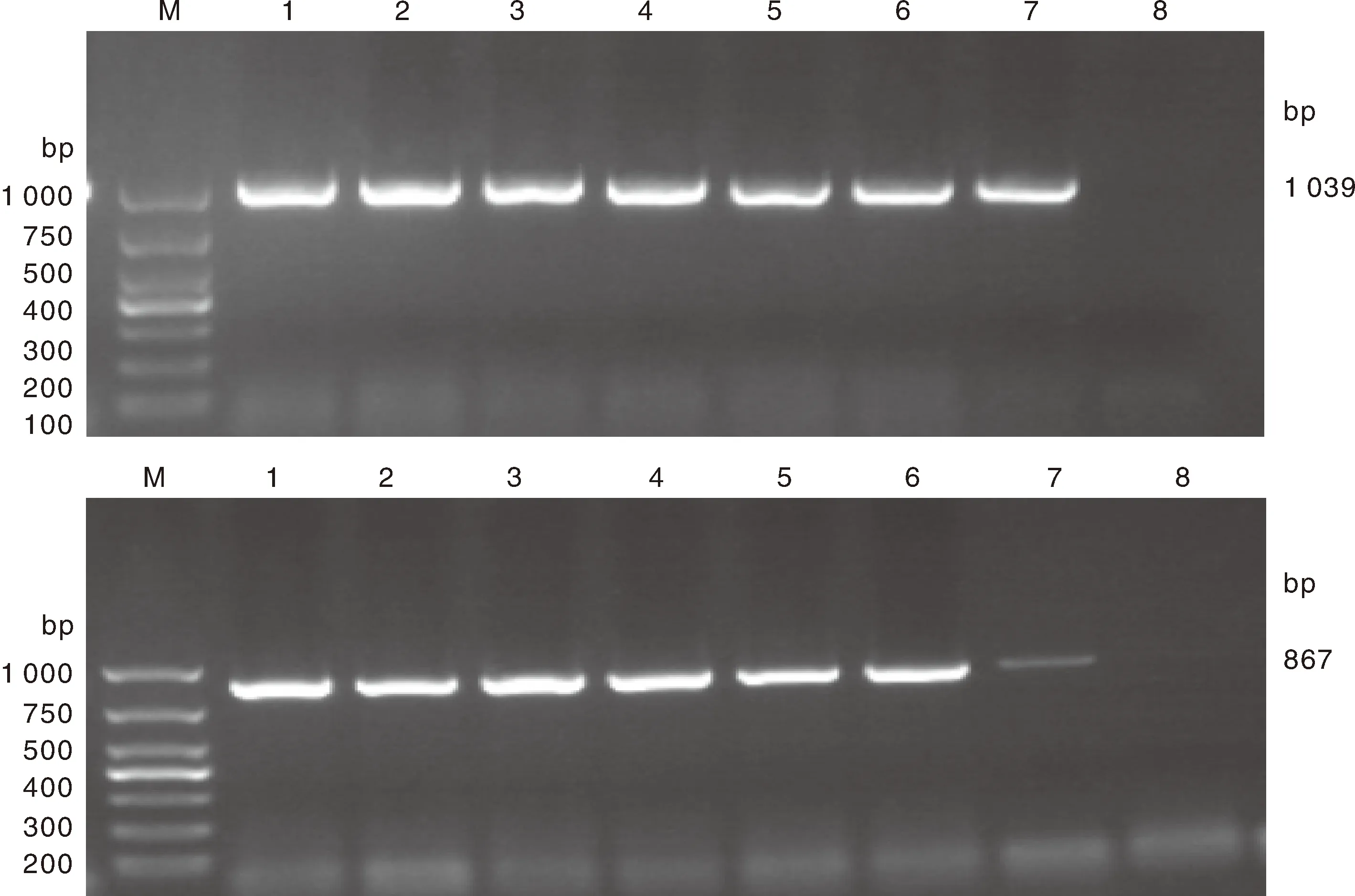
M,1 000 bp DNA Marker;1~7,临床样品;8,PCV2阴性对照。M,1 000 bp DNA Marker;1-7,Clinical samples;8,PCV2 negative control.图2 PCV2全基因组扩增结果Fig.2 PCR amplification of the whole genome
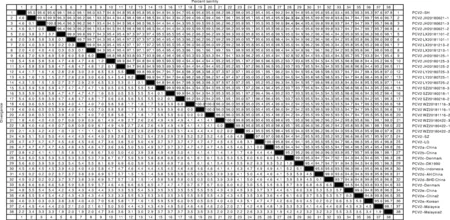
右上数据为同源性(%);左下数据为差异性(%)。The upper right data showed homology(%);the data at the bottom left showed the difference(%).图3 PCV2全基因组核苷酸序列同源性比较Fig.3 Homology comparison of nucleotide sequences of PCV2 whole genome
2.6 PCV2全基因组序列遗传进化分析
利用MEGA 6.0进化树分析软件,将22个PCV2毒株全基因组序列与GenBank中16个参考序列进行序列比对并绘制出遗传进化树(图4)。分析可知,检测到的22个PCV2毒株中,包括6株PCV2a,6株PCV2b,10株PCV2d,未检测出PCV2c和PCV2e。
2.7 PCV2各分离株ORF2基因的遗传进化树分析
PCV2ORF2基因编码PCV2 Cap蛋白,是PCV2刺激机体产生中和抗体的重要结构蛋白,也是最容易发生突变的蛋白。如图5所示,本试验22株PCV2毒株中,ORF2基因核苷酸编码705 bp的有9株,编码702 bp的有13株。序列比对分析显示,相同样品不同阳性克隆的PCV2ORF2基因核苷酸序列同源性为99.0%~100%;不同样品核苷酸序列同源性为89.6%~99.6%;与16个参考毒株核苷酸序列同源性为86.6%~99.1%;与疫苗猪SH(HM038027)、LG(HM038034)和SZ(AY181948)核苷酸序列同源性为90.5%~99.1%。系统进化树分析显示,所得序列主要分为3个分支,其中2个分支分别位于PCV2b和PCV2d参考株,亲缘关系近,另外1个分支和PCV2e参考株亲缘关系较近,这可能预示了浙江地区流行毒株正在向PCV2e转变。
3 讨论
PCV2是引起断奶仔猪多系统衰竭综合征的主要病原,也是导致其他猪呼吸道疾病和猪繁殖障碍病的病原之一,对全球养猪业造成持续性危害,给养猪户带来巨大的经济损失[7]。我国自2000年首次检测到PCV2以来,全国各省市及地区均陆续出现该病流行和暴发。
本研究对2018年浙江省不同地区329份疑似病料进行PCV2检测,阳性率为27.4%;其中宁波地区阳性率最高,达52%;衢州地区阳性率最低,为11.8%。经过回访调查,原因可能是衢州地区PCV2灭活疫苗免疫普遍,合理疫苗免疫一定程度上能阻止PCV2野毒侵袭。从不同年龄段疑似病料检测中发现,肥育猪阳性率最高,保育猪次之,仔猪最低。目前市场上PCV2疫苗均为灭活苗,一般在仔猪14日龄时免疫,保育猪能产生足够的抗体抵抗PCV2。而随着猪只日龄增长,疫苗免疫获得的PCV2抗体下降甚至消失,所以肥育猪感染率反而高于保育猪。由于肥育猪本身抵抗力较高,感染PCV2后死亡率不高,但会严重影响猪只生产性能。
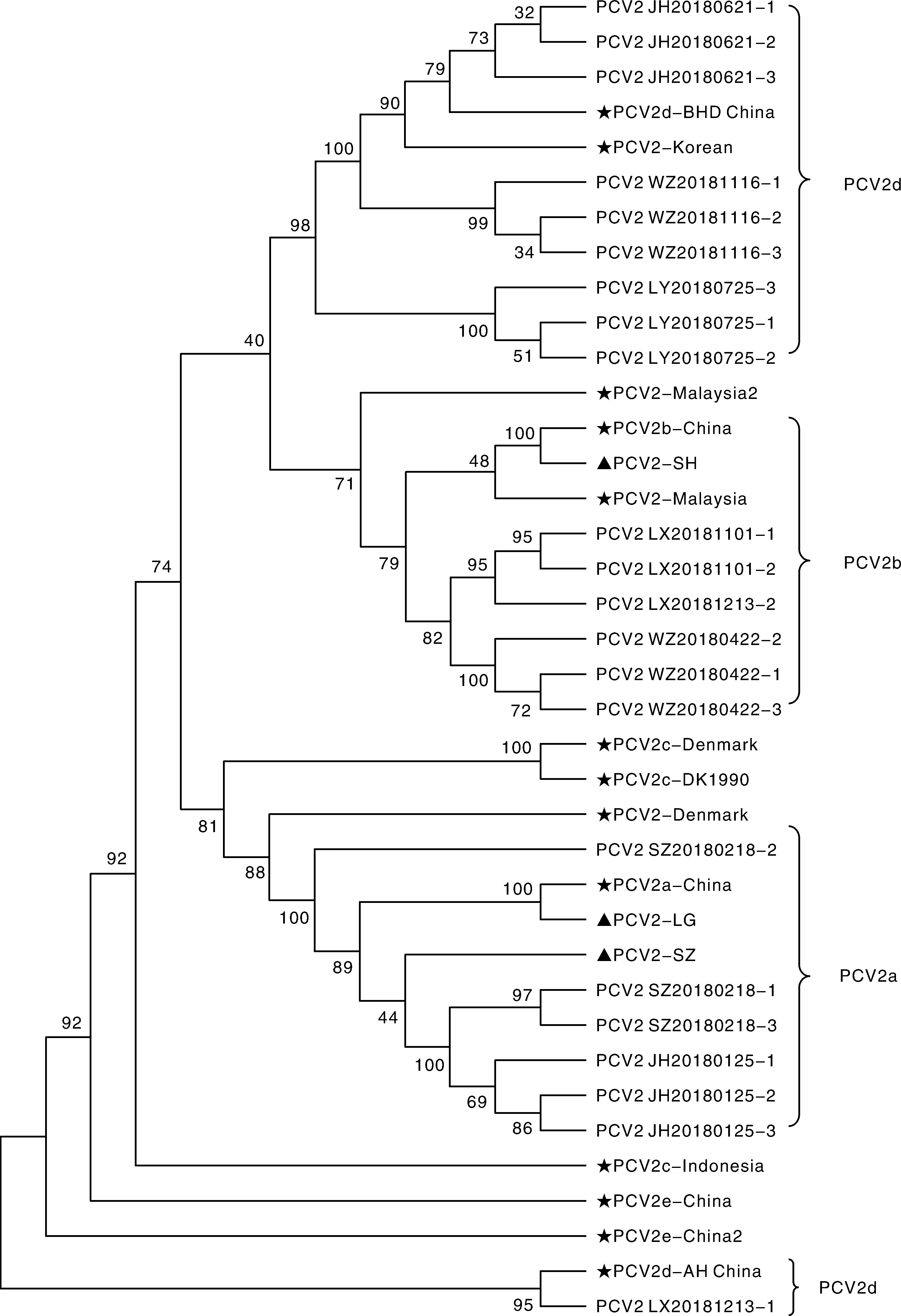
★,参考毒株;▲,疫苗毒株。★,Reference strains;▲,Vaccine strains.图4 PCV2全基因组系统进化树分析Fig.4 Phylogenetic tree analysis of PCV2 whole genome

★,参考毒株;▲,疫苗毒株。★,Reference strains;▲,Vaccine strains.图5 PCV2 ORF2基因系统进化树分析Fig.5 Phylogenetic tree analysis of ORF2 gene of PCV2 isolates
据报道,目前国内流行的PCV2基因型有PCV2a、PCV2b、PCV2d、PCV2e,而PCV2c亚型仅在丹麦发现。国内外研究表明,目前在世界范围内,PCV2流行主要以PCV2b亚型为主。在国内,主要流行毒株由PCV2b亚型逐渐向PCV2d亚型转变。本试验结果显示,2018年浙江地区PCV2a、PCV2b和PCV2d这3种亚型共存,其中PCV2d亚型成为浙江地区存在的优势毒株与吴明臻等[8]报道浙江金华地区PCV2毒株的流行已经从PCV2b亚型变为PCV2d亚型相符合。而目前国内使用的PCV2疫苗为PCV2a和PCV2b这2个亚型,针对近年来PCV2抗原的多变性,PCV2疫苗在临床上对PCV2感染后防控效果下降,从而导致PCV2临床发病率居高不下。
PCV2ORF2基因编码病毒的核衣壳蛋白(Cap蛋白),也是病毒的主要结构蛋白,主要参与宿主的免疫应答和病毒复制。不同毒株ORF2基因的同源性为86.6%~99.1%,相比全基因组序列同源性较低,表明Cap蛋白是变异较大的蛋白。Knell等[9]报道指出,PCV2基因组中ORF2基因发生突变,导致ORF2编码的Cap蛋白C末端有1个氨基酸的延伸。本试验中,22株PCV2分离株中,13株ORF2基因长度为702 bp,9株ORF2基因长度为705 bp,这9个序列C末端均有1个赖氨酸延伸,与Knell等[9]报道基本一致。赖氨酸含量与机体免疫系统活性存在一定的互作关系。因此,赖氨酸的延伸可能会影响Cap蛋白功能,从而改变病毒的致病力。

