拟除虫菊酯类农药多残留酶联免疫方法的建立
赵妍,余从田,魏新林*
1. 上海交通大学农业与生物学院(上海 200240);2. 光明食品集团(上海 200040)
拟除虫菊酯类农药是根据天然除虫菊酯的化学结构和生物活性改造得到的一类仿生农药,具有杀虫活性高、半衰期短、对哺乳动物毒性低等优点,在农业和卫生害虫防治方面得到广泛的应用[1-3]。然而,有研究表明长期低剂量摄入拟除虫菊酯对哺乳动物的神经系统、免疫系统和遗传物质具有潜在的慢性毒性效应[4-6]。因此,开发拟除虫菊酯类农药检测方法对保障消费者安全和健康具有重要意义。
目前,拟除虫菊酯类农药的检测方法主要有气相色谱法[7]、高效液相色谱法[8]、色谱-质谱联用法[9]、光谱分析法[10]和免疫分析法[11-12]等。然而,仪器分析方法存在操作复杂、成本高昂、专业要求高等问题,不能应对灵活多变的检测场景。相比较而言,酶联免疫吸附分析(ELISA)方法利用抗原抗体特异性结合的特点,灵敏度高、反应时间短、不需要专业的操作手法,对检测人员和检测场地的要求不高。此外,如果使用广谱抗体,能够识别结构相似的一类物质,可以实现多残留检测,更加适合现场大量样品的筛查。理论上,选择合适的包被抗原与相应的抗体匹配,可以提高间接竞争ELISA方法的灵敏度和检测范围。
此次试验从工作浓度、亲和常数、灵敏度和交叉反应等方面,考察不同方法制备的包被抗原与拟除虫菊酯单克隆抗体的匹配程度,并从中选择最佳包被抗原,然后对间接竞争ELISA的反应条件进行优化,最终建立拟除虫菊酯类农药的多残留酶联免疫检测方法。
1 材料与方法
1.1 仪器与试剂
拟除虫菊酯标准品(德国DR.E公司);拟除虫菊酯单克隆抗体(无锡杰圣杰康生物);3-苯氧基苯甲酸(PBA,日本TCI公司);鸡卵清蛋白(OVA)、Tween-20、明胶、3, 3’,5, 5’-四甲基联苯胺(TMB)、HRP标记的羊抗鼠IgG抗体(酶标二抗):北京索莱宝公司;其余试剂:国药公司。
ELISA试验所用缓冲溶液参考陈燕妮[13]的配方。
1.2 方法
1.2.1 包被抗原的合成与鉴定
分别采用EDC法和混合酸酐法将PBA与OVA偶联制备包被抗原[14],反应摩尔比(PBA∶OVA)为30∶1,45∶1和60∶1。将PBA、OVA和包被抗原分别进行紫外波长扫描,波长范围为200~400 nm。
1.2.2 包被抗原与抗体的亲和常数测定
按照非竞争ELISA方法[15]测定各包被抗原与抗体的Ka。将抗原和抗体分别从1和10 μg/mL开始二倍比稀释4个和8个浓度,两两交叉分布进行测定,每组设置3次平行。亲和常数(Ka)按式(1)[15]计算。

式中:n为每组数据中两个包被抗原浓度的比值,大于1;[Ab′]t和[Ab]t分别为OD450nm降低1/2时对应的抗体浓度,mol/L。
科技企业跨国并购创新绩效影响研究回顾——基于距离的视角……………………………………………………………夏 赟,张 鹏,等(2):96
1.2.3 间接竞争ELISA方法的操作过程
包被:添加包被抗原,100 μL/孔,37 ℃孵育2 h,洗涤液洗涤3次,250 μL/孔(下同)。封闭:添加封闭液,100 μL/孔,37 ℃封闭2 h,洗涤。竞争反应:先后添加适宜浓度的菊酯标准品和抗体,50 μL/孔,37 ℃孵育30 min,洗涤。酶标二抗:稀释3 000倍,100 μL/孔,37 ℃孵育30 min,洗涤。显色:配制新鲜显色液,100 μL/孔,37 ℃避光反应15 min,然后加入50 μ L/孔终止液。测定:用酶标仪测定OD450nm的值。
1.2.4 建立拟除虫菊酯标准抑制曲线
利用间接竞争ELISA方法测定不同质量浓度拟除虫菊酯的OD450nm值,检测结果用Origin软件进行四参数Logistics函数拟合,绘制标准抑制曲线,并计算抑制中浓度(IC50)。
1.2.5 拟除虫菊酯的交叉反应试验
按照1.2.4的方法分别测定其他拟除虫菊酯的IC50值,根据式(2)计算11种拟除虫菊酯类农药以及半抗原与抗体的交叉反应率(Cross-reactivity,CR)。
2 结果与分析
2.1 包被抗原的鉴定
根据拟除虫菊酯的母核结构选择PBA(化学结构见表3)作为包被半抗原。PBA、OVA和包被抗原的紫外扫描图谱如图1所示,PBA(291 nm)起到生色团作用,导致包被抗原的特征吸收波长(288 nm)与OVA(277 nm)相比出现红移现象,由此证明包被抗原偶联成功。
2.2 包被抗原的筛选
2.2.1 包被抗原与抗体最佳工作浓度的测定
采用方阵滴定法[11]测定ELISA中包被抗原与抗体的最佳工作浓度。根据间接竞争ELISA检测方法的要求,选择OD450nm值在1.2~1.5之间且抗原、抗体用量较少的浓度,作为最佳工作浓度。经过测定,抗体最佳工作浓度为0.25 μg/mL,包被抗原最佳工作浓度见表1。
2.2.2 包被抗原与抗体的亲和常数测定
Ka反映抗原与抗体结合力的大小。一般认为,当Ka值在107~1012L/mol范围时,抗体亲和力较高[16]。根据式(1)计算得亲和常数,见表1。6种包被抗原与抗体的亲和常数均大于107L/mol,表明这些人工抗原与抗体的结合能力较高。此外,用混合酸酐法制备的包被抗原与抗体的亲和力更高;并且在试验范围(30∶1,45∶1和60∶1)内,反应比越大,亲和力越高。结果如图2所示。所选有机溶剂对抗原抗体的结合有显著影响,根据体积分数的不同,存在促进或抑制结合不同的表现,其中甲醇的影响最小,与其他研究结果一致[11,17-18],所以选择甲醇作为标准品稀释液中的辅助溶剂。

图1 包被抗原紫外扫描图谱

表2 交叉反应筛选最佳包被抗原

表1 包被抗原的最佳工作浓度与亲和常数
2.2.3 交叉反应筛选最佳包被抗原
表2汇总了利用间接竞争ELISA方法初步测定11种拟除虫菊酯的交叉反应结果,使用MA2包被时能够识别8种拟除虫菊酯,在所有包被抗原中数量最多且灵敏度最高。
综合比较包被抗原的工作浓度、亲和常数、交叉反应和灵敏度,结果发现偶联方法和反应比对各指标有显著影响。与EDC法相比,混合酸酐法制备的包被抗原用量少、与抗体结合能力更强,对拟除虫菊酯的交叉反应更多,且灵敏度更高,而不同反应比得到的包被抗原指标也有差别。最终选择MA2(混合酸酐法,反应比45∶1)作为最佳包被抗原进行进一步的方法建立。
2.3 间接竞争ELISA方法的条件优化
2.3.1 标准品稀释液中有机溶剂种类及浓度的优化
拟除虫菊酯类农药在水中溶解度极小,但易溶于有机溶剂,所以需要选择适当的有机溶剂辅助溶解。用不同有机溶剂配制标准品稀释液,不添加菊酯标准品,考察常见有机溶剂对抗原抗体结合能力的影响,

图2 有机溶剂对抗原抗体结合能力的影响

图3 甲醇体积分数对间接竞争ELISA的影响
甲醇含量的影响如图3所示。中低体积分数(10%~40%)甲醇对抑制曲线和灵敏度的影响较小,高体积分数(50%~60%)甲醇会降低菊酯的抑制效果。这可能是一定体积分数的甲醇促进了菊酯的溶解和分散,过多的甲醇则破坏了抗体的蛋白结构,影响其与抗原的结合[11]。考虑到尽可能减少对反应体系的影响,甲醇添加量选择10%。
2.3.2 抗体稀释液中离子强度的优化
抗原-抗体的结合反应与二者作用时形成的盐桥和氢键有关,离子强度(即缓冲液中盐离子浓度)是一个重要的影响因素。离子强度对间接竞争ELISA的影响如图4所示。当离子强度大于或等于20 mmol/L时,抗原与抗体之间没有结合反应;当离子强度为5 mmol/L时,IC50急剧增大,灵敏度降低;而当离子强度为10 mmol/L时,抑制曲线的趋势正常,且灵敏度较高。因此,抗体稀释液的离子强度选择10 mmol/L。
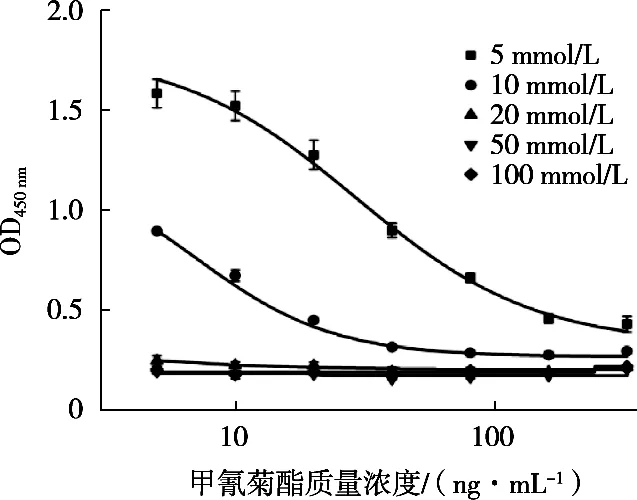
图4 离子强度对间接竞争ELISA的影响
2.3.3 抗体稀释液pH的优化
pH是影响抗原抗体结合反应的另一个重要因素,pH对间接竞争ELISA的影响如图5所示。不同pH条件下ODmax的差异较大,表明pH对抗原抗体结合能力具有较大的影响;而ODmin的差异较小,表明在pH 6.0~9.5范围内,菊酯的抑制效果相似。综合考虑两者的影响,选择对抗原抗体结合作用影响最小的pH,即pH 7.4作为抗体稀释液的pH。

图5 pH对间接竞争ELISA的影响
2.4 甲氰菊酯标准抑制曲线
在优化条件下建立间接竞争ELISA检测甲氰菊酯的标准抑制曲线,如图6所示。其IC50为8.69 ng/mL,线性检测范围(IC20~IC80)为2.65~28.55 ng/mL,检测限(IC10)为1.32 ng/mL。
2.5 间接竞争ELISA对拟除虫菊酯交叉反应率的测定
11种拟除虫菊酯以及半抗原的交叉反应结果如表3所示。建立的间接竞争ELISA方法对甲氰菊酯的灵敏度最高,对氯氰菊酯、苯醚氰菊酯、氟氯氰菊酯具有较强的交叉反应(CR>10%),对高效氯氟氰菊酯、溴氰菊酯、氟氯苯菊酯和顺式氰戊菊酯具有中等强度的交叉反应(1%<CR<10%),对氯菊酯、右旋苯醚菊酯、联苯菊酯和PBA无交叉反应。

图6 间接竞争ELISA检测甲氰菊酯标准抑制曲线

表3 拟除虫菊酯类农药的交叉反应结果
3 结论
用EDC法和混合酸酐法按不同反应比合成包被抗原,通过工作浓度、亲和常数、交叉反应和灵敏度等指标,筛选出以混合酸酐法制备,反应摩尔比45∶1的MA2为最佳包被抗原,用于检测方法的建立。经过间接竞争ELISA试验条件的优化,选择离子强度10 mmol/L、pH 7.4、甲醇含量10%作为竞争反应的最佳条件。在此基础上,建立了甲氰菊酯的标准抑制曲线,并测定11种拟除虫菊酯及半抗原的交叉反应。结果显示,该方法能同时检测8种拟除虫菊酯,灵敏度达8.69~344.97 ng/mL,能够实现拟除虫菊酯类农药的多残留检测。该方法还需要针对实际样品进行进一步的准确性评价。

