曲美他嗪对人脑血管平滑肌细胞增殖、迁移及活性氧表达的影响及其机制
代洪媛 郭海志 李小勇
脑梗死、脑出血及心肌梗死等心脑血管疾病的发病率和致残率均较高,严重威胁人们的身体健康,而动脉粥样硬化(AS)是其主要病理学基础。血管平滑肌细胞(VSMCs)是血管壁的重要组成细胞之一,其异常增殖和迁移是促进AS发生的重要机制[1];此外,AS的形成还与氧化应激反应密切相关,当活性氧(ROS)的生成大于清除时,ROS过多堆积而损伤血管内皮细胞,并促进VSMCs增殖、迁移,进而促进AS的发生[2]。曲美他嗪(TMZ)是一种哌嗪类衍生物,也是一种重要的能量代谢调节剂,可通过抑制游离脂肪酸代谢、增加葡萄糖代谢,缓解心肌缺血,在维持心肌存活和心脏功能方面发挥积极作用[3-5]。既往研究证实,TMZ能够有效延缓和改善AS[6-7],但其具体机制尚未明确。本研究通过体外细胞实验观察TMZ对人脑血管平滑肌细胞(HBVSMCs)增殖、迁移及ROS生成的影响,并探讨其可能机制,以揭示TMZ抗AS的分子机制。
材料与方法
1.材料:HBVSMCs购于中国科学院上海细胞库,TMZ购于武汉能仁医药化工有限公司,血小板衍生生长因子(PDGF)购于美国Peprotech公司。DMEM培养基和青链霉素混合液购于美国Hyclone公司,胎牛血清购于美国Gibco公司,二喹啉甲酸(BCA)试剂盒购于碧云天生物试剂公司,山羊抗兔IgG-辣根过氧化物酶购于北京中杉金桥生物公司,噻唑蓝(MTT)试剂和聚偏二氟乙烯(PVDF)膜购于美国Sigma生物试剂公司,CO2细胞培养箱购于SANYO公司,凝胶成像分析系统购于美国BIO-RAD公司,酶标仪购于美国Thermo公司,兔抗人β-连环蛋白(catenin)、原癌基因蛋白质(c-Myc)和基质金属蛋白酶(MMP)-9多克隆抗体购于武汉博士德公司,兔抗人细胞周期蛋白D1(CyclinD1)和甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体购自美国Santa Cruz公司。
2.方法
(1)细胞培养和分组:将HBVSMCs解冻复苏后接种至含10%胎牛血清和1%青链霉素混合液的DMEM培养基中,并置于5%CO2、37℃、饱和湿度的细胞培养箱中常规培养。选用生长状况良好的处于对数生长期的HBVSMCs,将其分为两部分进行实验。A实验:为探讨TMZ对HBVSMCs增殖、迁移、ROS及Wnt/β-连环蛋白(β-catenin)信号通路相关蛋白表达水平的影响,将HBVSMCs分为5组,对照组:不处理;PDGF组:加入10 ng/ml PDGF作为阳性对照;0.2 μmol/L、1.0 μmol/L和5.0 μmol/L TMZ组:在给予PDGF基础上,分别加入终浓度为0.2 μmol/L、1.0 μmol/L和5.0 μmol/L TMZ。B实验:为探讨TMZ是否可通过调控Wnt/β-catenin信号通路发挥作用,将HBVSMCs分为5组,对照组:不处理;PDGF组:加入10 ng/ml PDGF作为阳性对照;TMZ组:在给予PDGF基础上,加入予浓度为5.0 μmol/L TMZ;XAV939组:在给予PDGF基础上,加入浓度为2.0 μmol/L Wnt/β-catenin信号通路抑制剂XAV939;TMZ+XAV939组:在给予PDGF基础上,给予5.0 μmol/L TMZ和2.0 μmol/L XAV939共同处理。
(2)MTT法检测细胞增殖:将处于对数生长期的HBVSMCs(5×104个/ml)以每孔200 μl接种至96孔细胞板上,置于细胞培养箱内常规培养过夜。次日按照上述TMZ实验分组要求加入不同浓度的TMZ,其中每组设置5个平行孔,于细胞培养箱内孵育48 h后,弃培养液,每孔加入浓度为5 g/L的MTT工作液孵育4 h。再加入二甲基亚枫震荡反应至MTT结晶溶解后,使用酶标仪在450 nm处检测各组细胞的OD值。
(3)划痕实验检测细胞迁移:将浓度为105个/ml的对数生长期细胞液以每孔100 μl接种至24孔细胞板上,于培养箱内培养至80%~85%融合度。用移液枪枪头在孔中划出直径为5 mm划痕,经磷酸盐缓冲液(PBS)冲洗后,更换为含0.2 μmol/L、1.0 μmol/L和5.0 μmol/L TMZ或10 ng/ml PDGF培养液,并以不加药物的细胞作为对照。孵育24 h后,采用倒置显微镜随机选取3个视野观察各处理组细胞的迁移情况,各组细胞的迁移率=[0 h划痕距离(μm)-目标时点划痕距离(μm)]/0 h划痕距离(μm)×100%。
(4)二氯荧光素(H2DCF-DA)法检测细胞中ROS水平:将浓度为105个/ml的对数生长期细胞液以每孔200 μl接种至6孔细胞板上,常规培养过夜后,按照上述分组方法进行给药,24 h后,采用预冷的PBS洗涤3次,加入浓度为10 μmol/L H2DCF-DA溶液,避光条件下作用30 min后,使用PBS洗涤细胞3次。以0.25%胰蛋白酶消化收集各组细胞后,采用流式细胞仪检测细胞的荧光强度。将对照组细胞的荧光值设为1,处理组与对照组细胞荧光值的比值表示其他处理组细胞的荧光值。
(5)蛋白质免疫印迹法(Western blot)检测细胞中Wnt/β-catenin信号通路相关蛋白表达:采用0.25%胰蛋白酶消化收集处理48 h的0.2 μmol/L、1.0 μmol/L、5.0 μmol/L TMZ处理组和PDGF组及未处理的对照组细胞,加入细胞裂解液裂解细胞提取总蛋白。参照BCA试剂盒说明书步骤检测总蛋白的浓度。将热变性蛋白后的总蛋白按照每孔50 μg在12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶上进行电泳分离。待电泳结束后,将蛋白样品转至PVDF膜上。以0.5%脱脂奶粉封膜1.5 h后,加入1∶1 000倍稀释的特异性一抗(β-catenin抗体、CyclinD1抗体、MMP-9抗体、c-Myc抗体和GAPDH抗体)在4 ℃条件下孵育过夜。以TBST缓冲液洗膜10 min×3次后,加入1∶5 000倍稀释的IgG-辣根过氧化物酶二抗工作液室温孵育1 h。暗室内以发光剂显影后,采用凝胶成像系统扫描分析。

结 果
1.A实验中5组HBVSMCs增殖活力、迁移率、ROS及Wnt/β-catenin信号通路相关蛋白表达水平比较:对照组、PDGF组、0.2 μmol/L TMZ组、1.0 μmol/LTMZ组、5.0 μmol/L TMZ组HBVSMCs的OD值、迁移率、ROS、β-catenin、Cyclin D1、MMP-9及c-Myc表达水平比较,差异均有统计学意义(P<0.05);其中PDGF组上述指标均高于对照组,各浓度TMZ组上述指标均低于PDGF组,且呈浓度依赖性降低(P<0.05)。见图1和表1。
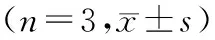
表1 A实验中5组HBVSMCs增殖活力、迁移率、ROS及Wnt/β-catenin信号通路相关蛋白表达水平比较

图1 Western blot检测HBVSMCs中Wnt/β-catenin信号通路相关蛋白的表达(A:对照组;B:PDGF组;C:0.2 μmol/L TMZ组;D:1.0 μmol/L TMZ组;E:5.0 μmol/L TMZ组)
2.B实验中5组HBVSMCs增殖活力、迁移率及ROS表达水平比较:对照组、PDGF组、TMZ组、XAV939组、TMZ+XAV939组HBVSMCs的OD值、迁移率及ROS表达水平比较差异均有统计学意义P<0.05)。PDGF组HBVSMCs增殖活力的OD值、迁移率及ROS表达水平均高于对照组(P<0.05);TMZ组、XAV939组HBVSMCs的OD值、迁移率及ROS表达水平均低于PDGF组(P<0.05);TMZ+XAV939组HBVSMCs的OD值、迁移率及ROS的表达水平均低于TMZ组(P<0.05)。见表2。
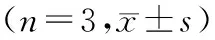
表2 B实验中5组HBVSMCs增殖活力、迁移率及ROS表达水平比较
讨 论
VSMCs异常增殖和迁移是AS发生的重要环节,PDGF是生长因子家族成员之一,可通过与特异性受体结合影响细胞内信号传导,诱导VSMCs的增殖、迁移并促进ROS的产生[8]。有研究表明,TMZ可调控肺动脉平滑肌细胞、内皮祖细胞和心肌细胞等细胞的增殖、迁移和氧化应激反应,并发挥保护心血管的作用[9]。本研究中以10 ng/ml PDGF作用于HBVSMCs后结果显示,HBVSMCs的增殖活力、迁移率及ROS的表达水平均高于对照组,而TMZ作用后可明显抑制PDGF诱导的HBVSMCs增殖、迁移和ROS表达。提示TMZ可抑制PDGF诱导的HBVSMCs增殖、迁移和ROS表达,这种抑制作用可能是TMZ改善AS恶性进展的重要机制。
Wnt/β-catenin信号通路是细胞内重要的信号转导途径,β-catenin是该信号通路的关键蛋白,游离的β-catenin进入细胞核后,通过与T细胞因子结合促进下游相关靶基因如CyclinD1、MMP-9和c-Myc激活,调控细胞增殖、迁移及凋亡等,Wnt/β-catenin信号通路与包括AS等多种疾病的发生、发展密切相关[10-12]。Wnt/β-catenin信号通路活化可促进VSMCs增殖和迁移,而抑制其活化可减弱VSMCs增殖、迁移及ROS的表达[13-14]。TMZ保护心血管的作用机制被证实与调控核因子(NF)-κB、蛋白激酶 B(AKT)和腺苷酸活化蛋白激酶(AMPK)等多种信号分子有关[15-17]。但其是否通过影响Wnt/β-catenin信号通路介导的细胞增殖和迁移而发挥作用尚未明确。本研究结果显示,TMZ作用于HBVSMCs后可明显降低其中β-catenin、CyclinD1、MMP-9及c-Myc表达水平,提示TMZ可抑制PDGF诱导的Wnt/β-catenin信号通路活化。此外,Wnt/β-catenin信号通路抑制剂XAV939与TMZ共同作用后,TMZ对PDGF诱导的HBVSMCs增殖、迁移及ROS表达的抑制作用进一步增强,提示TMZ可通过调控Wnt/β-catenin信号通路抑制HBVSMCs增殖、迁移及ROS表达。
综上所述,TMZ可以抑制HBVSMCs的增殖、迁移及ROS表达,其作用机制可能与抑制Wnt/β-catenin信号通路的活化有关,这为TMZ治疗AS提供了参考依据。

