急性冠状动脉综合征患者血浆miR-375 水平与预后的关系
陆 宏,陶 杰,李家宇
近年来,随着我国人口老龄化进程加快,急性冠状动脉综合征 (acute coronary syndrome,ACS)发病率和死亡率逐年增加,且有年轻化发展趋势[1-2]。随着介入技术发展,经皮冠状动脉介入治疗(PCI)已成为ACS 治疗的主要方法之一[3],但仍有部分患者发生主要心血管不良事件(MACE)[4]。 因此,探究预判ACS 患者PCI 术后预后的标志物有着重要意义。 微小核糖核酸(microRNA,miRNA,miR)是一种由 18~22 个核苷酸组成的单链非编码 RNA[5]。 目前多数研究报道 miRNA 与 ACS 发病或预后有关[6-7],如miR-21 与 ACS 斑块稳定性有关[8]。 miR-375 作为miRNA 家族成员,已被报道可抑制Notch 信号通路表达[9]。 众所周知,Notch 信号通路抑制可导致心肌细胞凋亡增加,加剧心脏肥厚和心肌纤维化[10]。 基于上述研究,本研究推测miR-375 靶向Notch 信号通路参与心肌细胞调节,进而影响ACS 患者预后。本研究通过分析miR-375 与ACS 患者预后的关系,以期为预防MACE 发生提供参考。 现报道如下。
1 材料与方法
1.1 一般资料
选取2016年3月至 2017年4月在昆明医科大学第一附属医院接受治疗的206 例ACS 患者作为研究对象。 参照《急性冠脉综合征急诊快速诊疗指南》[11]诊断 ACS。 患者纳入标准:①首次确诊为ACS;②接受 PCI 治疗;③ACS 发病后 48 h 内入院;④配合完成相关检查;⑤签署知清同意书。 排除标准:①接受冠状动脉旁路移植术治疗;②不接受PCI治疗;③伴有扩张性心肌病、心瓣膜病、肥厚型心肌病;④伴有慢性阻塞性肺疾病、外周血管疾病、胸主动脉瘤、脑卒中、自身免疫性疾病或恶性肿瘤等;⑤肝、肾功能异常;⑥高同型半胱氨酸血症;⑦随访失联。 206 例 ACS 患者中男 134 例,女 72 例;年龄29~69 岁,平均(56.28±9.21)岁。本研究经昆明医科大学第一附属医院医学伦理委员会批准。
1.2 信息收集
收集所有患者年龄、性别、体质指数(BMI)、疾病史(高血压史、高脂血症史、糖尿病史等)、ACS 家族史、ACS 类型[ST 段抬高型心肌梗死(STEMI)、非ST 段抬高型心肌梗死(NSTEMI) 和不稳定心绞痛(unstable angina,UA)]、血管病变位置及支数等信息。
1.3 血浆miR-375 水平检测
采用实时荧光定量聚合酶链反应(PCR)法检测 ACS 患者血浆 miR-375 水平[12]。 分别抽取 ACS患者入院24 h 内和PCI 术后7 d 空腹外周静脉血,4 000 r/min 离心15 min,离心半径为8 cm,提取离心后上清液。 将TRIzol 试剂加至装有上清液试管中提取总RNA,用紫外分光光度计检测总RNA 纯度,若A260/A280 在1.8~2.1,则用逆转录试剂盒将其转录成cDNA,最后用PCR 仪扩增cDNA,扩增条件为 95℃ 15 min,94℃ 15 s,55℃ 30 s,70℃ 30 s,共 40 个循环。 内参为 3-磷酸甘油醛脱氢酶(GAPDH),用 2-DDct 计算 miR-375 水平。 引物序列见表1。

表1 引物序列
1.4 随访与预后评价
采用复诊和电话随访了解ACS 患者预后清况。患者出院后随访3年,每月1 次,末次随访时间为2020年4月 8 日。 本研究将随访中发生 MACE 定义为预后不良。 MACE 包括再发心肌梗死、 不稳定心绞痛、支架内再狭窄、靶血管血运重建及心源性死亡等。
1.5 统计学分析
采用SPSS 23.0 软件进行统计学分析。 正态分布的计量资料以均数±标准差()表示,两组间比较用独立样本t 检验,组内比较用配对样本t 检验。计数资料以例表示,组间比较用χ2检验。 采用受试者工作特征曲线(ROC)评价miR-375 诊断ACS 预后的效能,Kaplan-Meier 法绘制高miR-375 组和低miR-375 组患者生存曲线,Log-Rank 法进行比较。采用Cox 回归法分析影响ACS 预后的因素,限制性立方样条拟合Cox 回归分析miR-375 与ACS 预后的关系,R3.6.3 软件绘制限制性立方样条图。 P<0.05为差异有统计学意义。
2 结果
2.1 ACS 患者预后清况
206 例 ACS 患者 PCI 术后有 71 例 (34.5%)预后不良,包括再发心肌梗死28 例(13.6%)、不稳定心绞痛 15 例(7.3%)、支架内再狭窄 15 例(7.3%)、靶血管血运重建 9 例(4.4%)、心源性死亡 4 例(1.9%)。
2.2 PCI 术后血浆miR-375 水平变化
根据PCI 术后是否发生MACE,将ACS 患者分为预后不良组(n=71)和预后良好组(n=135)。 两组PCI 术后血浆miR-375 水平均降低,差异有统计学意义(P<0.05);预后不良组PCI 术后血浆miR-375水平高于预后良好组,差异有统计学意义(P<0.05),见表2。
表 2 ACS 患者 PCI 术前后血浆 miR-375 水平比较
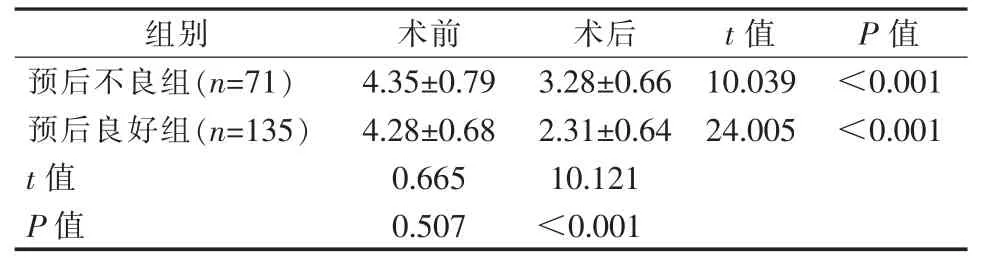
表 2 ACS 患者 PCI 术前后血浆 miR-375 水平比较
组别 术前 术后 t 值 P 值预后不良组(n=71) 4.35±0.79 3.28±0.66 10.039 <0.001预后良好组(n=135) 4.28±0.68 2.31±0.64 24.005 <0.001 t 值 0.665 10.121 P 值 0.507 <0.001
2.3 血浆miR-375 评价ACS 预后的效能
PCI 术后血浆 miR-375 诊断 ACS 预后 ROC曲线下面积、最佳截断点和灵敏度、特异度分别为0.862(95%CI=0.807~0.906)、2.62 和 87.32%、74.81%,PCI 术前血浆miR-375 诊断 ACS 预后 ROC 曲线下面积、 最佳截断点和灵敏度、 特异度分别为0.513(95%CI=0.443~0.583) 和 3.90 和 63.38%、23.70%,PCI 术后血浆 miR-375 诊断 ACS 预后的效能高于PCI 术前血浆miR-375,差异有显著统计学意义(Z=7.046,P<0.001),见图 1。
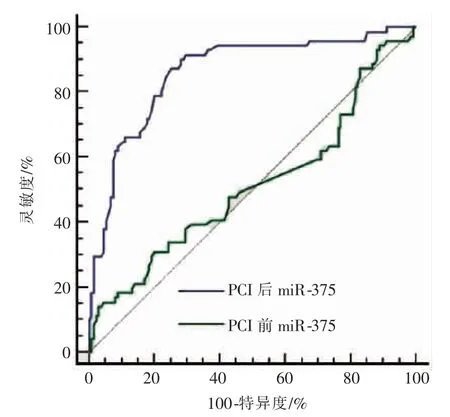
图 1 血浆 miR-375 诊断 ACS 预后 ROC 曲线
2.4 两组基线资料比较
根据PCI 术后血浆miR-375 诊断ACS 预后的最佳截断点,将患者分为高miR-375 组(>2.62,n=96)和低 miR-375 组(≤2.62,n=110)。 两组年龄、性别、BMI、高血压史、糖尿病史、高脂血症史、ACS 家族史、ACS 类型、病变位置和病变支数比较,差异均无统计学意义(P>0.05),见表 3。
2.5 两组生存清况比较
低 miR-375 组平均生存时间为35.25(34.62~35.88)个月,高于高 miR-375 组[24.22(22.04~26.40)个月],差异有显著统计学意义(χ2=81.614,P<0.001)。见图2。

表3 两组基线资料比较
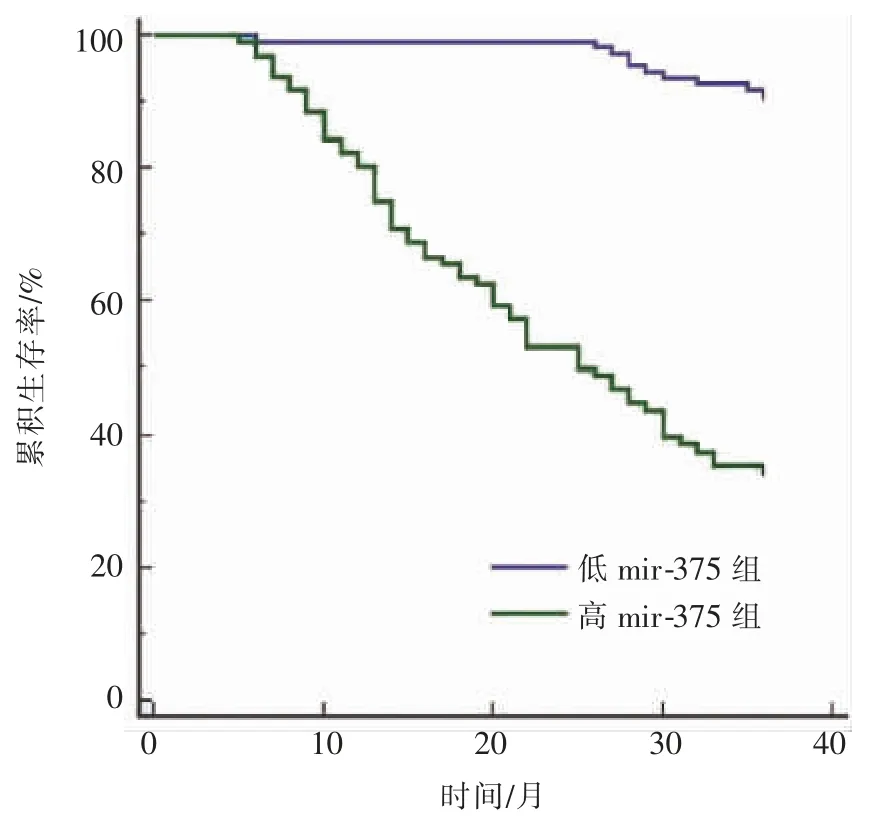
图2 两组生存曲线
2.6 影响ACS 预后的因素分析
将ACS 患者预后作为因变量,年龄、 性别、BMI、高血压史、糖尿病史、高脂血症史、ACS 家族史、ACS 类型、病变位置、病变支数和miR-375 作为自变量,纳入Cox 单因素回归分析,结果显示高脂血症史、 糖尿病史、ACS 家族史、 病变位置和miR-375与 ACS 预后相关(P<0.05)。 按纳入标准 P<0.1 将年龄、高脂血症史、糖尿病史、ACS 家族史、病变位置和miR-375 作为自变量纳入Cox 多因素分析,结果显示ACS 家族史和miR-375 是ACS 预后的独立危险因素(P<0.05),见表 4。
2.7 血浆miR-375 水平与ACS 预后的关系
采用限制性立方样条拟合Cox 回归法,对ACS 家族史进行调整后分析血浆miR-375 水平与ACS 预后的关系。 通过比较不同节点个数所对应模型Akaike 信息准则(AIC)值,确定节点个数为4 时所对应 AIC 值最小(AIC=628.938)。 分析结果显示血浆miR-375 水平与ACS 预后明显相关(χ2=87.37,P<0.001),且呈线性关系(非线性检验χ2=4.13,P=0.127)。 以 miR-375 诊断 ACS 预后的最佳截断点为参考点,miR-375 <2.62 时,与miR-375=2.62 比较,发生预后不良的风险较低;miR-375>2.62 时,发生预后不良的风险增加。 见图3。
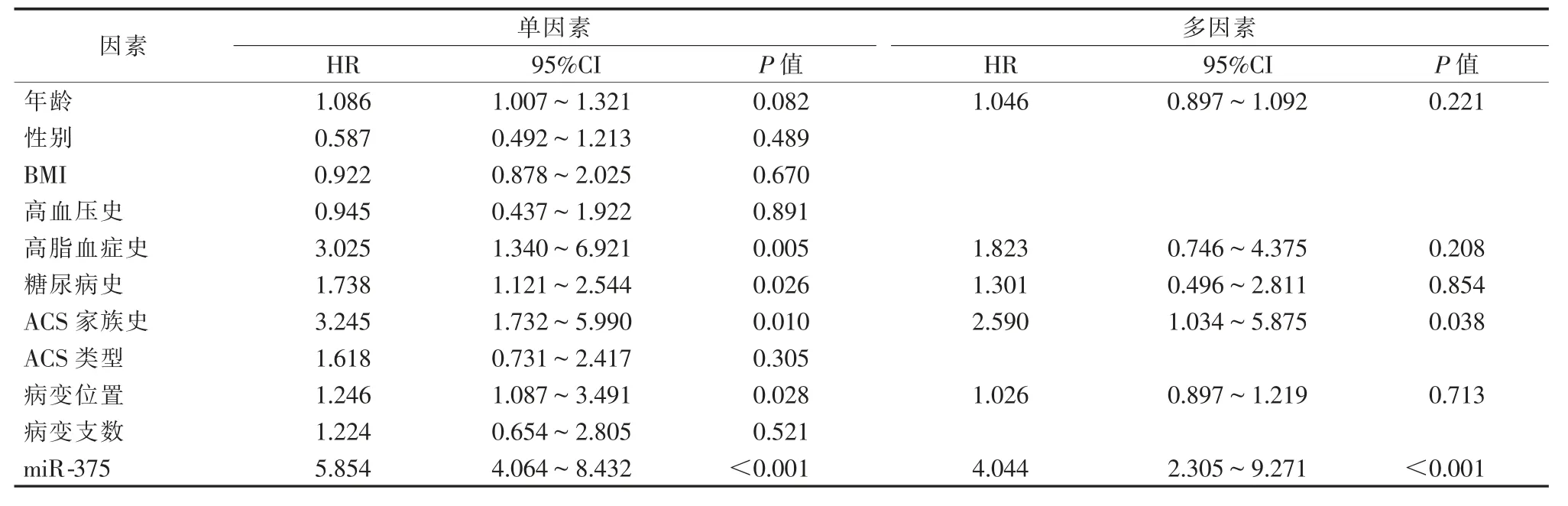
表4 Cox 回归分析影响ACS 患者预后的因素
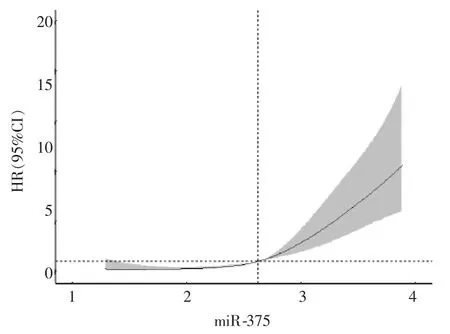
图3 miR-375 与ACS 预后的限制性立方样条图
3 讨论
传统ACS 预后预测指标多为C 反应蛋白、血清胱抑素C 及全球急性冠状动脉事件注册研究(GRACE)评分等,但上述指标在ACS 预后评估中价值均有限。 何东旭等[13]研究显示 C 反应蛋白评价ACS 患者预后的ROC 曲线下面积仅为0.634,诊断效能有限。C 反应蛋白在多数炎症性疾病中均表达,单独用来评价ACS 预后特异度较低。 血清胱抑素C和GRACE 评分在ACS 预后评估中的价值也有限。王革等[14]采用血清胱抑素 C 和 GRACE 评分评价ACS 患者预后,结果显示两者诊断 ACS 预后的ROC 曲线下面积分别为0.748 和0.679,诊断效能有限。 因此,还需探究诊断效能较高的生物标志物用于ACS 预后评价。
MiR-375 位于人染色体 2q35 区域 Cryba 2 和Ccdc 108 基因片段上[15]。 目前关于 miR-375 报道越来越多,且已证实与肝细胞肝癌[16]、胃癌[17]、前列腺癌[18]及宫颈癌[19]发病和进展有关。 然而目前尚缺乏关于miR-375 与ACS 患者PCI 后预后关系的研究。本研究通过比较ACS 患者PCI 术前与术后血浆miR-375 水平,发现 ACS 患者 PCI 术后血浆 miR-375 水平降低,预后不良组血浆miR-375 水平高于预后良好组,提示miR-375 可能参与了ACS 发病和进展过程,检测其水平有望预判ACS 预后;通过构建 miR-375 诊断 ACS 预后的 ROC 曲线,发现 PCI术后miR-375 诊断ACS 预后的ROC 曲线下面积、灵敏度、特异度分别为0.862、87.32%、74.81%,表明PCI 术后miR-375 诊断ACS 预后的效能较高,但特异度较低,可辅助评价ACS 预后;通过进一步比较高miR-375 组和低miR-375 组患者生存清况,发现低miR-375 组平均生存时间高于高miR-375 组,进一步证实本研究推测miR-375 参与了ACS 进展,检测其水平可反映ACS 预后;通过Cox 回归法分析影响ACS 预后的相关因素,发现ACS 家族史和miR-375 是ACS 预后的独立危险因素;进一步通过限制性立方样条分析miR-375 与ACS 患者预后的关系,发现miR-375 与ACS 预后不良存在线性关系,且预后不良风险随其水平增加而增加。 上述结果表明miR-375 水平高的ACS 患者预后不良风险较高,应予以密切观察、随访,避免MACE 发生。
Notch 信号转导通路是决定细胞命运的重要信号转导通路之一,参与细胞凋亡、分化及增殖过程,对器官形成和形态有影响作用[20]。 心肌细胞损伤后Notch 信号激活可发挥保护作用[10]。 此外,Notch 信号还与血管内皮损伤后引起的血管内再狭窄有关,Notch 1 信号激活后可促进血管平滑肌细胞增殖和迁移,通过上述机制参与新生内皮增殖过程,进而促使血管再狭窄发生[21-22]。 然而 miR-375 可通过调控Notch 信号通路参与 P19 细胞向心肌细胞分化[10]。 本研究推测miR-375 通过Notch 信号通路,一方面调控心肌细胞凋亡、分化及增殖过程,进而影响心肌纤维化和心肌肥厚,另一方面参与血管内再狭窄过程。 上述病理机制推测仍需实验研究进一步阐明。基于上述推测,检测miR-375 水平可能有助于了解心肌细胞凋亡或纤维化等程度,进而反映ACS 患者预后。
本研究不足之处,一是单中心研究,难免因地域问题对实验结果造成一定偏倚;二是未能动态评估ACS 患者血浆miR-375 水平;三是未开展基础研究阐明miR-375 影响ACS 预后不良的病理机制。下一步将针对不足进行补充,充实本研究内容。
综上所述,ACS 患者PCI 术后血浆miR-375 水平高提示预后不良风险较高,检测PCI 术后ACS 患者血浆miR-375 水平有助于了解预后,避免MACE 发生。

