不同腹型肥胖指标对非酒精性脂肪肝严重程度预测能力的研究
杜程钢,武强,孙红娟,赵庆凯,赵鑫萌
解放军总医院海南医院健康医学科,海南 三亚 572013
随着我国普及肝炎疫苗接种计划的成功和生活方式的改变等,非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)已经取代病毒性肝炎成为我国肝病的主要疾病[1]。NAFLD是一个常见的肝脏疾病,包括单纯性脂肪变性、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)到肝硬化的一系列疾病,单纯性脂肪变性的中重度程度更易引起肝功能异常进入NASH状态,最终发展为不可逆的肝硬化甚至肝癌[2]。NAFLD 与心血管疾病、糖尿病、慢性肾脏疾病等密切相关[2],肝脏活检是NAFLD的诊断金标准,但由于操作复杂且具有创伤性,目前临床诊断多采用肝脏彩色多普勒超声检查,简单易行的NAFLD严重程度的预测工具尤为重要。腹型肥胖与NAFLD的相关性一直是国内外学者密切关注的话题,腹型肥胖被认为脂肪分布位置更靠近肝脏,发生NAFLD 的风险更大,且与NAFLD的严重程度密切相关[3]。另有10%~15%的NAFLD发生在BMI相对正常的腹围超标人群中[4]。本研究在健康体检人群中探讨体质量指数(BMI)和3个腹型肥胖指标—腰围、腰臀比和腰高比与NAFLD 严重程度的相关性,以便临床上早期预测和干预NAFLD提供依据。
1 资料与方法
1.1 一般资料 选取2017年4月1日至2019年1月31 日在解放军总医院海南医院健康医学科体检者。纳入标准:年龄≥18岁;初次体检者;海南当地居民(常驻海南1年以上),分别来自三亚市、陵水县、海口市、万宁、琼海、乐东、东方、琼中、儋州等地区,职业为行政、企事业单位在职及退休员工、当地城镇居民等,不包括外地人员、部队官兵、本院职工,孕妇及哺乳期妇女等。排除标准:病毒性肝炎(乙肝、丙肝等),肝硬化,恶性肿瘤、未控制的心脑血管疾病,肾功能不全,器官移植者,传染性疾病(梅毒螺旋杆菌、艾滋病),自身免疫性肝病、药物性肝病,及其他遗传性疾病等。
1.2 方法
1.2.1 病史采集 体检当日由内科查体医师询问基础疾病史、吸烟史(定义为每日吸烟至少1支并持续1 年以上)和饮酒史(定义为每日男性乙醇量>20 g,女性>10 g,乙醇量换算公式:克=饮酒量(mL)×酒精含量(%)×0.8 (乙醇比重),酒精含量按照米酒和啤酒5°、红酒10°和白酒40°计算)。
1.2.2 体格检查 (1)肥胖指标:身高体质量测试仪(德国生产Seca牌)测量身高体质量并计算体质量指数(body mass index,BMI),BMI= 体 质 量(kg)/身 高2(m2);腰围(waist circumference,WC)和臀围测量时检查者双腿并拢站立位,用非弹性卷尺在肚脐上1 cm处绕腹部一周,正常呼气结束时测量得出腰围数据(cm),股骨大转子处绕臀部一周测量得出臀围(cm),计算腰臀比(waist-to-hip ratio,WHR)=腰围(cm)/臀围(cm)和腰高比(waist-to-height ratio,WHtR)=腰围(cm)/身高(cm)。(2)血压:采用全自动臂式血压计(日本爱安德株式会社,TM-2655P),测量研究者安静状态下的坐位右上臂血压,自动读数血压数值,血压异常者间隔半小时以上复测,记录两次平均值。
1.2.3 肝脏超声检查 B超检查由超声医师采用美国GE730专家版B超诊断仪,了解脂肪肝情况。
1.2.4 生化指标 抽取体检者当日清晨空腹12 h以上的静脉血3~5 mL (加抗凝),检测血清空腹血糖、糖化血红蛋白、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、肌酐、尿素氮和尿酸,均采用常规的实验室方法测定。
1.3 诊断标准
1.3.1 非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD) 参照2010 年中华医学会肝病学分会脂肪肝和酒精性肝病学组规定的临床诊断标准[5]。非酒精性脂肪肝指无饮酒史或每日男性乙醇量<20 g,女性<10 g;NAFLD 的严重程度由肝脏B 超结果为依据分为轻度、中度和重度。
1.3.2 肥胖指标 (1) BMI 超重:24.0 kg/m2≤BMI<28.0 kg/m2;BMI 肥胖:≥28.0 kg/m2;(2) WHR 升高[6]:男性>0.9,女性>0.85;(3) WC 超标[6]:男性≥90 cm,女性≥85 cm;(4) WHtR 超标[7]:腰围(cm)/身高(cm)≥0.5。
1.4 统计学方法 由专业统计人员采用SPSS21.0统计软件进行数据整理及统计分析。计量资料应用Q-Q 图进行正态性检验,符合正态分布的用均数±标准差(±s)描述,两组间比较采用t检验,多组间比较用单因素方差分析,组间两两比较如方差齐性用LSD法,方差不齐则用Tamhane's T2法,检验水准α=0.018,组间趋势检验用多项式线性检验;非正态分布的计量资料用中位数IQR (Q25-Q75)表示,两组间比较用两个独立样本的秩和检验(Mann-Whitney U 检验);计数资料用百分率%描述,采用χ2检验,组间两两比较采用Bonferroni 调整,检验水准α=0.05;Logistic 多元回归分析肥胖指标与NAFLD 相关性,采用2 个模型进行分析,模型Ⅰ为男性人群,模型Ⅱ为女性人群,以NAFLD 为因变量(0=无,1=轻度,2=中度-重度),由于重度NAFLD 例数较少,故与中度NAFLD 合并分析,将肥胖指标按照诊断标准转化为分类数据,BMI (0=无,1=超重,2=肥胖),WHR (0=无,1=超标),WHtR (0=无,1=超标),WC (0=无,1=超标)为自变量,在校正了年龄、血压、空腹血糖、糖化血红蛋白、血肌酐、血尿酸、吸烟史(0=无,1=是)后,采用基于似然比的逐步前进法进行分析。以P<0.05 为有统计学意义,所有检验均采用双侧检验。利用受试者工作特征曲线(ROC),分析男女性肥胖指标对NAFLD 不同程度的预测能力。
2 结果
2.1 不同性别体检人群的基础资料比较 研究共纳入符合纳入和排除标准、资料完整准确的体检者16 288 例,年龄18~73 岁,平均(42.365±11.47)岁;基础资料男性均高于女性,差异有统计学意义(P<0.05);该人群NAFLD 发生率为37.5% (6 101 例),男性轻度和中重度NAFLD 发生率均高于女性,差异有统计学意义(P<0.05),见表1。
2.2 肥胖指标与NAFLD 严重程度比较 男性NAFLD各组间的BMI、WHR、WHtR、WC均值及超标率比较差异均有统计学意义(P<0.05);进一步两两比较显示,NAFLD轻度组和中重度组的4个肥胖指标均值均较正常组高,且中重度组较轻度组高;趋势检验显示,NAFLD 严重程度随着肥胖指标均值的增加而增加(趋势检验α=0.017);NAFLD 轻度组和中重度组的BMI 肥胖率,WHR、WHtR 和WC 超标率均高于正常组,且中重度组高于轻度组,差异均有统计学意义(P<0.05),见表2。
表1 不同性别体检人群的基础资料比较[±s,IQR(Q25-Q75),例(%)]
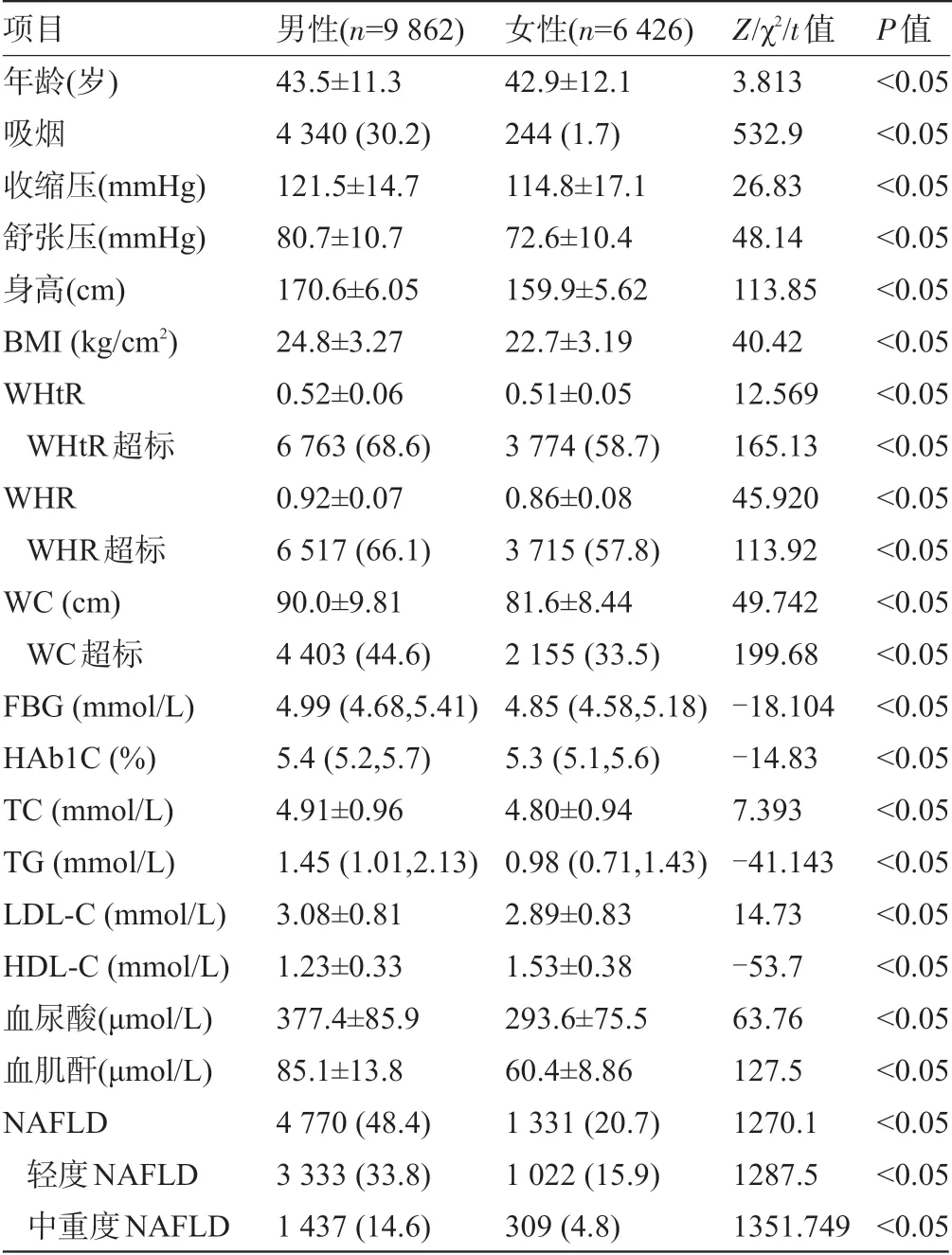
表1 不同性别体检人群的基础资料比较[±s,IQR(Q25-Q75),例(%)]
注:1 mmHg=0.133 kPa。
项目年龄(岁)吸烟收缩压(mmHg)舒张压(mmHg)身高(cm)BMI (kg/cm2)WHtR WHtR超标WHR WHR超标WC (cm)WC超标FBG (mmol/L)HAb1C (%)TC (mmol/L)TG (mmol/L)LDL-C (mmol/L)HDL-C (mmol/L)血尿酸(μmol/L)血肌酐(μmol/L)NAFLD轻度NAFLD中重度NAFLD男性(n=9 862)43.5±11.3 4 340 (30.2)121.5±14.7 80.7±10.7 170.6±6.05 24.8±3.27 0.52±0.06 6 763 (68.6)0.92±0.07 6 517 (66.1)90.0±9.81 4 403 (44.6)4.99 (4.68,5.41)5.4 (5.2,5.7)4.91±0.96 1.45 (1.01,2.13)3.08±0.81 1.23±0.33 377.4±85.9 85.1±13.8 4 770 (48.4)3 333 (33.8)1 437 (14.6)女性(n=6 426)42.9±12.1 244 (1.7)114.8±17.1 72.6±10.4 159.9±5.62 22.7±3.19 0.51±0.05 3 774 (58.7)0.86±0.08 3 715 (57.8)81.6±8.44 2 155 (33.5)4.85 (4.58,5.18)5.3 (5.1,5.6)4.80±0.94 0.98 (0.71,1.43)2.89±0.83 1.53±0.38 293.6±75.5 60.4±8.86 1 331 (20.7)1 022 (15.9)309 (4.8)Z/χ2/t值3.813 532.9 26.83 48.14 113.85 40.42 12.569 165.13 45.920 113.92 49.742 199.68-18.104-14.83 7.393-41.143 14.73-53.7 63.76 127.5 1270.1 1287.5 1351.749 P值<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05
表2 男性NAFLD不同严重程度与肥胖指标比较[±s,例(%)]
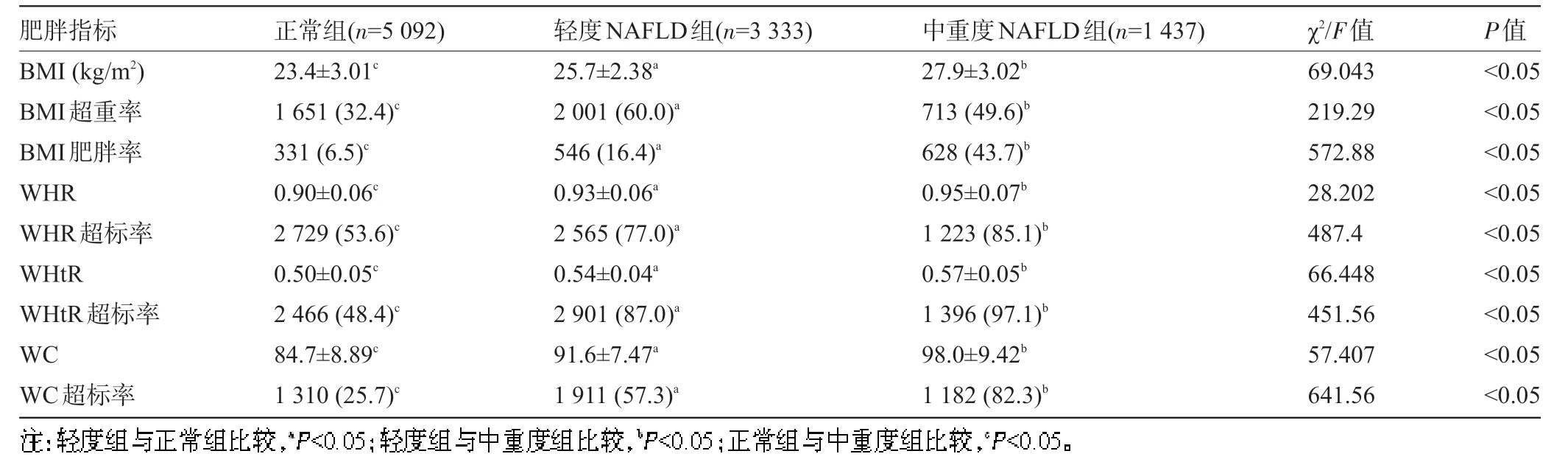
表2 男性NAFLD不同严重程度与肥胖指标比较[±s,例(%)]
images/BZ_16_242_2676_1736_2709.png
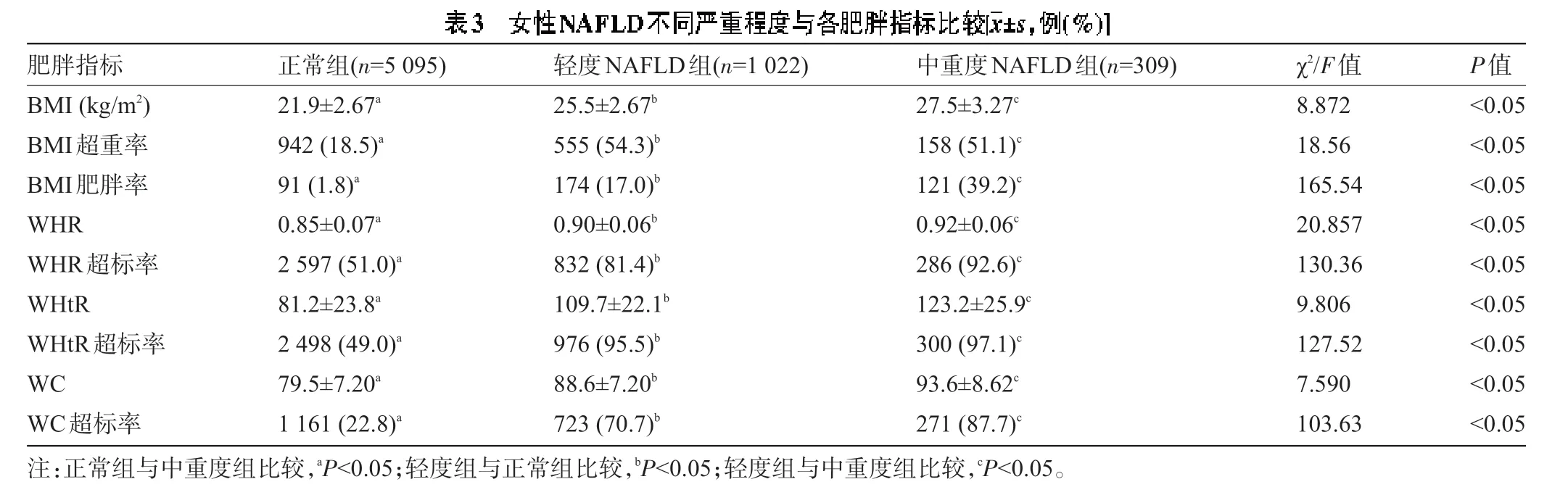
女性NAFLD不同组间的肥胖指标均值及超标率均有差异,轻度组和中重度组的BMI、WHR、WHtR、WC均值较正常组高,且中重度组高于轻度组,差异均有统计学意义(P<0.05);随着肥胖均值的增加NAFLD的程度随之加重(趋势检验α=0.017);BMI超重率和肥胖率,WHR、WHtR、和WC超标率,轻度组和中重度组均高于正常组,且中重度组高于轻度组,差异均有统计学意义(P<0.05),见表3。
2.3 肥胖与NAFLD 严重程度的Logistic 多元回归分析 Logistic 多元回归分析结果显示,调整性别、年龄、血压、血糖、血脂等因素后,轻度NAFLD的发病风险,男性为BMI肥胖、WHR超标、WHtR超标和腰围超标,BMI超重与男性NAFLD无相关性,女性的各肥胖指标异常均与轻度NAFLD 有相关性;中重度NAFLD发病风险与男女性的各肥胖指标超标均有相关性;其中腰高比超标与男女性轻度和中重度NAFLD发病风险的OR最大,男性为2.865和3.863,女性为1.475和5.084,差异有统计学意义(P<0.05),见表4。
?

表4 肥胖指标与NAFLD相关性的多因素Logistic回归分析
2.4 ROC 曲线分析肥胖指标对NAFLD 的预测价值 为进一步明确肥胖指标与NAFLD 关系,采用ROC 曲线比较各肥胖指标对轻度和中重度NAFLD的预测价值。结果显示,男女性的腰高比曲线下面积(AUC)最大,轻度NAFLD男性为0.645 (0.634~0.656),女性为0.816 (0.804~0.827),重度NAFLD男性为0.816(0.806~0.827),女性为0.882 (0.866~0.898),最大约登指数显示,腰高比对男女性轻度和中重度NAFLD 的预测价值最佳。轻度NAFLD 的切点值男性为0.51(敏感度为80.2%,特异度为47.8%),女性0.53 (敏感度为78.6%,特异度为72.7%);中重度NAFLD 的切点值男性为0.54 (敏感度为77.5%,特异度为70.6%),女性为0.55 (敏感度为85.8%,特异度为79.5%),见表5。

表5 男女性不同肥胖指标诊断NAFLD的ROC曲线
3 讨论
NAFLD、病毒性肝炎和酒精性肝病是导致我国慢性肝损伤和终末期肝病的主要因素[1],随着生活方式的改变,NAFLD患病率逐年增加,由此带来的疾病负担增长迅速,由2005 年的15%增长到2010 年的25%[8]。肥胖是NAFLD 的独立危险因素。一项Meta 分析显示,肥胖个体发生NAFLD是正常体质量的3.5倍,且存在着随体质量增加NAFLD 严重程度加重的趋势[9]。本研究结果显示,该人群的NAFLD 发生率为37.5%,包括轻度26.7%,中重度10.8%。与正常组比较,NAFLD组的BMI、WHR、WHtR 和WC 均值明显升高,且随着肥胖的增加NAFLD严重程度随之加重。目前研究认为,肥胖与NAFLD 的发病机制主要与脂肪细胞因子分泌的脂联素、瘦素、肿瘤坏死因子-α (TNF-α)等炎症介质相关。这些炎症介质通过调节肝脏脂肪积累、胰岛素抵抗(IR)和纤维化对NAFLD有明显的影响,尤其是脂联素和瘦素,被认为与NAFLD 发生发展密切相关[10]。脂联素的生理作用可以增加肝脏胰岛素敏感性,从而减少内脏脂肪蓄积,故低脂联素血症是NAFLD患者的一个显著特征[11];血清瘦素水平升高与NAFLD的严重程度及纤维化程度密切相关[12]。此外,脂肪细胞分泌的炎症介质还可以诱导游离脂肪酸的脂解产生非酯化脂肪酸和脂肪因子。内脏脂肪主要分布在大网膜、肠系膜及腹前壁等,虽然只占总脂肪量的5%~20%,但其有丰富的血供和活跃的代谢,大量的游离脂肪酸通过门静脉直接进入肝脏,加速了肝细胞脂肪变性的过程[3]。腹型肥胖与NAFLD 的相关性已得到证实[3],但腹型肥胖的3 个指标—WHR、WHtR或WC,究竟哪个与NAFLD 的相关性更强,结果仍存在争议。ZHENG等[13]在NAFLD患者和正常组的对照研究中显示,WHR 较WHtR 具有更高的诊断价值;BAYRAM 等[14]研究显示,与WC 和WHR 相比,WHtR对NAFLD 有更好的预测能力;LIN 等[15]研究显示,WHtR 是台湾社区青少年人群NAFLD 的独立危险因素,且随着WHtR 的增加NAFLD 的严重程度随之加重;PARK 等[16]前瞻性研究发现,韩国男性的NAFLD严重程度随着其腰围的增加而加重。这些研究提示,腹型肥胖对NAFLD影响的病理机制,仍然缺乏有力证据。本研究结果显示,WHtR与NAFLD的相关性更强(OR值:男性轻度2.865,中重度3.863;女性轻度1.475,中重度5.084);ROC曲线分析也显示,WHtR对NAFLD的预测价值更优于WC和WHR,结果与BAYRAM等[14]研究一致。WHtR是近年来一个判定腹型肥胖的新型指标,被认为是一个比BMI和腰围更理想的筛查心血管危险因素的测量工具[17]。由于WHtR 不受年龄、性别、地域、种族等因素影响,大大提高了临床应用价值。WHtR 是腰围与身高之比,由于成年男女性的身高较恒定,实际上WHtR 更大程度地取决于腰围的大小[7]。腰围是临床最早用于判断腹型肥胖的指标,反映的是腹部皮下脂肪和内脏脂肪之和,由于受到年龄、性别、种族等多重因素影响,诊断标准无法统一,与疾病的相关性一直受到质疑。WHtR>0.5是国际公认的腹型肥胖最佳切点值[7]。ZENG等[18]研究显示,中国人群的腰高比最佳值男性0.5,女性0.48。本研究ROC 曲线显示,WHtR 预测轻度NAFLD 切点值男性为0.51,女性为0.53,中重度NAFLD的切点值男性为0.54,女性为0.55。另外本研究显示WHR与NAFLD的相关性及预测能力最低,WHR是腰围与臀围之比,腰围是皮下脂肪和内脏脂肪之和,臀围的脂肪组织主要以皮下脂肪为主尤其是女性。有研究显示,与内脏脂肪相比较,四肢和腰臀部的皮下脂肪对动脉粥样硬化具有一定的保护作用[19]。BMI是临床应用最早最广泛的肥胖指标,本研究结果显示该人群的BMI 预测NAFLD 有较高的灵敏度。BMI作为衡量整体肥胖的指标,由于无法区分肌肉与脂肪,与NAFLD 的相关性被众多研究质疑[4]。也有研究显示,BMI 相对正常的人群发生NAFLD与基因相关[20],提示BMI可以联合WHtR提高预测NAFLD的灵敏度和特异度。
综上所述,WHtR超标是该人群发生NAFLD的高危人群,应将WHtR作为常规监测指标,并通过改善不良生活方式和采取合理膳食等关键性措施,控制WHtR超标,降低该人群的NAFLD发病风险。
本研究存在以下局限性:(1)研究方法为横断面研究,不能准确阐述腰高比与NAFLD的因果关系;(2)研究人群的腰围基线较高超标率(40.3%)高于海南地区平均水平(22.2%)[21],且以企事业单位职工为主体,结果不能完全代表自然人群;(3)由于重度NAFLD 人数较少,及缺失肝功能数据,NAFLD的严重程度的分组精确性不够;故本研究结果还需进行多中心、长周期的前瞻性队列研究进一步验证。

