牙周炎对大鼠外周血中辅助性T 细胞分群的影响
袁 芸,张洪铭,黄 慧
上海交通大学医学院附属第九人民医院·口腔医学院口腔修复科,国家口腔疾病临床医学研究中心,上海市口腔医学重点实验室,上海市口腔医学研究所,上海200011
牙周炎是发生于牙周支持组织的炎症反应,常伴发结合上皮的退缩、附着丧失、牙周袋形成,以及牙槽骨吸收。随着病变逐渐向根方发展,患牙可出现松动移位、咀嚼困难等临床表现,最终导致牙齿缺失的严重后果[1]。流行病学调查[2]显示,牙周炎在成年人中的患病率高达90%,是我国成年人失牙的首要原因。
牙周致病菌主要包括牙龈卟啉单胞菌、福塞坦菌、伴放线聚集杆菌等[3-4]。这些病原菌及其毒素在入侵牙周组织时,可激活局部免疫环境中的固有免疫应答和特异性免疫应答。其中,辅助性T(helper T, Th)细胞介导的细胞免疫应答是特异性免疫应答的重要组成部分。根据Th 细胞在炎性疾病中的作用,可将其分为Th1、Th2、Th17 及调节性T(T-regulatory, Treg) 4 种细胞亚型[5]。这4 种细胞通过分泌不同的细胞因子来介导牙周炎局部的组织损伤。Th1 细胞主要分泌细胞因子干扰素-γ(interferon-γ,IFN-γ);Th2 细胞主要分泌白细胞介素-4(interleukin-4,IL-4);Th17 细胞产生的细 胞因子以IL-17A 为 主;Treg细胞主要产生IL-10[6-7]。研究[8]表明,在牙周炎病损处,IFN-γ 浓度升高,IL-10 的表达量降低,且在重度牙周炎和急性进展性牙周炎患者中更加明显。IL-17A 在牙周炎患者牙龈组织和龈沟液中的表达水平均高于正常对照 组[9]。
牙周致病菌在激活局部免疫应答的同时,也引起全身免疫应答。有学者发现慢性牙周炎患者与正常人相比,外周血中Th1、Th17 及Treg 细胞的比例明显升高[10-11]。类似的现象也出现在模型动物中,IFN-γ 在实验性牙周炎大鼠外周血清中的表达显著升高,Th17 细胞、Treg 细胞及两者的比值在牙周炎大鼠外周血中也明显升高[12-13]。但是,也有学者[14-15]认为在牙周炎患者与正常人外周血中,Th17细胞并无明显变化,且IL-17A+T 细胞、IFN-γ+T 细胞均无明显变化。目前,关于牙周炎对全身免疫环境中Th 细胞分群的影响尚无一致定论。因此,本研究通过建立大鼠牙周炎模型,对比牙周炎与健康大鼠外周血中Th 细胞各亚群的比例,探讨牙周炎对外周血中Th 细胞分群的影响,为牙周炎的免疫学研究提供依据。
1 材料与方法
1.1 主要试剂及仪器
RPMI1640 培养液(Sigma 公司,美国),胎牛血清(浙江天杭生物科技股份有限公司),杜氏磷酸盐缓冲液(Dulbecco's phosphate buffered saline,DPBS;江苏凯基生物技术股份有限公司);FITC 标记的CD3、BUV395标记的CD4、BV480 标记的CD8、BV421 标记的CD25、AF647 标记的IFN-γ、PE 标记的IL-4 抗体、APC-CY7 标记的死活染料、抗原封闭剂、刺激剂/蛋白转运抑制剂、破胞膜剂、红细胞裂解液、缓冲液、流式细胞仪,均购自美国BD 公司;PE-Cyanine 标记的IL-17A、PE-eFluor 标记的叉头状螺旋转录因子3(transcription factor forkhead box P3,Foxp3)抗体、破核膜剂,均购自美国eBioscience 公司;细胞培养箱购自美国Thermo 公司,显微CT 扫描仪(micro-CT Skyscan1176)购自比利时布鲁克公司。
1.2 牙周炎动物模型的建立
6 周龄SPF 级SD 雄性大鼠10 只,由上海交通大学医学院附属第九人民医院动物实验中心提供,体质量为(180±20)g,无牙周疾病,健康状况良好。将大鼠随机分为牙周炎组和对照组,每组各5 只。牙周炎组:称重后以1%的戊巴比妥钠溶液腹腔注射麻醉大鼠(0.6 mL/100 g),分离双侧下颌第一磨牙(M1)颈部牙龈组织,采用3-0缝合线结扎M1 牙颈部,每日检查结扎丝,如有松动则重新结扎。对照组:大鼠麻醉后分离牙龈,不结扎,其余均与牙周炎组相同。实验期间给予实验动物清洁饲料和纯净水,按时更换垫料,环境温度25 ℃,光照12 h/d。术后2 周,采用牙周探针分别检查牙周炎组与对照组大鼠下颌M1 牙周状况,记录探诊深度。实验获得上海交通大学医学院附属第九人民医院实验动物伦理委员会审批(批准号HKDL-2017-249)。
1.3 牙槽骨吸收高度的测量
处死大鼠,每组随机选择3 只,取下颌骨,去除软组织,经4%多聚甲醛固定24 h 后,进行显微CT 扫描检测。扫描参数设置为:电压65 kV,电流280 μA,1.0 mm 铝箔过滤,旋转步长0.55°,像素为18 μm×18 μm×18 μm。扫描后利用NRecon 软件进行三维重建。选取M1 颊侧近中、中间、远中及舌侧近中、中间、远中,共6 个位点,测量釉牙骨质界(cementoenamel junction,CEJ)至牙槽嵴顶(alveolar bone crest,ABC)的垂直距离(CEJ-ABC)作为牙槽骨吸收高度。每个样本测量3 次,取平均值作为最终结果。
1.4 Th 细胞各亚群的流式细胞术检测
1.4.1 外周血采集 采用心脏采血法获取大鼠外周血,将外周血收集至含有EDTA-K2 抗凝剂的采血管中。取1.0 mL 外周血用于Th1、Th2 及Th17 细胞流式细胞术检测,另取1.0 mL 外周血用于Treg 细胞流式检测。
1.4.2 Th1、Th2、Th17 细胞样本制备 将1.0 mL 外周血加入到六孔板中,每孔中加入1.0 mL 含10%胎牛血清、1%双抗的RPMI1640 培养液及2 μL 刺激剂/蛋白转运抑制剂,培养4 ~6 h(37 ℃,5% CO2)。红细胞裂解液去除红细胞,DPBS 重悬,转移至流式管中,死活染料染色,缓冲液清洗2 次,抗原封闭,用FITC 标记的CD3及BV480 标记的CD8 抗体进行胞外因子染色。经破胞膜剂固定破膜后,用AF647 标记的IFN-γ、PE 标记的IL-4、PE-Cyanine 标记的IL-17A 抗体进行胞内因子染色。缓冲液洗涤重悬,上机检测。
1.4.3 Treg 细胞样本制备 按1.4.2 中的方法去除红细胞、死活染料染色、抗原封闭。用FITC 标记的CD3、BUV395 标记的CD4 及BV421 标记的CD25 抗体进行胞外因子染色。经破核膜剂固定破膜后,用PE-eFluor 标记的Foxp3 抗体进行核内因子染色。缓冲液洗涤重悬,上机检测。
1.4.4 流式细胞术分析 利用FlowJo 10.5.3 软件分析Th1、Th2、Th17、Treg 细胞的比例。
1.5 统计学方法
采用Graphpad Prism 8.0 软件包进行数据分析。定量数据以x—±s 表示,定性数据以n(%)表示。牙槽骨吸收高度及Th1、Th2、Th17、Treg 细胞的百分比在2 组之间的比较均采用独立样本t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 牙周探诊
牙周探诊结果见图1,结果显示:牙周炎组大鼠下颌M1 周围牙龈组织红肿,颊侧牙龈明显增生,探诊深度约为1.0 mm。对照组大鼠下颌M1 周围牙龈组织呈淡粉色,未见明显肿胀、增生,探诊深度小于0.5 mm。
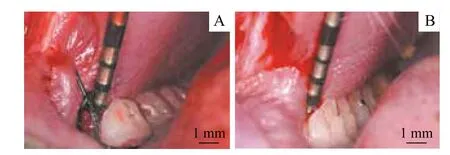
图1 牙周探诊结果Fig 1 Results of periodontal probing
2.2 牙槽骨吸收高度
牙槽骨吸收高度测量结果见图2。颊侧近中CEJ-ABC在牙周炎组和对照组中分别为(1 271.0±59.2)μm 和(833.7±59.2)μm,牙周炎组高于对照组,差异有统计学意义(P=0.006);颊侧中间CEJ-ABC 在牙周炎组和对照组中分别为(1 303.7±23.8)μm 和(870.3±40.8)μm,牙周炎组高于对照组,差异有统计学意义(P=0.001);颊侧远中CEJ-ABC 在牙周炎组和对照组中分别为(1 019.7±62.8)μm 和(442.0±12.1)μm,牙周炎组高于对照组,差异具有统计学意义(P=0.001)。舌侧近中CEJ-ABC在牙周炎组和对照组中分别为(1 084.0±13.0)μm 和(931.3±84.3)μm,牙周炎组高于对照组,但差异无统计学意义(P=0.148);舌侧中间CEJ-ABC 在牙周炎组和对照组中分别为(987.7±18.2)μm 和(769.7±58.1)μm,牙周炎组高于对照组,差异有统计学意义(P=0.023);舌侧远中CEJ-ABC 在牙周炎组和对照组中分别为(885.7±15.6)μm 和(696.0±27.2)μm,牙周炎组高于对照组,差异有统计学意义(P=0.004)。牙槽骨吸收高度测量结果表明,牙周炎组M1 颊舌侧牙槽骨均发生明显吸收。
2.3 流式细胞术检测结果
流式细胞术检测结果见图3。Th1 细胞在牙周炎组大鼠外周血中的比例明显高于对照组(P=0.002),Th17 细胞在牙周炎组大鼠外周血中的比例也明显升高(P=0.028);而Treg 细胞在牙周炎组大鼠外周血中的比例明显降低(P=0.002);Th2 细胞在牙周炎组大鼠外周血中的比例也低于对照组,但差异无统计学意义。
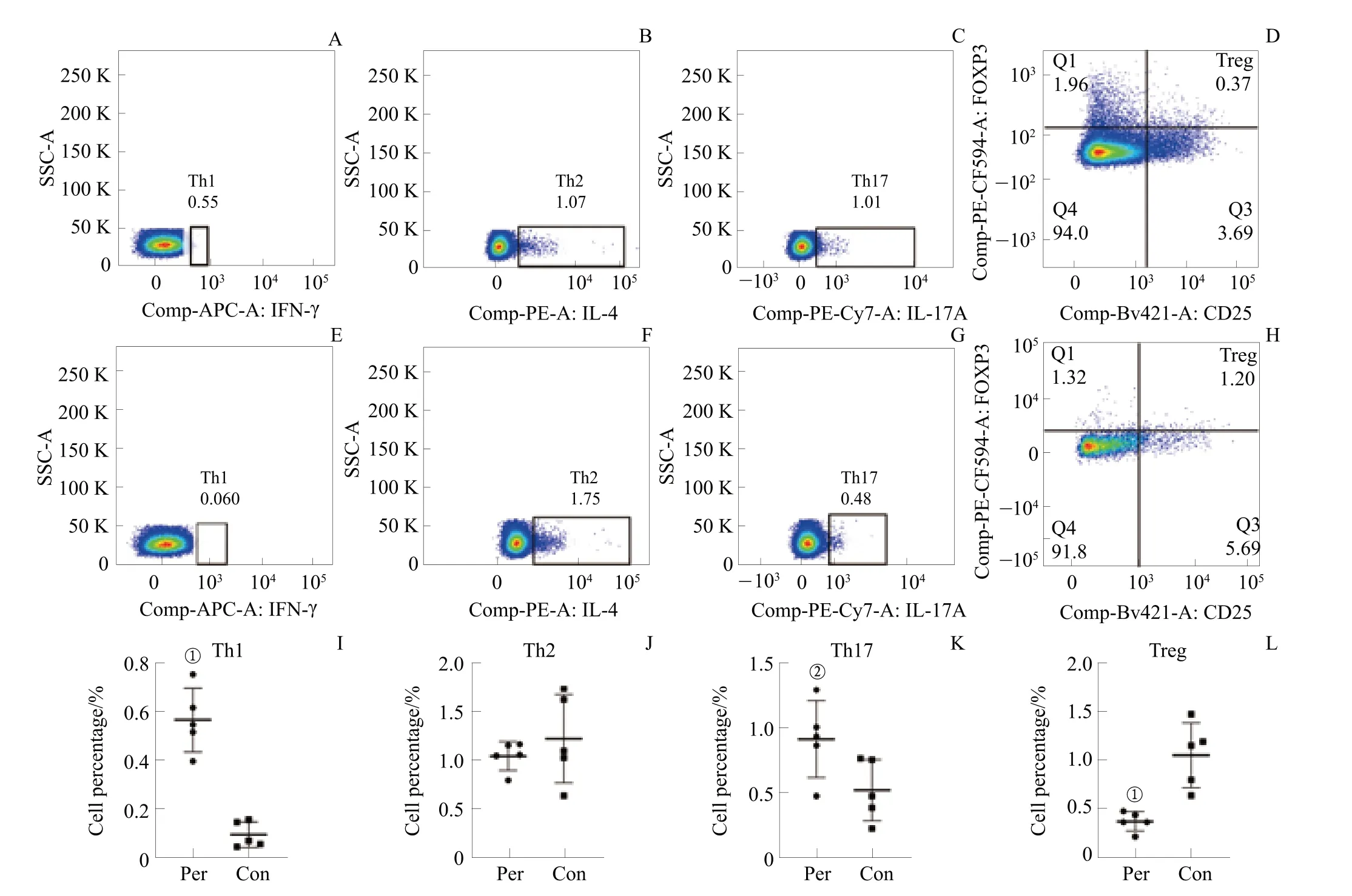
图3 流式细胞术检测结果Fig 3 Results of flow cytometry
3 讨论
牙周炎是以牙龈红肿、牙周袋形成、牙槽骨吸收为典型临床表现的慢性炎症破坏性疾病。本研究采用大鼠下颌第一磨牙牙颈部结扎的方法建立实验性牙周炎大鼠模型。术后2 周,牙周炎组大鼠出现牙龈红肿、探诊出血,颊侧探诊深度达1.0 mm;而对照组大鼠未见牙龈红肿出血,探诊无牙周袋形成,颊侧探诊深度明显小于牙周炎组。牙槽骨吸收高度测量结果显示,除了舌侧近中CEJ-ABC 在2组间无明显差异外,牙周炎组在其余5 个位点的测量值均显著高于对照组,表明牙周炎组M1 周围牙槽骨发生明显吸收。以上结果表明,结扎第一磨牙牙颈部2 周可诱导形成实验性牙周炎大鼠模型。
牙周致病菌及其代谢产物激活病变局部的单核细胞、巨噬细胞,产生大量促炎性细胞因子,如白细胞介素-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)和前列腺素E2 等[16]。这些细胞因子可通过血液循环进行扩散,从而引起外周血中Th 细胞分群的改变。本研究通过流式细胞术检测实验性牙周炎大鼠与对照组大鼠外周血中Th 细胞各亚群的比例,结果发现牙周炎组大鼠外周血中促炎型Th1、Th17 细胞的比例升高,炎症调节型Treg细胞的比例降低。
然而,关于牙周炎对外周血中Th 细胞分群的影响,目前尚无一致结论。王琳源等[17]采用口腔涂抹牙龈卟啉单胞菌的方法建立小鼠牙周炎模型,4 周后检测发现牙周炎小鼠外周血中Th17 细胞在总CD4+T 细胞中的比例和数量显著高于对照组,且牙周炎组IL-17A 的表达增加。Chen 等[10]对68 例慢性牙周炎患者和43 例健康者外周血样本进行检测,发现牙周炎患者外周血中Th1 和Th17 细胞的比例明显高于健康者。Gao 等[13]采用牙周结扎+涂抹牙龈卟啉单胞菌的方法建立大鼠牙周炎模型,通过流式细胞术发现牙周炎大鼠外周血中Th17 细胞比例升高,且Th17 与Treg 细胞的比值升高。而Sabarish 等[11]研究发现,慢性牙周炎患者外周血中Treg 细胞的比例明显高于健康者;Cheng 等[18]研究发现牙周炎患者与健康者相比,外周血中Th17 及Treg 细胞的比例未见明显变化,并认为牙龈局部的炎症反应不会引起血液中主要的免疫细胞亚群发生改变。以上研究结果存在差异的原因可能有:①实验动物的物种差异,大部分动物实验均发现牙周炎能显著影响啮齿类动物外周血中Th 细胞的分群,而临床研究结果的差异性较大。②病变程度不同,早、中、晚期牙周炎可能对外周血中Th 细胞的分群产生不同的影响。③个体差异,牙周炎引起的T 细胞免疫反应在不同个体之间的程度不同。
既往研究[19]认为Th1 细胞是造成牙周炎中牙周支持组织损伤的主要细胞,Th1 细胞通过分泌IFN-γ、TNF 等促炎性细胞因子破坏牙周组织。IFN-γ 可以提高黏附因子和趋化因子的含量,促使炎症细胞向感染部位聚集,在牙周炎症反应、骨吸收、附着组织丧失上都起着重要的作用[8]。近年来研究发现Th17 细胞的浸润与牙周炎的病变轻重有着密切关系,IL-17A 水平升高在炎症过程中起到重要作用,牙周炎组织的破坏缘于IL-17A 分泌增加[20-21]。Th2 细胞通过分泌IL-4 抑制T 细胞向Th1 细胞分化,抑制巨噬细胞的功能,抑制破骨细胞的生成,控制炎症的进展[22]。Treg 细胞能通过接触或分泌IL-10 和转化生长因子抑制T 细胞的增殖和活化,对自身免疫性疾病和炎症反应起负调控作用。因此,目前认为Th1 和Th17 细胞是主要的促炎型Th 细胞亚群,而Th2 和Treg 细胞是主要的炎症调节型Th 细胞亚群。
综上,本研究结果表明,牙周炎可促进大鼠外周血中促炎型Th 细胞亚群的分化,抑制炎症调节型Th 细胞亚群的分化。而牙周炎引起Th 细胞各亚群比例变化的具体作用机制,仍有待进一步阐明。
参·考·文·献
[1] Hajishengallis G. Periodontitis: from microbial immune subversion to systemic inflammation[J]. Nat Rev Immunol, 2015, 15(1): 30-44.
[2] 李昆蔓, 代静, 任静, 等. CD4 阳性T 淋巴细胞亚群与牙周炎的关系[J]. 中华口腔医学研究杂志(电子版), 2017, 11(3): 178-183.
[3] Leira Y, Iglesias-Rey R, Gómez-Lado N, et al. Porphyromonas gingivalis lipopolysaccharide-induced periodontitis and serum amyloid-β peptides[J]. Arch Oral Biol, 2019, 99: 120-125.
[4] Zhang LP, Gao L, Xu CR, et al. Porphyromonas gingivalis lipopolysaccharide promotes T- helper 17 cell differentiation from human CD4+naïve T cells via toll-like receptor-2 in vitro[J]. Arch Oral Biol, 2019, 107: 104483.
[5] Chen TH, Arra M, Mbalaviele G, et al. Inflammatory responses reprogram TREGS through impairment of neuropilin-1[J]. Sci Rep, 2019, 9(1): 10429.
[6] Bunte K, Beikler T. Th17 cells and the IL-23/IL-17 axis in the pathogenesis of periodontitis and immune-mediated inflammatory diseases[J]. Int J Mol Sci, 2019, 20(14): 3394.
[7] Bi CS, Sun LJ, Qu HL, et al. The relationship between T-helper cell polarization and the RANKL/OPG ratio in gingival tissues from chronic periodontitis patients[J]. Clin Exp Dent Res, 2019, 5(4): 377-388.
[8] Garlet GP, Martins Jr W, Ferreira BR, et al. Patterns of chemokines and chemokine receptors expression in different forms of human periodontal disease[J]. J Periodontal Res, 2003, 38(2): 210-217.
[9] Ohyama H, Kato-Kogoe N, Kuhara A, et al. The involvement of IL-23 and the Th17 pathway in periodontitis[J]. J Dent Res, 2009, 88(7): 633-638.
[10] Chen XT, Chen LL, Tan JY, et al. Th17 and Th1 lymphocytes are correlated with chronic periodontitis[J]. Immunol Invest, 2016, 45(3): 243-254.
[11] Sabarish R, Rao SR, Lavu V. Natural T regulatory cells (n treg) in the peripheral blood of healthy subjects and subjects with chronic periodontitis: a pilot study[J]. J Clin Diagn Res, 2016, 10(3): ZC36-ZC39.
[12] 王中秀, 杨岚, 谭静怡, 等. 辅助性T 细胞1 和17 细胞特征性分泌因子在大鼠实验性牙周炎模型中的表达及意义[J]. 中华口腔医学杂志, 2017, 52(12): 740-746.
[13] Gao L, Zhao YJ, Wang PP, et al. Detection of Th17/Treg cells and related factors in gingival tissues and peripheral blood of rats with experimental periodontitis[J]. Iran J Basic Med Sci, 2017, 20(3): 294-300.
[14] Suárez LJ, Vargas DE, Rodríguez A, et al. Systemic Th17 response in the presence of periodontal inflammation[J]. J Appl Oral Sci, 2020, 28: e20190490.
[15] Okada K, Fujimura T, Kikuchi T, et al. Effect of interleukin (IL)-35 on IL-17 expression and production by human CD4+T cells[J]. PeerJ, 2017, 5: e2999.
[16] Ramadan DE, Hariyani N, Indrawati R, et al. Cytokines and chemokines in periodontitis[J]. Eur J Dent, 2020, 14(3): 483-495.
[17] 王琳源, 关宁, 林晓萍. 辅助性T17细胞在牙周炎小鼠中的免疫状态研究[J]. 华西口腔医学杂志, 2015, 33(2): 125-129.
[18] Cheng WC, Saleh F, Abuaisha Karim B, et al. Comparative analysis of immune cell subsets in peripheral blood from patients with periodontal disease and healthy controls[J]. Clin Exp Immunol, 2018, 194(3): 380-390.
[19] Taylor JJ. Cytokine regulation of immune responses to Porphyromonas gingivalis[J]. Periodontol 2000, 2010, 54(1): 160-194.
[20] Dutzan N, Kajikawa T, Abusleme L, et al. A dysbiotic microbiome triggers TH17 cells to mediate oral mucosal immunopathology in mice and humans[J]. Sci Transl Med, 2018, 10(463): eaat0797.
[21] Cheng WC, Hughes FJ, Taams LS. The presence, function and regulation of IL-17 and Th17 cells in periodontitis[J]. J Clin Periodontol, 2014, 41(6): 541-549.
[22] Palmqvist P, Lundberg P, Persson E, et al. Inhibition of hormone and cytokinestimulated osteoclastogenesis and bone resorption by interleukin-4 and interleukin-13 is associated with increased osteoprotegerin and decreased RANKL and RANK in a STAT6-dependent pathway[J]. J Biol Chem, 2006, 281(5): 2414-2429.

