糖尿病足溃疡相关基因与免疫细胞特征分析
周 晗,杨晓笙,廖陈龙,张文川
上海交通大学医学院附属第九人民医院神经外科,上海 200011
2019 年,约有4.63 亿成年人患糖尿病(diabetes mellitus,DM),这一数字在2045 年预计将超过7 亿[1]。糖尿病足溃疡(diabetic foot ulceration,DFU)是最常见且医疗负担最高的DM 并发症之一,DFU 患者约占DM 患者的15%[2]。随着DM 患病人数的增加和DM 患者预期寿命的延长,DFU 患者的数量将持续增加[3]。DFU 患者面临复发和截肢的高风险,并承受着巨大的经济负担。DFU 的病因复杂多样[4],周围神经病变、周围动脉疾病和重复性创伤被认为是主要诱发因素。与正常伤口愈合相比,DM患者伤口愈合过程中受到高血糖、慢性炎症、缺氧和神经肽信号转导受损的影响[4],造成伤口愈合不良,最终可能导致慢性开放性溃疡[5]。此外,DM 患者的免疫反应和对感染的抵抗力也发生了改变[6]。因此,有必要了解DFU发生过程中的潜在分子机制,并确定更具体有效的治疗干预措施。
近年来,DFU 的分子生物学机制研究已取得一些成果。Nguyen 等[7]研究发现活性基质金属蛋白酶-9(matrix metalloprotein-9,MMP-9)上调是DM 小鼠伤口难以愈合的原因,并证明其抑制剂(R)-ND-336 较贝卡普勒明(becaplermin,一种现有的经美国食品药品监督管理局批准的DFU 药物)对伤口愈合更有效。Sunkari 等[8]提出,缺氧诱导因子1(hypoxia inducible factor-1, HIF-1)的激活有助于改善DM 小鼠的伤口愈合。Icli 等[9]指出,miRNA-26a 可以显著提高DM 小鼠伤口愈合的速度。Ramirez等[10]利用基因表达谱芯片研究发现,金黄色葡萄球菌诱导的DFU 中miR-15b-5p 上调,并在进一步的实验中证实其对DNA 修复和炎症反应的抑制作用。
在本研究中,GSE80178 的芯片数据下载于美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI) 基 因 表 达 综 合 数 据 库(Gene Expression Omnibus,GEO)。通过这些数据来鉴定DFU与糖尿病足皮肤(diabetic foot skin,DFS)的差异表达基因(differentially expressed genes,DEG)及其生物学功能,并基于反卷积算法(CIBERSORTx)[11]探索影响DFU 发展的免疫细胞,旨在为DFU 靶向治疗药物的开发提供新的思路。
1 资料与方法
1.1 芯片数据和预处理
mRNA 数据集GSE80178 下载自GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/)。 该 数 据 集 的 建 立 基 于GPL16686(Affymetrix Human Gene)平台[10],共包含12 个独立样本,包括6 个DFU 样本、3 个DFS 样本和3 个非糖尿病足部皮肤(non-diabetic foot skin,nDFS)样本,即正常人皮肤样本。通过R 语言中的oligo 软件包[12]读取CEL文件探针级数据。原始表达数据使用RMA(Robust Multi-Array Average)算法[13]进行背景校正,log2转换及归一化。
1.2 差异基因筛选和功能富集分析
利用R 语言中的limma 包来鉴别DEG,且以P < 0.05、log2|Fold Change|(log2|FC|) >1 用作截断标准。为探索DEG 涉及的基因功能,我们将DEG 提交给DAVID(Database for Annotation, Visualization, and Integrated Discovery)数据库(https://david.ncifcrf.gov/)进行注释与聚类[14-15]。基因功能的可视化是使用GOplot 程序包[16]生成的。对应的筛选标准为P<0.05,基因计数>5。
1.3 免疫细胞分析
CIBERSORTx 提供了一种反卷积算法,可根据基因表达数据估算混合细胞群中成员细胞类型的丰度。利用该算法及其提供的22 种免疫细胞的547 个标记基因,对12 个样本进行反卷积分析,推断22 种免疫细胞在nDFS、DFS 及DFU 的相对含量,并通过Wilcoxon 秩和检验分析了nDFS、DFS 与DFU 之间各种免疫细胞比例的差异。使用R 语言的vioplot 软件包绘制小提琴图以可视化22 种浸润免疫细胞的比例差异。
2 结果
2.1 DFU 与DFS 之间DEG 鉴别
经RMA 算法预处理后,所有样品的基因表达平均值处于同一水平,以P<0.05 和log2|FC|>2 为标准,共获得296 个DFU 与DFS 之间的DEG。火山图中显示了80 个上调基因和216 个下调基因(图1A)。按log2|FC| 排序,并在热图中展示前5 个上调和下调基因(图1B),这10个基因的具体信息见表1。
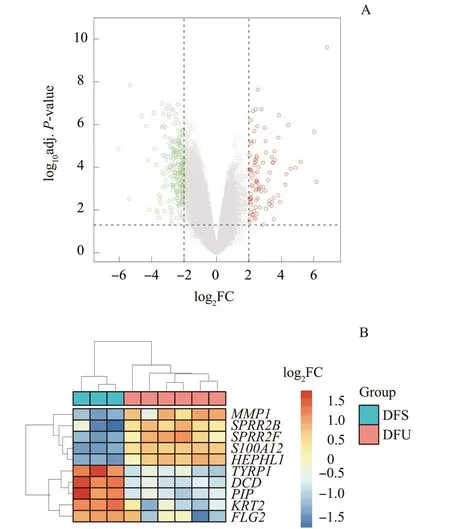
图1 DFU 和DFS 之间的DEGFig 1 DEGs between DFU and DFS
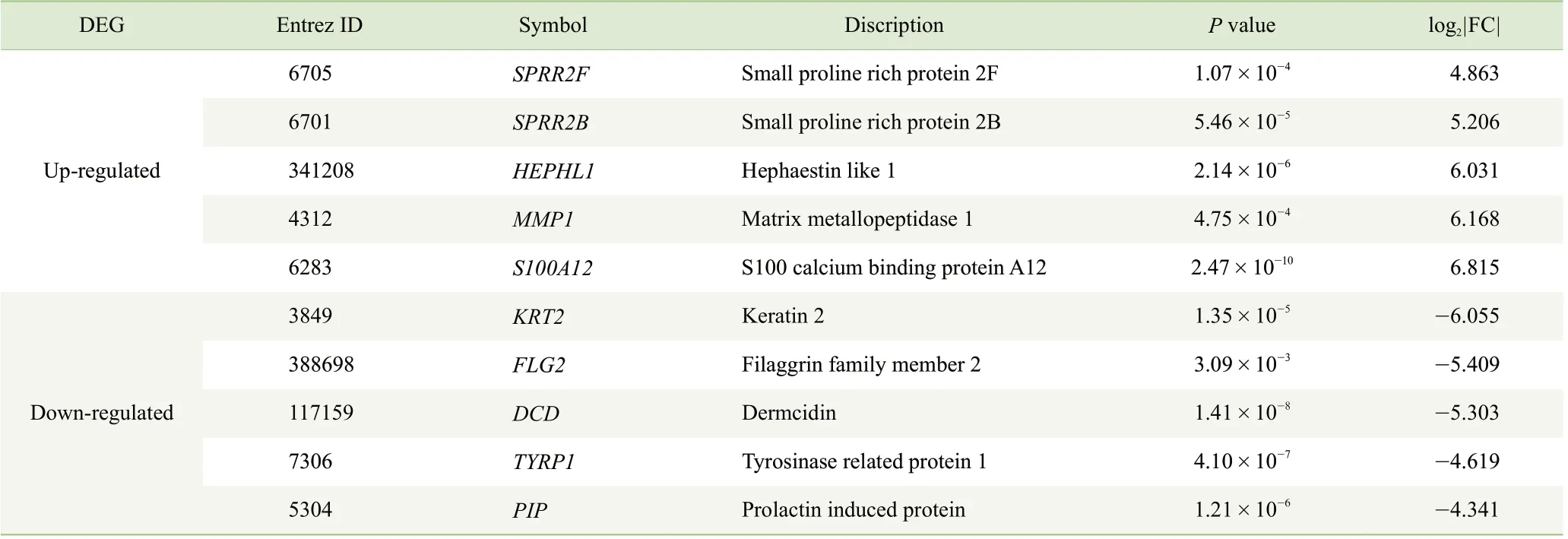
表1 DFU 和DFS 之间上调和下调的前5 位DEGTab 1 Top 5 up-regulated and down-regulated DEGs between DFU and DFS
2.2 功能注释与富集分析
以基因本体论(Gene Ontology,GO)注释了DFU 和DFS 之间DEG 所代表的生物学特征(表2)。以P<0.05、基因计数>5 为筛选条件,筛选出3 个下调和11 个上调的生物过程,以及5 个下调和3 个上调的细胞成分。角质形成细胞的分化、角质化、肽交联、表皮发育、中性粒细胞趋化性等生物过程在DFU 组上调,下调的生物过程包括来自于RNA 聚合酶Ⅱ启动子的转录负调控、轴突导向和细胞黏附。在细胞成分类别中,DEG 主要集中在外泌体和细胞外空间。

表2 GO 分析DEG 的生物过程与细胞成分Tab 2 Biological process and cellular component of DEGs
2.3 nDFS、DFS 及DFU 中的免疫细胞分析
通 过CIBERSORTx 算 法,从6 个DFU 样 品 和3 个DFS 样品中获得22 种免疫细胞的比例。与DFS 相比,DFU 中CD8+T 细胞、单核细胞、静息自然杀伤细胞(NK 细胞)和活化的肥大细胞比例增加,而静息肥大细胞和活化的NK 细胞的比例降低(图2)。
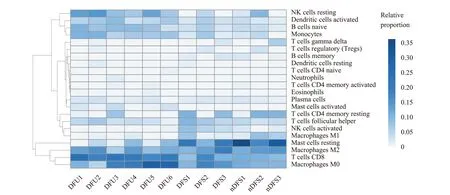
图2 DFU、DFS 和nDFS 中免疫细胞的相对比例Fig 2 Relative proportions of immune cells in DFU, DFS and nDFS
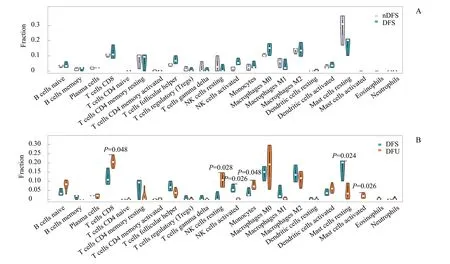
图3 DFU、DFS 和nDFS 中免疫细胞相对比例的比较Fig 3 Comparation of the relative proportions of immune cells in DFU, DFS and nDFS
为进一步验证在DFU 发生前后各免疫细胞比例差异是否具有统计学意义,采用Wilcoxon 秩和检验分别对nDFS 与DFS 组、DFS 与DFU 进行比较。如图3 所示,nDFS 与DFS 组间,未发现差异具有统计学意义的免疫细胞(均P >0.05);DFS 组与DFU 组间,DFU 中CD8+T 细胞、单核细胞、活化的肥大细胞和静息NK 细胞比例显著升高,而活化的NK 细胞和静息肥大细胞比例显著降 低。
3 讨论
DFU 是DM 的常见并发症,每年影响全球2 610 万人[2]。DFU 的复发及因其导致的截肢是该疾病的主要难题。年复发率估计为22.1%[17],截肢的年发生率为0.25%~1.80%,截肢后1 年的死亡率为44%[18-19]。尽管最近研究人员对DFU 发病机制展开了一些研究,但是目前对其的了解仍相对有限,因此有必要对其发病机制进行 更深入的了解以寻找潜在的治疗靶点,提供更多的治疗选择。
本研究通过生物信息学方法分析了DFU 和DFS 的表达谱数据集。总共鉴定出80 个上调基因和216 个下调基因,用于后续的GO 功能富集。在前5 个上调的基因中,S100A12 参与先天免疫应答的抗微生物感染,发挥细胞因子和趋化因子的作用,并可募集大量白细胞[20];MMP-1 在伤口愈合过程所涉及的细胞迁移、上皮化和组织修复中起重要作用[21-22];SPRR2B 和SPRR2F 编码的蛋白质是角质化包膜的组成部分,是对抗细胞外和环境因素的屏障[23]。由此推测,DFU 组织中先天免疫应答、抗菌功能以及特定的角质形成有所增强。在前5 个下调的基因中,KRT2、DCD 和FLG2 或可作为潜在的治疗靶点。KRT2 编码在表皮角质形成细胞的上棘层中表达的结构蛋白,KRT2 缺乏会导致角化过度,并引起局部炎症[24-25]。DCD 编码的C 端肽具有抗菌和抗真菌活性[26]。FLG2 蛋白可以为皮肤提供物理屏障,并且该蛋白的C 端片段具有抗菌作用。推测DCD 和FLG2 的显著下调可能与DFU 复发有关。其他3个基因HEPHL-1、TYRP1 和PIP 在DFU 中的作用有待进一步的研究。
GO 分析用于了解这些DEG 编码蛋白可能涉及的生物过程和细胞成分。基底角质形成细胞的增殖和迁移是皮肤溃疡恢复的关键因素[27]。在DFU 样品,角质形成细胞的分化、角质化、肽交联和表皮发育表现活跃。角质形成细胞不仅提供物理屏障来预防细菌感染,而且还通过产生抗菌肽、炎症细胞因子和趋化因子来促进早期免疫反应[28]。此外,与免疫相关的过程,例如中性粒细胞趋化性和对细菌的防御反应、炎症反应也有所增强。其他上调的生物过程包括血管生成的正调控、凋亡过程的正调控和细胞增殖的正调控。由这些上调的生物过程推测,DFU 局部皮肤正在进行主动表皮和血管修复和主动的炎症反应,以及增强抗菌功能。下调的生物过程包括来自于RNA 聚合酶Ⅱ启动子的转录负调控、轴突导向和细胞黏附。在细胞成分类别中DEG 主要集中在外泌体和细胞外空间,因此DFU 中的细胞外微环境和细胞之间的信息传递值得研究者关注。
根据上述研究结果推测,DFU 的形成可能伴随着免疫微环境的改变。因此,本研究应用CIBERSORTx 对DFU 发生前后各种免疫细胞的浸润比例进行了全面评估。结果发现,在DFS 和nDFS 中各免疫细胞比例差异均无统计学意义,这与先前的研究[29]结果一致。因此,推测DM 患者皮肤对溃疡的敏感性可能不是由于局部免疫微环境的改变,即在溃疡发生前DM 患者皮肤局部免疫微环境改变并不明显。而在DFU 和DFS 的对比中我们发现,活化的肥大细胞、静息NK 细胞、CD8+T 细胞、单核细胞比例增加。
肥大细胞参与伤口愈合过程中的炎症反应、血管生成和细胞外基质重吸收[30]。DFU 组中活化的肥大细胞比例显著增加,而静息肥大细胞比例显著下降。该差异反映了DFU 中肥大细胞可能被激活,脱颗粒;而最近的研究表明,这种现象不利于伤口愈合。Tellechea 等[31]报道了在损伤之前或之后,局部应用肥大细胞脱颗粒抑制剂MCS- 01 可以加速DM 小鼠的伤口愈合;在另一项研究[32]中,用肥大细胞脱颗粒抑制剂色甘酸二钠预处理可以修复DM 小鼠的伤口愈合损伤。在一项应用光生物调节和条件培养基治疗DM 大鼠伤口的研究中,Bagheri 等[33]发现光生物调节和条件培养基加速了伤口愈合过程,并显著减少了肥大细胞总数和肥大细胞脱颗粒。
单核细胞进入棘层分化为朗格汉斯细胞[34]。DFU 中此类细胞比例显著增加,这与Stojadinovic 等[35]的研究一致;他们还报道了朗格汉斯细胞的数量在DFU 愈合后增 加,表明朗格汉斯细胞对溃疡修复具有理论上的积极作 用。
NK 细胞的主要功能是识别病毒感染细胞表面的主要组织相容性复合物,触发细胞因子释放并引起细胞裂解或凋亡[36]。CD8+T 细胞具有与NK 细胞类似的细胞杀伤功能[37]。本研究发现DFU 中活化的NK 细胞减少,CD8+T细胞的比例增加,反映局部细胞免疫可能参与了DFU 的病理过程,但具体机制有待进一步研究。
既往针对数据集GSE80178 的研究发现了miR-15b-5p 在DFU 中的作用[10],以及DFS 与nDFS 间的差异[29]。与之不同,本研究旨在探究DFU 发病过程中分子和免疫细胞的变化。从该数据集中本研究共筛选出296 个DEG,用于功能富集和浸润免疫细胞分析,并发现了可能成为DFU 治疗靶点的基因和免疫细胞。DFU 发展中的主要生物过程包括角质化、先天免疫和抗菌功能。此外,高血糖对皮肤局部的免疫细胞比例影响较小,提示溃疡的发生可能与其他因素如神经或血管因素有关。在溃疡发生后,活化的肥大细胞、静息NK 细胞、CD8+T 细胞、单核细胞比例增加,提示它们与溃疡的形成或修复存在关联。考虑到本研究局限于单个数据集,样本数量较少且缺少临床样本验证,未来还需要进一步开展更为深入的实验来验证本研究的结果。
参·考·文·献
[1] Saeedi P, Petersohn I, Salpea P, et al. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045: results from the International Diabetes Federation Diabetes Atlas, 9th edition[J]. Diabetes Res Clin Pract, 2019, 157: 107843.
[2] Armstrong DG, Boulton AJM, Bus SA. Diabetic foot ulcers and their recurrence[J]. N Engl J Med, 2017, 376(24): 2367-2375.
[3] Lin CJ, Lan YM, Ou MQ, et al. Expression of miR-217 and HIF-1α/VEGF pathway in patients with diabetic foot ulcer and its effect on angiogenesis of diabetic foot ulcer rats[J]. J Endocrinol Invest, 2019, 42(11): 1307-1317.
[4] Baltzis D, Eleftheriadou I, Veves A. Pathogenesis and treatment of impaired wound healing in diabetes mellitus: new insights[J]. Adv Ther, 2014, 31(8): 817-836.
[5] Sinwar PD. The diabetic foot management: recent advance[J]. Int J Surg, 2015, 15: 27-30.
[6] Tsourdi E, Barthel A, Rietzsch H, et al. Current aspects in the pathophysiology and treatment of chronic wounds in diabetes mellitus[J]. Biomed Res Int, 2013, 2013: 385641.
[7] Nguyen TT, Ding DR, Wolter WR, et al. Validation of matrix metalloproteinase-9 (MMP-9) as a novel target for treatment of diabetic foot ulcers in humans and discovery of a potent and selective small-molecule MMP-9 inhibitor that accelerates healing[J]. J Med Chem, 2018, 61(19): 8825-8837.
[8] Sunkari VG, Lind F, Botusan IR, et al. Hyperbaric oxygen therapy activates hypoxia-inducible factor 1 (HIF-1), which contributes to improved wound healing in diabetic mice[J]. Wound Repair Regen, 2015, 23(1): 98-103.
[9] Icli B, Nabzdyk CS, Lujan-Hernandez J, et al. Regulation of impaired angiogenesis in diabetic dermal wound healing by microRNA-26a[J]. J Mol Cell Cardiol, 2016, 91: 151-159.
[10] Ramirez HA, Pastar I, Jozic I, et al. Staphylococcus aureus triggers induction of miR-15B-5P to diminish DNA repair and deregulate inflammatory response in diabetic foot ulcers[J]. J Invest Dermatol, 2018, 138(5): 1187-1196.
[11] Newman AM, Steen CB, Liu CL, et al. Determining cell type abundance and expression from bulk tissues with digital cytometry[J]. Nat Biotechnol, 2019, 37(7): 773-782.
[12] Carvalho BS, Irizarry RA. A framework for oligonucleotide microarray preprocessing[J]. Bioinformatics, 2010, 26(19): 2363-2367.
[13] Irizarry RA, Hobbs B, Collin F, et al. Exploration, normalization, and summaries of high density oligonucleotide array probe level data[J]. Biostatistics, 2003, 4(2): 249-264.
[14] Ashburner M, Ball CA, Blake JA, et al. Gene ontology: tool for the unification of biology. The Gene Ontology Consortium[J]. Nat Genet, 2000, 25(1): 25-29.
[15] Dennis G Jr, Sherman BT, Hosack DA, et al. DAVID: Database for Annotation, Visualization, and Integrated Discovery[J]. Genome Biol, 2003, 4(5): P3.
[16] Walter W, Sánchez-Cabo F, Ricote M. GOplot: an R package for visually combining expression data with functional analysis[J]. Bioinformatics, 2015, 31(17): 2912-2914.
[17] Fu XL, Ding H, Miao WW, et al. Global recurrence rates in diabetic foot ulcers: a systematic review and meta-analysis[J]. Diabetes Metab Res Rev, 2019, 35(6): e3160.
[18] Hunt DL. Diabetes: foot ulcers and amputations[J]. BMJ Clin Evid, 2011, 2011: 0602.
[19] Bruttocao A, Terranova C, Martella B, et al. Rate of amputation and mortality in new-onset diabetic foot ulcers in the elderly[J]. BMC Geriatr, 2010, 10(Suppl 1): A48.
[20] Oesterle A, Bowman MA. S100A12 and the S100/calgranulins: emerging biomarkers for atherosclerosis and possibly therapeutic targets[J]. Arterioscler Thromb Vasc Biol, 2015, 35(12): 2496-2507.
[21] Trengove NJ, Stacey MC, MacAuley S, et al. Analysis of the acute and chronic wound environments: the role of proteases and their inhibitors[J]. Wound Repair Regen, 1999, 7(6): 442-452.
[22] Ladwig GP, Robson MC, Liu R, et al. Ratios of activated matrix metalloproteinase-9 to tissue inhibitor of matrix metalloproteinase-1 in wound fluids are inversely correlated with healing of pressure ulcers[J]. Wound Repair Regen, 2002, 10(1): 26-37.
[23] Tesfaigzi J, Carlson DM. Expression, regulation, and function of the SPR family of proteins. A review[J]. Cell Biochem Biophys, 1999, 30(2): 243-265.
[24] Fischer H, Langbein L, Reichelt J, et al. Loss of keratin K2 expression causes aberrant aggregation of K10, hyperkeratosis, and inflammation[J]. J Invest Dermatol, 2014, 134(10): 2579-2588.
[25] Fischer H, Langbein L, Reichelt J, et al. Keratins K2 and K10 are essential for the epidermal integrity of plantar skin[J]. J Dermatol Sci, 2016, 81(1): 10-16.
[26] Steffen H, Rieg S, Wiedemann I, et al. Naturally processed dermcidin-derived peptides do not permeabilize bacterial membranes and kill microorganisms irrespective of their charge[J]. Antimicrob Agents Chemother, 2006, 50(8): 2608-2620.
[27] Kurita M, Araoka T, Hishida T, et al. In vivo reprogramming of wound-resident cells generates skin epithelial tissue[J]. Nature, 2018, 561(7722): 243-247.
[28] Krishna S, Miller LS. Innate and adaptive immune responses against Staphylococcus aureus skin infections[J]. Semin Immunopathol, 2012, 34(2): 261-280.
对于±800 kV滇西北至广东特高压直流输电线路工程共塔段线路,若将接地极线的铁塔横担更换为复合横担,复合横担长度暂取4.2 m(暂取该工程各塔型铁塔横担长度中的最小值),雷击闪络率如表2所示。
[29] Ramirez HA, Liang L, Pastar I, et al. Comparative genomic, microRNA, and tissue analyses reveal subtle differences between non-diabetic and diabetic foot skin[J]. PLoS One, 2015, 10(8): e0137133.
[30] Oskeritzian CA. Mast cells and wound healing[J]. Adv Wound Care, 2012, 1(1): 23-28.
[31] Tellechea A, Bai S, Dangwal S, et al. Topical application of a mast cell stabilizer improves impaired diabetic wound healing[J]. J Invest Dermatol, 2020, 140(4): 901-911.e11.
[32] Tellechea A, Leal EC, Kafanas A, et al. Mast cells regulate wound healing in diabetes[J]. Diabetes, 2016, 65(7): 2006-2019.
[33] Bagheri M, Amini A, Abdollahifar MA, et al. Effects of photobiomodulation on degranulation and number of mast cells and wound strength in skin wound healing of streptozotocin-induced diabetic rats[J]. Photomed Laser Surg, 2018, 36(8): 415-423.
[34] Deckers J, Hammad H, Hoste E. Langerhans cells: sensing the environment in health and disease[J]. Front Immunol, 2018, 9: 93.
[36] Paul S, Lal G. The molecular mechanism of natural killer cells function and its importance in cancer immunotherapy[J]. Front Immunol, 2017, 8: 1124.
[37] Rosenberg J, Huang J. CD8+T cells and NK cells: parallel and complementary soldiers of immunotherapy[J]. Curr Opin Chem Eng, 2018, 19: 9-20.

