CNV-Seq联合核型分析在羊水穿刺胎儿染色体嵌合体诊断中的应用
刘 文 徐晶晶 彭亚琴 胡 月 宋雅娴 何国平 汤冬冬 汪 菁
羊水细胞染色体核型嵌合比例、类型、发生位置的不同对胎儿临床表型的影响不可预知,如何精准评估“嵌合体”,并对孕妇是否继续妊娠提供准确的遗传咨询,是目前临床工作中的重点和难点问题[1-2]。染色体核型嵌合存在真性嵌合和假性嵌合2种可能,难以判断,虽然真性、假性嵌合的诊断标准明确,但嵌合体诊断的灵敏度和准确度仍有待提高。染色体核型分析是诊断染色体异常较为公认的“金标准”,但是使用该方法诊断染色体嵌合体,依然存在漏诊、误诊的可能,研究[3-4]认为染色体核型分析提示嵌合的孕妇并不应立即终止妊娠,建议使用其他检测技术进一步验证。
近年来,随着细胞生物学、分子生物学技术的不断进步,尤其是基因组拷贝数变异测序技术(copy number variation sequencing,CNV-Seq)日益广泛地应用于产前诊断,已对胎儿染色体嵌合的灵敏、特异诊断起到了积极的作用。本研究拟通过回顾性分析穿刺羊水标本双线培养、制片、G带核型分析及联合应用CNV-Seq技术进行嵌合体诊断的准确性,并进一步明确不同产前诊断指标异常孕妇羊水中染色体核型的嵌合情况,探讨2项技术联合在胎儿染色体嵌合体诊断中的临床应用。
1 资料与方法
1.1 一般资料 选择2018年1月至2019年9月在中国科学技术大学附属第一医院妇产科产前诊断中心行常规产前诊断的孕妇为研究对象。纳入标准:单胎妊娠,无妊娠感染及其他合并症。排除标准:孕妇本人或配偶染色体异常,精神疾病患者。本研究共纳入3 320位孕妇,年龄21~37岁,孕周18~24周,均签署产前诊断(含CNV-Seq)知情同意书。其羊水标本均通过羊膜腔穿刺术顺利获取,分别用于染色体核型分析和CNV-Seq。
1.2 方法
1.2.1 经腹B超引导下羊膜腔穿刺术 采用21 G穿刺针连接注射器抽取1~2 mL孕妇羊水后弃去,以避免母体细胞污染,改换注射器继续抽取清亮羊水约25 mL,按顺序分装至I、II、III号管,I、III号管分别留取约10 mL羊水用于细胞培养,II号管留取约5 mL羊水用于CNV-Seq。
1.2.2 羊水核型分析 ①培养、制片:I、III号管分两线独立操作,分别接种后第2天加液2 mL,1周换液,显微镜下监测细胞生长状态,8~10 d后使用原位法收获细胞并制片,G显带染色后,使用徕卡GSL-120自动扫描仪记录信息。②阅片分析:两线分别计数不少于15个细胞、分析不少于3个细胞,观察、记录染色体数目及结构情况。按照国家卫生健康委员会制定的羊水细胞嵌合体真实性评估及处理规则[5],必要时扩大细胞计数并增加核型分析数量。
1.2.3 CNV-Seq检测 将II号管羊水标本离心沉淀后,提取50 ng基因组DNA作为模板构建测序文库,使用BGISEQ-500测序仪进行低深度高通量测序,记录染色体非整倍体变异及100 kb以上的CNV并进行分析。CNV结果的临床评价基于美国医学遗传学会(American College of Medical Genetics,ACMG)指南,突变命名参考国际系统标准[6-7]。
1.3 随访 对羊水核型或CNV-Seq检测结果提示为胎儿染色体嵌合体的孕妇提供遗传咨询,并对活产胎儿进行随访。
2 结果
2.1 胎儿染色体嵌合体检出率 3 320例羊水标本中,CNV-Seq联合G带核型分析共检测出胎儿染色体嵌合体19例(嵌合检出率为0.57%),其中核型检测出16例(嵌合检出率为0.48%),CNV-Seq检测出12例(嵌合检出率为0.36%)。2种方法均检测出的嵌合体共有9例,值得注意的是,3例核型分析未嵌合的标本,CNV-Seq检测出嵌合,后经荧光原位杂交(fluorescence in situ hybridization,FISH)验证为真嵌合。见表1。
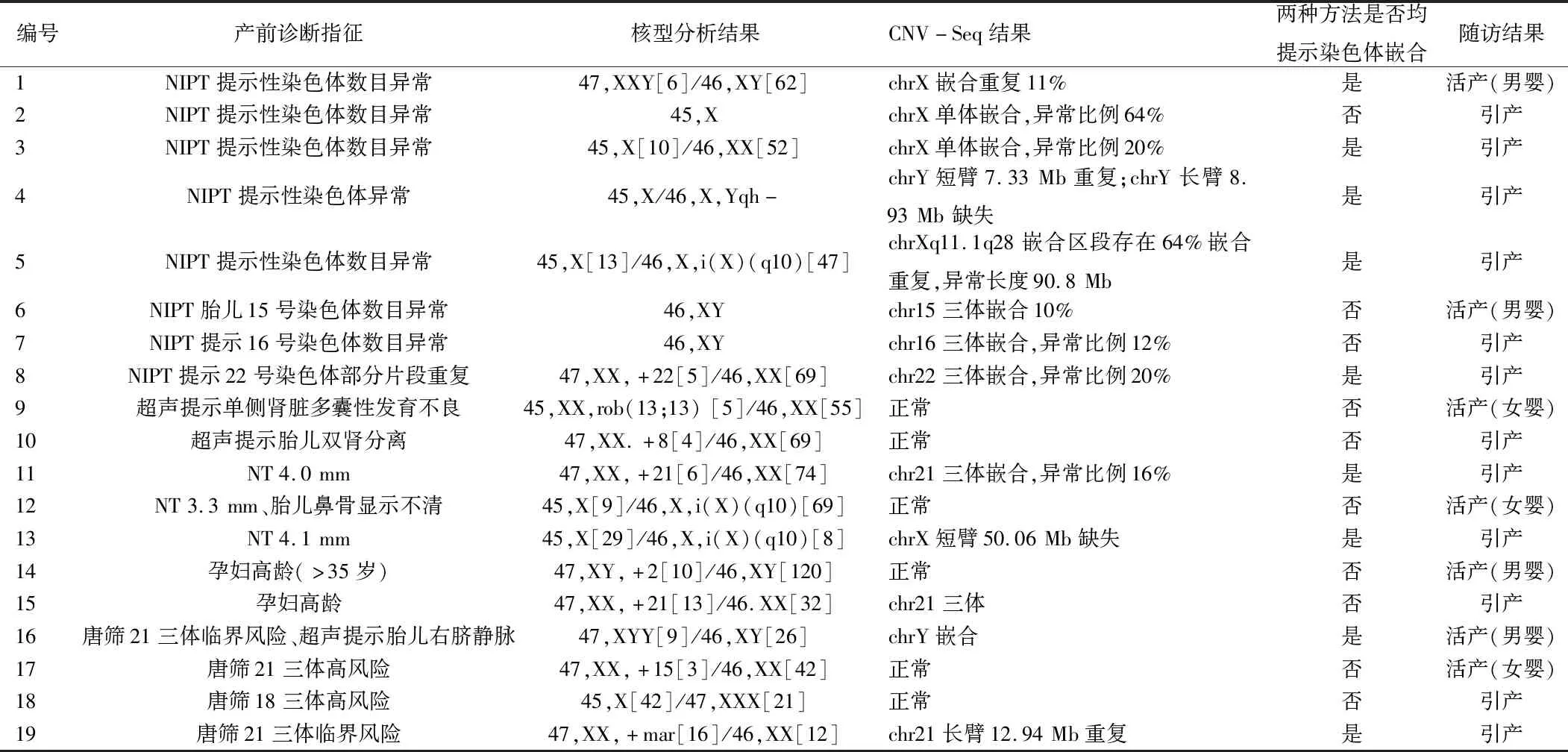
表1 核型分析和CNV-Seq嵌合结果
2.2 不同产前诊断指征孕妇羊水染色体嵌合结果 在不同产前诊断指标异常的孕妇羊水标本中,无创产前检测(non invasive prenatal testing, NIPT)提示异常的孕妇羊水中检出嵌合体8例,超声、胎儿颈项透明膜(nuchal translucecy, NT)厚度提示异常的孕妇羊水标本中检出嵌合体5例,高龄孕妇羊水标本中检出嵌合体2例,唐氏筛查结果提示高风险的孕妇羊水标本中检出嵌合体4例。见表2。
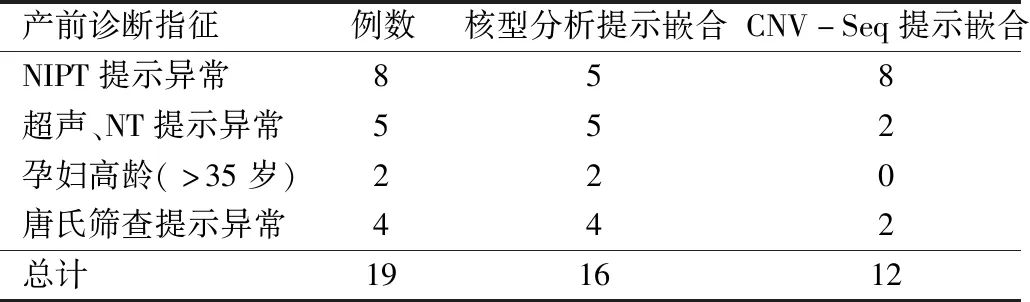
表2 核型分析及CNV-Seq检测不同产前诊断指征孕妇羊水染色体嵌合结果(例)
2.3 胎儿染色体异常嵌合类型 核型分析联合CNV-Seq检测为嵌合体的病例中,性染色体数目或结构异常9例,常染色体数目、结构异常的分别为9例和1例。其中有3例性染色体和7例常染色体异常嵌合的病例,核型分析与CNV-Seq检测结果不一致。见表3。

表3 核型分析及CNV-Seq检测出的异常嵌合类型(例)
3 讨论
准确鉴别胎儿染色体是否存在嵌合体以及嵌合的性质,对决定孕妇的妊娠结局尤为关键。嵌合体的形成原因多种多样,例如:在合子卵裂过程中或胚胎早期体细胞突变,此时每一条染色体都可能畸变,形成染色体数目、结构异常的真性嵌合体。然而,特定情况下,多种因素也会导致假性嵌合现象,假性嵌合需通过进一步检测来确认[8]。有学者提出在妊娠早期绒毛膜或中期羊水中若发现嵌合,不应立即终止妊娠,应行脐血穿刺术或羊膜腔穿刺术,并使用其他检测技术进一步证实胎儿染色体异常,例如:结合超声诊断技术对胎儿进行观察,并考虑运用蛋白质组学技术筛查产前诊断生物标志物[9],如选择继续妊娠并活产胎儿,在胎儿出生后还应检测多个组织、加强随访[10]。
染色体核型分析是诊断染色体异常较为公认的“金标准”,但是诊断低比例染色体嵌合体,以及在区分真性、假性嵌合过程中仍然存在明显不足,迫切需要其他检测方法的联用,辅助诊断胎儿染色体嵌合体,以期更加准确地区分真、假嵌合,实现灵敏、特异诊断[3]。
CNV-Seq是一项近年来兴起的高通量测序技术,具有操作简单、周期短、通量高、检测范围广等优势,弥补了核型分析染色体结构性变异分辨率大于10 Mb的不足[11-12]。CNV-Seq可以在分子水平上检测出形态学观察不易发现的染色体微缺失、微重复,还可以辅助检测嵌合比例,发现核型分析无法诊断的低比例嵌合,同时避免取材误差或体外培养、收获、制片等人为操作造成的假性嵌合诊断,从而能够更准确地辅助临床进行遗传咨询[13]。
本研究采用的嵌合体检测方案是穿刺羊水标本行染色体G带核型分析联合CNV-Seq分子检测,结果显示核型分析胎儿染色体嵌合检出率为0.48%,CNV-Seq嵌合检出率为0.36%,2种方法联用的嵌合检出率为0.57%,CNV-Seq联合核型分析提高了胎儿染色体嵌合体诊断的阳性检出率,与既往文献[14]报道的羊水嵌合体检出率(0.3%)基本吻合。值得注意的是,3例核型分析无明显嵌合的标本,CNV-Seq检测出真性嵌合,由此可见,穿刺取材、细胞培养、制片等实验操作及人工分析引起的系统误差,导致核型分析出现漏检不可避免,而CNV-Seq作为辅助检测手段,可以较好地弥补核型分析的劣势[15-16]。在检出嵌合体的病例中,对应的产前诊断指标异常包括:NIPT异常、超声或NT厚度异常、孕妇高龄及唐氏筛查高危等,表明随着分子遗传学的快速发展、超声诊断学的不断进步,常规产前检查一定程度上提高了胎儿染色体嵌合体的阳性检出率。此外,在检出的10例染色体嵌合体中,核型分析与CNV-Seq检测结果不一致,可能的原因是核型分析的是经过体外培养的羊水细胞,而CNV-Seq检测的是未经体外培养的羊水细胞,且二者对于低比例嵌合的检测灵敏度不同。
CNV-Seq虽然可以提高羊水穿刺产前诊断中胎儿嵌合体的诊断率,但由于其技术局限性,目前尚无法判断遗传物质总量不变的情况下染色体结构异常,如上述1例罗氏易位嵌合,CNV-Seq尚无法辨别。此外,在性染色体嵌合病例中,CNV-Seq虽能检测到异常,但对结果更精准的解读尚需联合核型分析。
综上所述,对于NIPT、超声[17-19]等产前筛查中发现的高危妊娠,CNV-Seq联合常规G带染色体核型分析可以弥补单一检测方法诊断羊水穿刺胎儿染色体嵌合体出现误诊的不足,,且有助于发现染色体低比例嵌合及微缺失、微重复,为产前遗传咨询提供了更加可靠的实验室诊断结果。

