胃和肠表型在伴肠母细胞分化胃腺癌中的表达
苟思琪,张 前,方 媛,杨路路,王劲松,齐 琼,黄文斌
0 引 言
伴肠母细胞分化的胃腺癌(gastric adenocarcinoma with enteroblastic differentiation, GAED)是产甲胎蛋白胃癌的一种少见亚型,由Matsunou等[1]于1994年首次报道。GAED组织学上类似于胎儿肠上皮,肿瘤细胞呈管状、乳头状、实体结构,胞浆透亮或嗜酸,免疫组织化学上至少表达肠母细胞分化标志物(AFP、GPC3和SALL4)中的一种[2]。前期研究以及文献报道显示GAED具有较高的淋巴结及远处转移率,相对于普通型胃癌预后较差[3-5]。胃和肠表型表达在胃癌的组织发生中具有重要作用。有研究表明,采用胃和肠上皮细胞标记物(MUC2、MUC5AC、MUC6、CD10)可分析胃癌的胃肠表型[6];且研究发现,无论早期还是进展期胃癌,具有胃表型的胃癌是淋巴结转移和预后不佳的独立因素。然而,目前为止尚未见GAED中胃和肠表型表达的相关性报道。本文应用免疫组化EnVision法检测GAED中MUC2、MUC5AC、MUC6、CD10的表达,研究GAED的表型特征,并进一步探讨GAED的细胞来源及胃和肠表型标志物表达及分型的临床意义。
1 资料与方法
1.1 临床资料收集我科2015年1月-2018年12月因胃癌行根治切除术标本540份,其中43份诊断为GAED。所有病理切片均经2位高年资病理医师复诊。GAED的诊断标准定义为肿瘤主要为腺癌成分伴透亮或嗜酸性胞质,类似于胎儿肠上皮,呈管状乳头状或实性片状生长,且免疫组化至少表达AFP、GPC3或SALL4。
1.2方法所有手术切除标本均经4%甲醛固定,常规组织处理及石蜡包埋,4 μm厚切片5张,切片脱蜡、梯度乙醇脱水后,分别行HE和免疫组化染色。免疫组化染色采用EnVision法,10%H2O2进行内源性生物素酶处理,高温高压抗原修复,抗原修复液为pH6.0枸橼酸盐缓冲液,然后在Dako全自动染色机上进行免疫染色,具体操作参照说明书进行。一抗MUC2、MUC5AC、MUC6、CD10均为Dako公司产品,购自北京中杉金桥生物技术公司。MUC2阳性对照为正常结肠组织,MUC5AC阳性对照为正常胃黏膜组织,MUC6阳性对照为正常胃窦组织, CD10阳性对照为正常小肠组织,PBS代替一抗作为阴性对照。
1.3结果判断MUC2、MUC5AC、MUC6均表达于细胞质,CD10表达于腺癌的腔缘。当>10%肿瘤细胞表达时定义为阳性[2]。胃和肠表型分型根据免疫组化结果确定:胃型为MUC5AC和(或)MUC6表达阳性,而MUC2和CD10表达阴性;肠型为MUC2和(或)CD10表达阳性,而MUC5AC和MUC6表达阴性;混合型为MUC2和(或)CD10表达阳性与MUC5AC和(或)MUC6表达阳性;未分类型为4项指标均阴性。
1.4统计学分析采用SPSS 23.0软件进行分析。GAED中MUC2、MUC5AC、MUC6和CD10表达以及胃和肠表型分型在GAED中的分布以n(%)表示。不同细胞标记物表达与GAED临床病理参数之间的关系采用Fisher确切概率法。以P≤0.05为差异有统计学意义。
2 结 果
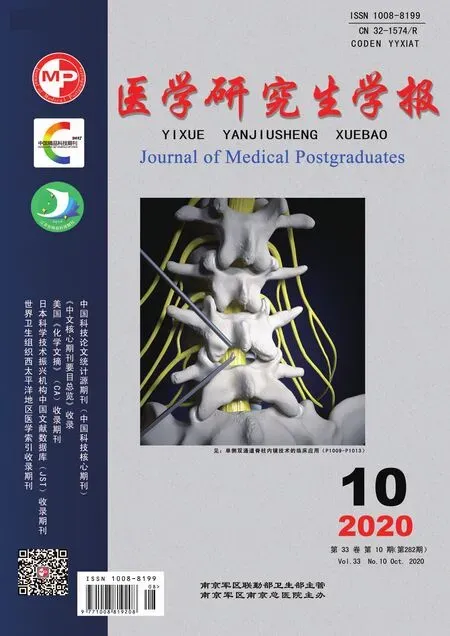
2.1 GAED中MUC5AC、MUC6、 MUC2和CD10的表达及胃和肠表型分布组织学上,GAED肿瘤细胞呈管状、实体结构,细胞质透亮,类似于胎儿肠上皮,见图1。43例GAED中,MUC5AC、MUC6、 MUC2和CD10的阳性率分别为16.3%(7/43)、18.6%(8/43)、7.0%(3/43)、4.7%(2/43)。根据免疫组化结果GAED进行分型,胃型9例(20.9%)、肠型3例(7.0%)、混合型2例(4.7%)、未分类型29例(67.4%)。GAED中胃和肠表型以未分类型为主,其次为胃型,而肠型和混合型均少见。
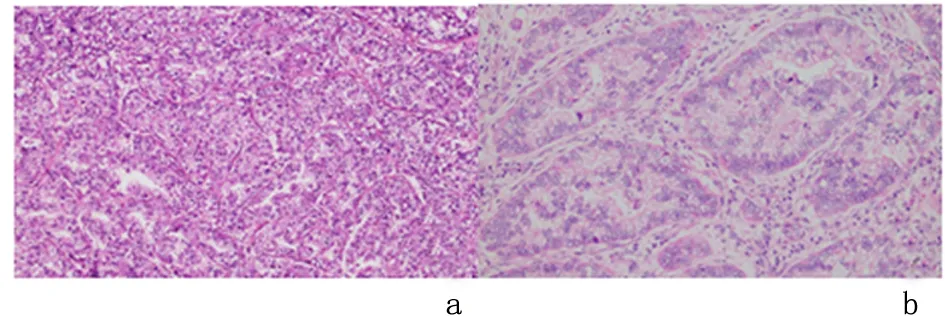
a:细胞呈管状、实体结构; b:细胞质透亮
2.2GAED中MUC2、MUC5AC、MUC6和CD10的表达与临床病理参数之间的关系MUC5AC表达在≥60岁GAED更高,差异有统计学意义(P<0.05);MUC6在≥60岁和pTNM分期III和IV期GAED患者表达更高,差异有统计学意义(P<0.05),见表1。
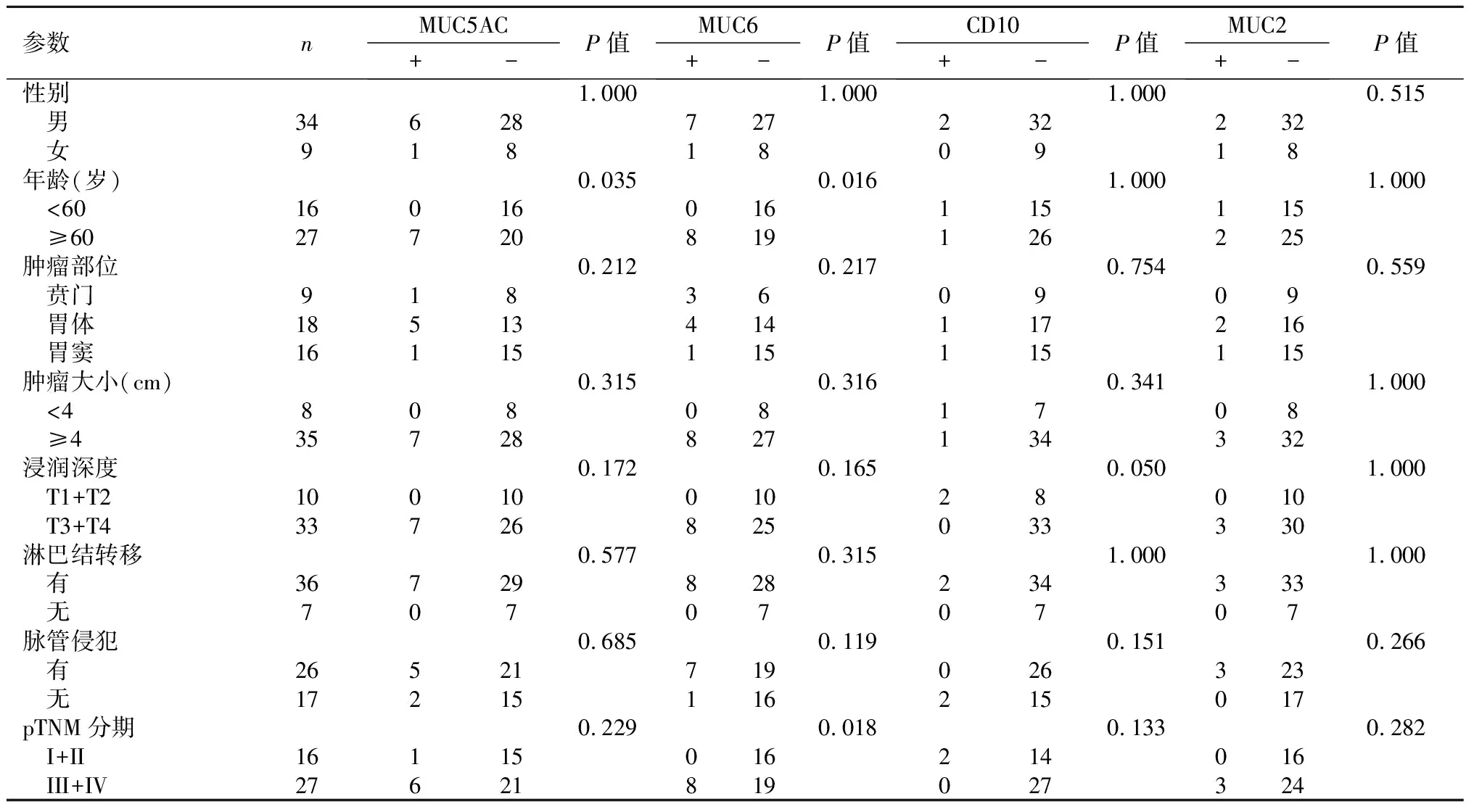
表 1 GAED中MUC5AC、MUC6、MUC2和CD10的表达与临床病理参数之间的关系
2.3GAED中胃和肠表型分型与临床病理参数之间的关系不同胃和肠分型中,仅年龄在4种类型中差异有统计学意义。其中胃型和未分类型在≥60岁者更高(P<0.05)。见表2。
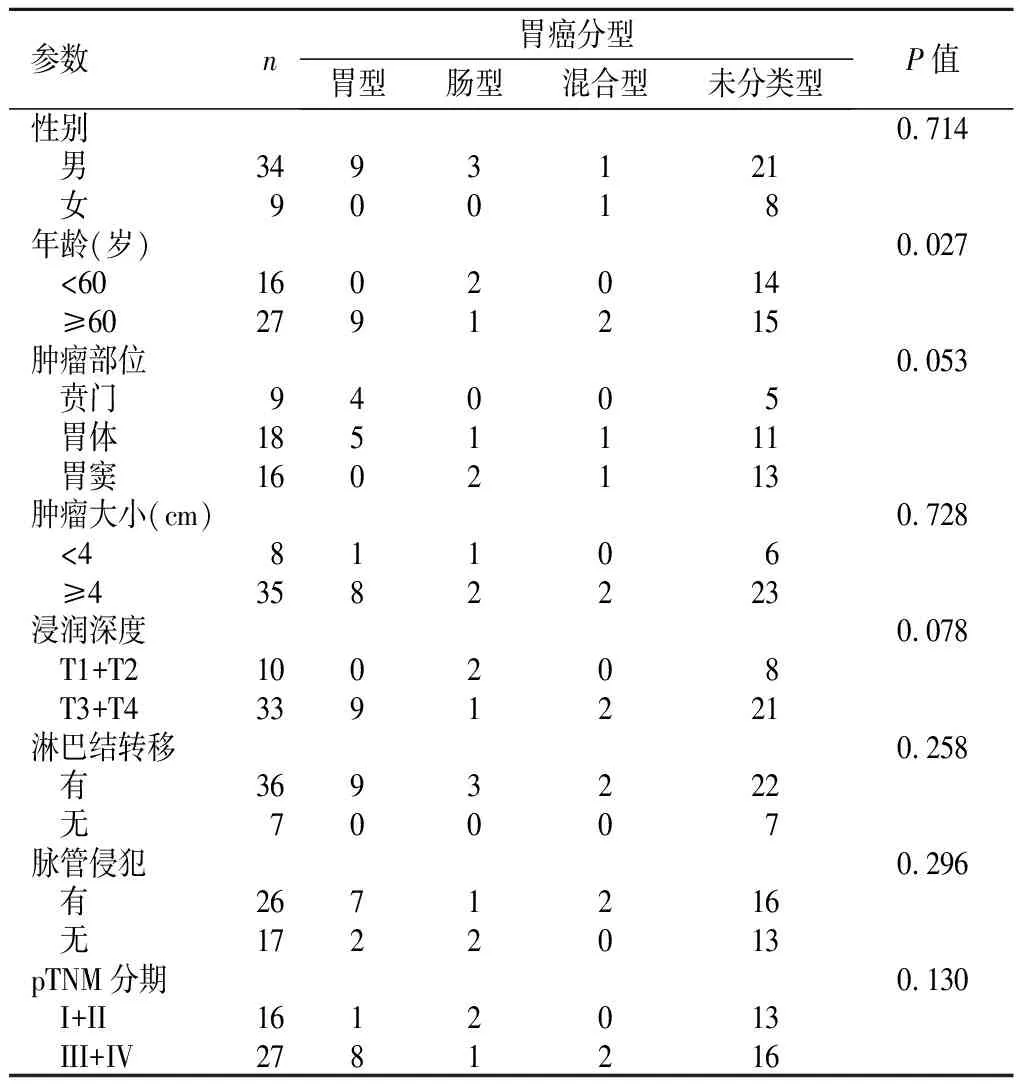
表 2 GAED中胃和肠表型分型与临床病理参数之间的关系
3 讨 论
GAED是近年来认识的一种新的胃癌组织学类型,特征性表现为肿瘤细胞排列成管状乳头状、筛状和实性结构,肿瘤细胞胞质透亮或嗜酸性,免疫组化上至少表达一种肠母细胞分化标志物 (SALL4、GPC3和AFP)[2]。关于该肿瘤的临床生物学行为,国内外多项研究发现相比于非GAED,GAED具有更加侵袭性的临床生物学行为,如更容易发生淋巴结转移和脉管侵犯及,以及具有更晚的临床分期和更差的预后[3-5]。虽然GAED组织学形态和免疫表型具有肠母细胞分化特征,但其准确的组织细胞起源尚未清楚。
黏蛋白是一组高分子量的糖蛋白,参与腺上皮的合成和分泌。正常情况下,黏蛋白除了对腺上皮起保护作用外还参与上皮细胞的分类、更新、细胞黏附和细胞信号传导通路的调节。正常胃黏膜中存在不同类型黏蛋白。其中MUC5AC主要分布在胃小凹上皮;MUC6主要分布在胃体腺黏液颈部上皮和幽门腺。这2种黏蛋白被认为代表着胃型黏液。MUC2正常情况下表达于肠道黏膜,不表达于正常胃黏膜上皮。但当胃黏膜上皮发生肠上皮化生时可有MUC2表达。CD10主要表达于小肠上皮的刷状缘,正常胃黏膜上皮不表达。MUC2和CD10被认为代表着肠型标志。这些细胞特异性分子已被用来追踪胃肿瘤上皮细胞的细胞谱系[7]。本研究发现MUC5AC、MUC6、MUC2和CD10的阳性率分别为16.3%、18.6%、7.0%和4.7%。根据这些免疫组化结果进行的胃癌分型则显示GAED以未分类型为主,其次为胃型;而肠型和混合型均少见,提示GAED或者保留了胃癌发生早期的表型或者真正发生了分化。然而根据定义,GAED具有肠母细胞分化;但本研究发现2种肠道标志物MUC2和CD10在GAED中表达低,提示GAED中的肿瘤细胞虽然具有胚胎肠管分化,但缺乏向肠上皮的转分化潜能。
肿瘤的表型标志物表达通常被认为模仿了起源组织的表达,并与胃癌的临床生物学行为具有一定的相关性。Kim等[8]研究发现MUC5AC表达与较低的男女比例和较高比例的弥漫型胃癌有关,MUC2阳性表达的胃癌多见于胃窦、肠型肿瘤和早期胃癌,但有较低的神经周围侵犯和淋巴结转移。CD10表达与患者平均年龄大、男女比例高和肠型胃癌有关。进一步根据免疫标记进行的胃肠表型分型结果显示未分类型胃癌多见于胃体,体积较大、更多的神经周围侵犯和淋巴结转移。Tajima等[9]研究了133例早期分化性胃癌,结果显示人胃型黏蛋白表达与混合型肿瘤和淋巴结转移有关;而MUC2表达与黏膜内侵犯呈负相关,具有胃型表型的分化性胃癌更可能转化为未分化型癌和显示向深层浸润性生长。这些发现表明根据早期分化性胃癌的表型标记物表达可以预测肿瘤侵袭性行为。Tajima等[10]还进一步研究了213例晚期胃癌胃和肠表型标记物表达与术后腹腔复发和血道转移的关系,结果发现MUC5AC阳性和MUC2阴性胃癌容易发生腹腔复发,MUC2阴性和CD10阳性胃癌容易发生血道转移。根据免疫标记进行的胃癌分型发现胃型胃癌具有较高的腹腔复发。Tajima等[10]认为胃和肠表型标记物及其分型有助于预测胃癌术后复发和转移的模式。黄文斌等[11]研究也发现MUC5AC表达与肿瘤大小有关。MUC6表达多见于分化型胃癌和有淋巴结转移者;CD10表达与胃癌的组织学类型和脉管侵犯有关;MUC2表达与胃癌临床病理参数无关。胃和肠表型分类显示胃型胃癌多为未分化型胃癌,胃肠混合型胃癌多发生浆膜层及浆膜外层浸润和较晚的pTNM分期。本研究发现MUC5AC与MUC6的表达与患者年龄呈正相关;同时MUC6的表达也和更高的pTNM分期有关;而MUC2和CD10表达与GAED任何临床病理参数无关。进一步根据4种标志物进行的胃和肠表型研究发现,胃型和未分类型在≥60岁者更高,而其他临床病理参数与胃和肠表型分型无关,提示MUC5AC、MUC6、MUC2和CD10表达及基于这些标志物的胃和肠表型分型可能在一定程度上有助于预测GAED的临床生物学行为。本文研究结果不同于以往的文献报道,可能与病例为特殊类型胃癌,且病例数量较少有关。需要今后进一步加大病例数量研究。
胃癌组织学上根据腺体形成趋势分为肠型和弥漫型,或者分化型和未分化型。根据文献报道,GAED组织学类型上是属于肠型或者分化型[12]。然而,本研究发现GAED主要表达MUC5AC、MUC6,为未分类型和胃型胃癌。Kwon等[13]研究GAED常表达CD10、CDX2和MUC6,但不表达MUC2和MUC5AC,故认为GAED具有较高的胃窦黏液表型和肠黏液表型。两者结果的差异可能与这些指标的阳性截断值以及研究的病例中组成不同有关。对EBV阳性胃癌的细胞来源进行研究结果发现该类型胃癌主要以未分类型和胃型胃癌为主[14-15]。结合既往研究结果,可推测特殊类型的胃癌无法根据组织形态学简单地归为肠型和弥漫型或分化型与未分化型,而是需要根据胃和肠表型标志物表达进一步精确分型。
总之,GAED虽然名称和形态学上具有肠母细胞分化,组织学上归为肠型或分化型,但胃和肠表型标记物表达提示GAED主要为未分类型和胃型,罕见具有真正的肠型分化。对于胃和肠表型标记物及其分型在GAED的临床病理学意义尚需要积累较多的病例进行进一步研究。