类风湿性关节炎患者发生冠心病风险列线图预测模型的建立
李 洁,颜紫宁,范 莉,沈 丹,黄 俊,崔 灵
0 引 言
类风湿性关节炎(rheumatoid arthritis, RA)是一种慢性、炎症性自身免疫病,主要以滑膜炎和血管炎为主要病理改变,并且累及多个系统。研究指出心血管系统是最常累及的重要器官之一,心血管事件也成为RA患者死亡的首要原因[1],其中大部分与动脉粥样硬化性疾病有关。RA患者中普遍存在亚临床冠状动脉粥样硬化[2],但动脉粥样硬化是一个全身性的慢性过程,早期发现并采取干预措施对于降低RA患者冠心病(coronary heart disease, CHD)的发生率和病死率非常重要[3]。
RA目前被认为是动脉粥样硬化形成的独立危险因素[4],因RA的风险分布不同于普通人群,传统的临床心血管病风险估测在应用上存在局限性[5],冠状动脉造影和CT冠状动脉造影(CT coronary angiography, CTCA)可以诊断CHD,但因辐射和费用等问题很难在RA群体中大规模开展。本研究旨在探讨建立RA患者发生CHD的列线图预测模型,为临床预后及治疗提供参考。
1 资料与方法
1.1 临床资料回顾性分析2012年3月至2018年9月常州市第二人民医院风湿免疫科315例RA患者的临床资料。其中32例患者合并CHD,稳定性心绞痛19例,缺血性心肌病3例,不稳定性心绞痛8例,心肌梗死2例。所有患者RA的诊断均符合2010年美国风湿学会和欧洲抗风湿病联盟修订的分类诊断标准[6], 标准评分≥6分则明确诊断为RA。高血压的诊断参照《中国高血压防治指南》[7]。冠心病诊断结合症状、心电图、超声心动图、心肌酶谱检查以及经冠状动脉造影或CTCA证实的冠状动脉狭窄程度≥50%。排除合并患有其他弥漫性结缔组织病的患者。按照RA患者是否发生CHD分为RA+ CHD组(n=32)和RA组(n=283)。
1.2方法
1.2.1 观察指标收集患者住院期间的性别、年龄、身高、体重、病程。实验室指标包括高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、尿酸、类风湿因子(RF)、血清C-反应蛋白(CRP)、血红细胞沉降率(ESR)、糖化血红蛋白(HbA1c)。记录心电图是否有改变(包括ST-T改变或异常Q波)。
1.2.2颈-股脉搏波传播速度(carotid-femoral pulse wave velocity, cfPWV)测量采用GE-Vivid E9超声诊断仪,配备9L型探头(频率2.4-10MHz)和M5s探头(频率1.5-4.6MHz),同步连接心电图,取右侧颈总动脉及右侧股总动脉血流频谱,记录心电图R波起点至右颈总动脉血流加速点之间的时间延迟t1,R波点至右股总动脉血流加速点之间的时间延迟t2,t为颈-股脉搏波传播时间,t= t2- t1。用软尺测量右颈总动脉频谱采集处至右股总动脉频谱采集处之间的直线距离L,cfPWV=80%L/t。所有测量值均取3个心动周期的平均值。每次测量待血流状态和同步心电图显示心率稳定后进行,并将频谱扫描速度调节至最快,且2次测量的心率尽可能相同,一般取≤3bpm[8],获得最高的时间分辨率且减少误差。
1.2.3颈动脉内-中膜厚度(intima media thickness at the cervical artery, IMT)以及颈动脉斑块Crouse积分患者休息后仰卧位,9L型探头检查颈动脉,依次检查左、右侧颈总动脉、颈总动脉球部以及颈内动脉,选取该6个区域中IMT的最大值进行分析。若IMT≥1.5 mm,作为斑块形成,测量各个孤立性斑块的最大厚度,然后相加,即作为斑块Crouse积分,两侧同一动脉计分相加作为该动脉斑块总积分。

2 结 果
2.1 RA患者发生CHD的单因素分析结果2组年龄、RA病程、高血压史、糖化血红蛋白、尿酸等差异有统计学意义(P<0.05),见表1。
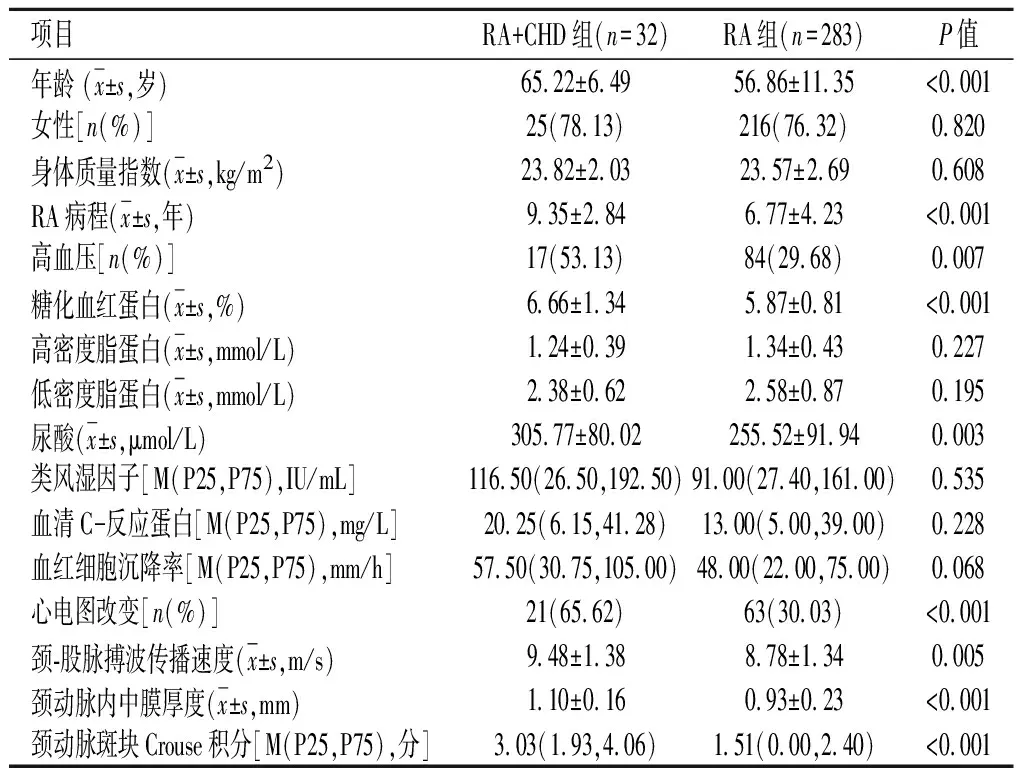
表 1 RA患者临床资料的比较
2.2RA患者发生CHD的多因素Logistic回归分析结果根据单因素分析结果并结合专业,以组间差异有统计学意义的因素为自变量,以是否发生冠心病为因变量进行二分类Logistic回归分析,结果显示,高血压、糖化血红蛋白、RA病程、cfPWV、颈动脉斑块Crouse积分、尿酸、心电图改变是RA患者发生CHD的危险因素(P<0.05),见表2。
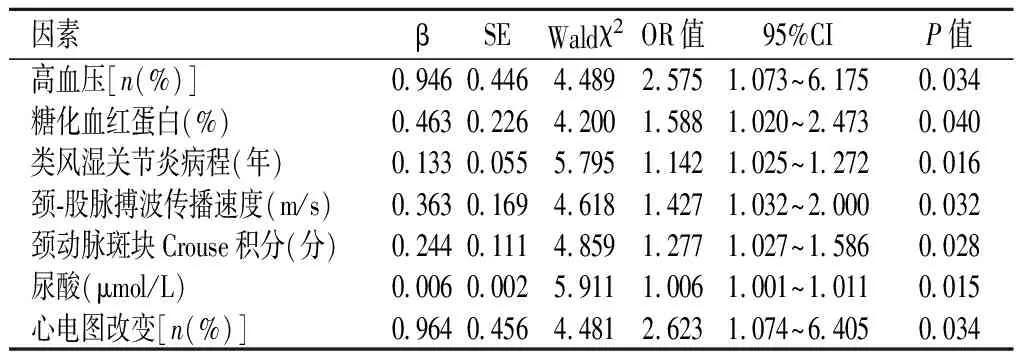
表 2 RA患者发生CHD的多因素Logistic回归分析
2.3RA患者发生CHD列线图预测模型的建立根据上述Logistic多因素回归分析模型结果,建立RA患者发生CHD的列线图预测模型,见图1。总评分越高,RA合并发生CHD的风险越高。该模型校正曲线中标准曲线与校准预测曲线贴合良好 ,见图2,说明本研究的列线图预测模型预测能力较好。对列线图预测模型进行内部验证,C-index指数为0.89(0.825~0.903),同时通过绘制ROC 曲线得出校正前曲线下面积为0.853(95%CI:0.810~0.891),校正后AUC为0.867(95%CI:0.825~0.903),校正前后差异有统计学意义(P<0.05),C-index指数和校正后AUC>0.75,表明该模型区分能力较好。见图3。

图 1 RA患者发生CHD的列线图预测模型
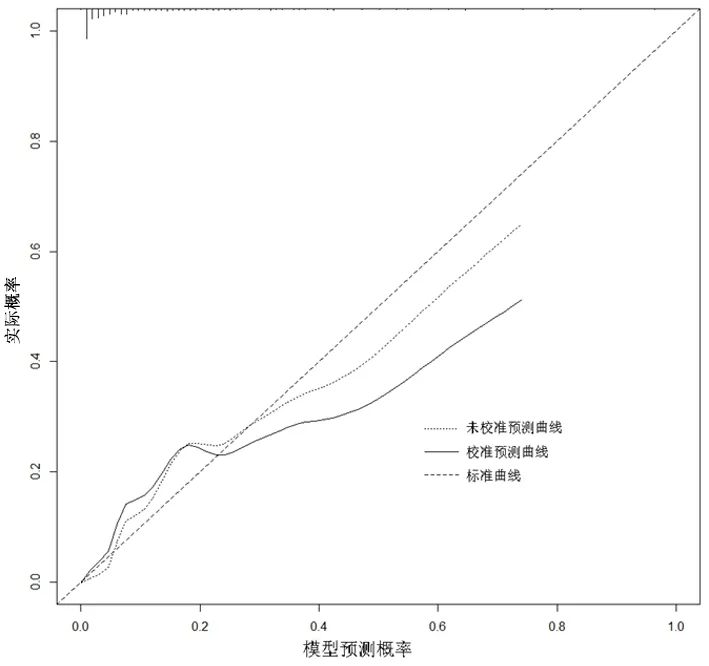
图 2 RA患者发生冠心病预测模型的校正曲线
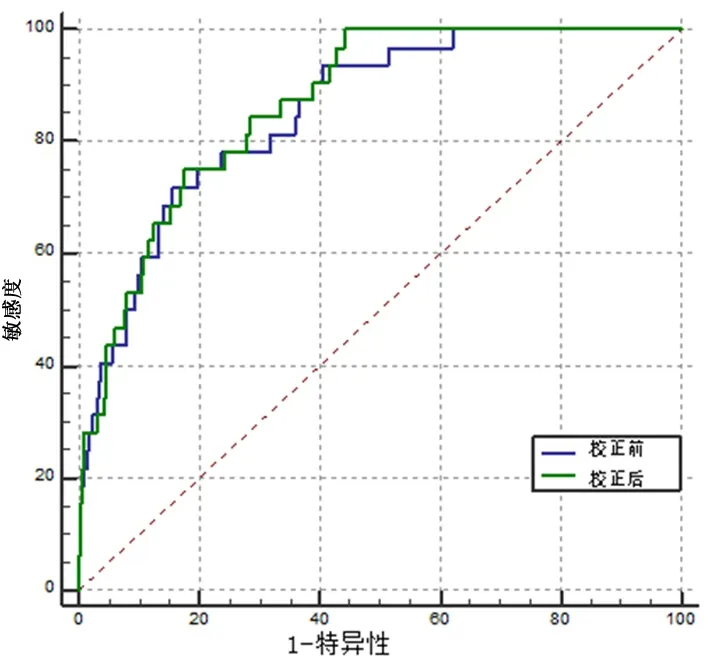
图 3 列线图模型预测RA发生冠心病的ROC曲线图
3 讨 论
RA与动脉粥样硬化加速相关[10],RA发生CHD的风险不能仅用传统心血管危险因素解释,根据10年Framingham评分风险表,RA患者属中度风险[11]。研究表明包括ACC/AHA-ASCDV风险指数在内的用于一般人群的模型无法评估RA真实心血管疾病(cardio vascular disease, CVD)风险[12]。
上述危险分层基于临床和生化参数,此外,还可通过超声、冠状动脉钙化积分、CTCA、正电子发射断层扫描和心血管磁共振等无创心血管(cardio vascular, CV)成像技术。但上述技术受电离辐射、费用、示踪剂等的限制,大范围开展存在难度[13-14]。超声可测量颈动脉内中膜厚度和动脉粥样硬化斑块,其存在可预测冠状动脉事件,也被用作亚临床动脉粥样硬化和高CV风险的金标准试验[15]。cfPWV也是公认的心血管不良预后的预测因子,其预测值高于经典CV危险因素[16]。本研究RA+ CHD组IMT、Crouse积分及cfPWV均显著高于RA组。这些指标在血管树不同层次反映了动脉硬化的不同方面。本研究将既往研究[17-18]报道过的几种超声指标与心电图、实验室数据结合,旨在对RA患者发生CHD风险进行更为准确的预测。
本研究单因素分析显示RA合并CHD组年龄、高血压比例及HbA1c、UA均高于RA组,说明这些传统CV危险因素同样也是其CVD风险增加的原因,这与A. Dalbeni等[19]的研究结果一致。RA炎性滑膜炎表现与动脉硬化间有共同的炎症反应过程,有文献亦指出全身炎症与动脉硬化间存在潜在关系[20]。RA+CHD组病程长于RA组,提示RA者炎症长期活动和自身免疫系统的紊乱也增加了CVD风险。本研究中CRP、ESR和RF这3个炎症标志物RA+CHD组数值均高于RA组,虽差异无统计学意义,也将其纳入校正,未进入模型的原因考虑可能在于这些参数不能很好地反映患者长期的炎症负荷状态,此次也未对入选者按疾病活动度细化分组。此次回顾性分析观察期较长,期间难免使用降脂、降压等药物,故不考虑药物的影响。HDL-C、LDL-C组间无差异可能与服用他汀类药物有关。但药物均按指南规范使用,所以这些数据是实际的,模型也更实用。
列线图实现了回归分析结果的可视化和图形化,能对临床事件进行个性化的预测、分析[21]。本研究模型弥补了单一指标单独预测时的不足,且其中各指标获取安全,可操作性强,对高风险或有造影剂使用禁忌的患者,临床可及时干预,降低CVD风险。
综上所述,本研究联合超声参数颈动脉Crouse积分和cfPWV、实验室参数UA和HbA1c以及ECG、高血压史、RA病程构建的列线图模型,对RA患者发生CHD具有较高的预测价值,可为RA患者发生CHD的筛查和诊断提供可靠依据。