LINC00665靶向miR-761调控Wnt/β-catenin信号通路影响胶质瘤细胞增殖、细胞周期分布和凋亡
陈宁军,刘志刚,赵 军,李 剑
(1.西安医学院附属宝鸡医院 神经外科,陕西 宝鸡721006;2.陕西省第四人民医院神经外科,陕西 西安710043;3.江油市第二人民医院 神经外科,四川 江油621701;4.空军军医大学第一附属医院西京医院 神经外科,陕西 西安710032)
胶质瘤最常见的原发性脑肿瘤,占所有脑恶性肿瘤的50%-60%[1]。根据肿瘤的大小、类型、分级、部位以及患者年龄和整体健康状况,临床主要采用手术切除后放疗、化疗、中医治疗、基因治疗等治疗手段[2]。然而由于其放化疗抗性的出现,胶质瘤患者的中位生存期不足12个月[3]。因此,阐明胶质瘤发生发展的分子机制开发有效的胶质瘤诊疗方法对改善胶质瘤治疗现状意义重大。研究显示长链非编码RNA(long non-coding RNA,lncRNA)通过调控转录、转录后加工、基因组印记、蛋白质功能在细胞生长、肿瘤发生中发挥重要作用[4]。LINC00665是近年来发现的基因间lncRNA,研究显示LINC00665高表达与肝癌患者的肿瘤分级、分期以及总生存期明显相关,参与对肝癌细胞细胞周期的调控[5]。在胃癌中LINC00665也呈高表达,抑制LINC00665显著降低胃癌细胞的活力和体外侵袭能力[6]。然而LINC00665在胶质瘤细胞中的作用并未阐明。miR-761在神经胶质瘤组织中表达下调,上调miR-761表达可抑制胶质瘤细胞的增殖和迁移[7]。生物信息学分析显示miR-761是LINC00665的潜在靶基因,但LINC00665能否靶向miR-761参与胶质瘤进展尚未可知。本实验旨在揭示LINC00665在胶质瘤细胞中的表达以及对胶质瘤细胞增殖、细胞周期分布和凋亡的影响。
1 材料与方法
1.1 实验材料
人胶质瘤细胞系A172、U-251MG、SHG139以及人脑正常胶质细胞HEB购于中国科学院上海细胞库;DMEM培养基、RPMI-1640培养基、MEM-EBSS培养基、胎牛血清、青链霉素双抗购于美国Gibco公司;TRIzol试剂、RIPA裂解液、二喹啉甲酸(Bicinchoninic acid,BCA)试剂盒购于北京索莱宝公司;si-con、si-LINC00665、miR-con、miR-761、anti-miR-con、anti-miR-761、野生型荧光素酶报告基因载体(WT-LINC00665)、突变型荧光素酶报告基因载体(MUT-LINC00665)以及PCR引物由上海吉凯基因化学技术有限公司提供;细胞计数试剂盒(Cell Counting Kit 8,CCK-8)、细胞周期与细胞凋亡检测试剂盒购于上海碧云天公司;兔源Ki-67、兔源细胞周期素D1(CyclinD1)、兔源Cleaved caspase-3、兔源β-连环蛋白(β-catenin)、兔源c-myc抗体、鼠源β-actin抗体、山羊抗兔IgG、山羊抗鼠IgG购于美国Abcam公司。
1.2 实验分组
人胶质瘤细胞系A172以及人脑正常胶质细胞HEB采用DMEM培养基,SHG139细胞采用RPMI-1640培养基、U-251MG细胞采用MEM-EBSS培养基,于37℃、含5% CO2、相对湿度59%的细胞培养箱中进行培养,所有培养基中均添加10%胎牛血清和1%的青链霉素双抗。每1-2天更换一次细胞培养液,当细胞铺满瓶底的80%时进行细胞传代。取对数期细胞A172细胞进行后续实验。将A172细胞按照5×104cells/孔接种到6孔板,代细胞融合度约为60%时利用脂质体LipofectamineTM2000进行细胞转染,将A172细胞分为si-con组、si-LINC00665组、miR-con组、miR-761组,转染48 h,检测转染合格后进行后续实验分析。正常培养的A172细胞记为空白对照(Blank)组。为验证LINC00665是通过调控miR-761进而影响A172细胞的增殖、凋亡以及细胞周期分布,将A172细胞分为si-LINC00665+ anti-miR-con组、si-LINC00665+anti-miR-761组、转染48 h,进行后续实验分析。
1.3 RT-qPCR
采用TRIzol试剂提取细胞样本总RNA,以提取的总RNA为模板,逆转录为cDNA。按照RT-qPCR试剂盒SYBR Green法步骤进行扩增,扩增40个循环周期。分别以β-actin和U6为内参照,按照2-ΔΔCt公式计算LINC00665和miR-761的相对表达量。引物序列如下。LINC00665上游引物5′-AGCACCCCTAGTGTCAGTCA-3′,下游引物5′-TGGTCTCTAGGGAGGCAGAA-3′;β-actin上游引物5′-GAGCCTCGCCTTTGCCGATCC-3′,下游引物5′-CGATGCCGTGCTCGATGGGG-3;miR-761上游引物5′-ACAGCAGGCACAGAC-3′,下游引物5′-GAGCAGGCTGGAGAA-3′;U6上游引物5′-CTCGCTTCGGCAGCACA-3′,下游引物5′-AACGCTTCACGAATTTGCGT-3′。
1.4 CCK-8法检测细胞活力
转染后,将细胞按照3×103cells/孔接种到96孔板,37℃、含5% CO2、培养箱培养48 h,每孔加入10 μl的CCK-8试剂,培养箱孵育2 h,在酶标仪450 nm波长处检测各孔的吸光度值。
1.5 流式细胞术检测细胞周期的分布
细胞转染48 h时胰酶消化为单细胞悬液,预冷的PB清洗细胞2次,重悬细胞后,4 ℃固定过夜,碘化丙啶染色后,于流式细胞仪检测细胞周期的分布。
1.6 流式细胞术检测细胞凋亡
细胞转染48 h时胰酶消化为单细胞悬液,预冷的PB清洗细胞2次,取适量结合缓冲液重悬细胞于流式管内,分别加入膜联蛋白V异硫氰酸荧光素和碘化丙啶进行染色,避光孵育15 min后,于流式细胞仪检测细胞凋亡情况。
1.7 Western Blot检测Ki-67、CyclinD1、Cleaved caspase-3、β-catenin和c-myc蛋白的表达水平
细胞转染48 h时,收集各组细胞,RIPA裂解液提取各组细胞总蛋白。BCA法测定各组样本蛋白含量,调整蛋白浓度至3 mg/mL后沸水浴5 min变性细胞蛋白,冷却至室温后-80℃保存备用。取30 μg细胞蛋白进行聚丙烯酰胺凝胶电泳分离细胞蛋白。利用常规湿法转膜装置将细胞蛋白转移至硝酸纤维素膜,放于5%的脱脂牛奶中室温封闭2 h,TBST洗膜3 min,将膜置于已稀释的Ⅰ抗溶液中室温条件孵育2 h,TBST洗膜10 min×3次,将膜置于已稀释的Ⅱ抗溶液中室温条件孵育1 h,TBST洗膜10 min×3次,加入化学发光显色试剂显色,以β-actin为内参,利用Quantity One 4.40软件分析Ki-67、CyclinD1、Cleaved caspase-3、β-catenin和c-myc蛋白的表达水平。
1.8 双荧光素酶报告基因实验
采用生物信息学分析工具进行靶基因预测发现LINC00665和miR-761之间存在部分连续互补的核苷酸序列,推测miR-761是LINC00665的潜在靶基因。采用脂质体转染法将miR-761 mimics、miR-NC分别与WT-LINC00665或MUT-LINC00665共转染至SW620细胞,转染48 h,采用双荧光素酶报告基因实验检测各组SW620细胞的荧光素酶活性。同时将si-con、si-LINC00665、pcDNA、pcDNA -LINC00665分别转染至A172细胞,转染48 h,按照上述RT-qPCR检测步骤测定miR-761的表达水平。
1.9 统计学分析
2 结果
2.1 LINC00665和miR-761在人脑正常胶质细胞和胶质瘤细胞中的表达
见表1,与人脑正常胶质细胞HEB比较,胶质瘤细胞U-251MG、A172、SHG139中LINC00665的表达水平显著升高,miR-761的表达水平显著降低(P<0.05)。
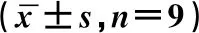
表1 人脑正常胶质细胞和胶质瘤细胞中LINC00665和miR-761的表达
2.2 沉默LINC00665抑制胶质瘤细胞增殖和诱导细胞凋亡及细胞周期阻滞
见图1和表2,与si-con组比较,si-LINC00665组A172细胞LINC00665的表达水平显著降低,Ki-67和CyclinD1蛋白的表达水平显著降低,Cleaved caspase-3蛋白的表达显著升高,细胞活力显著降低,细胞凋亡率显著升高,G0-G1期细胞数显著升高,S期细胞数显著降低(P<0.05)。
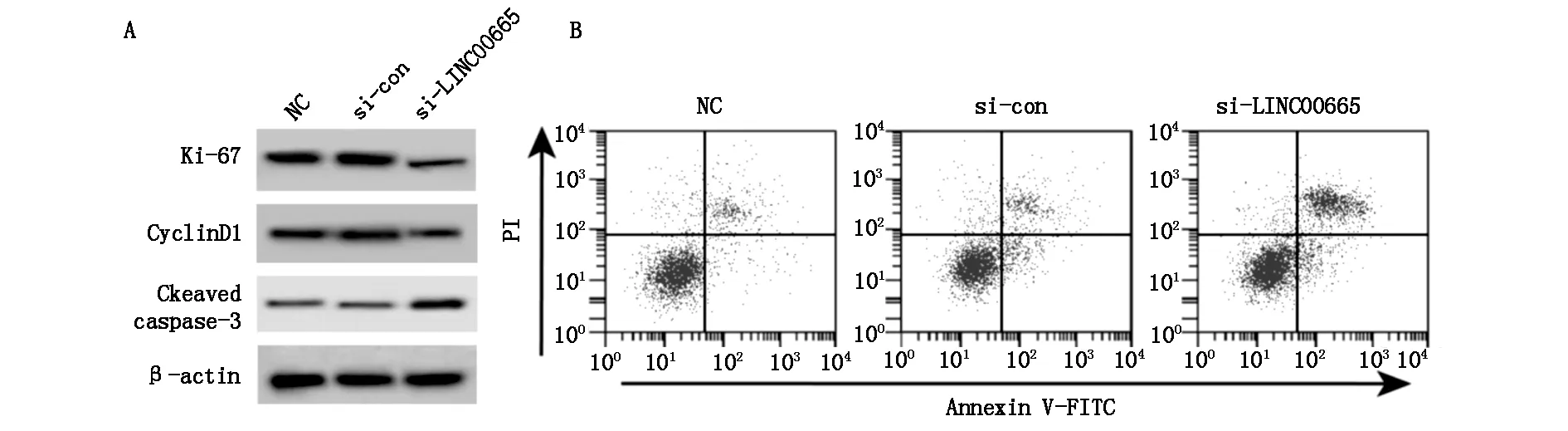
图1 Western blot检测胶质瘤细胞Ki-67、CyclinD1和Cleaved caspase-3蛋白表达及流式细胞术检测胶质瘤细胞凋亡
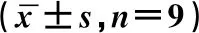
表2 沉默LINC00665对胶质瘤细胞增殖、细胞凋亡和细胞周期以及Ki-67、CyclinD1和Cleaved caspase-3蛋白表达的影响
2.3 LINC00665靶向miR-761调控其表达
采用starbase进行靶基因预测发现LINC00665与miR-761之间存在连续互补的核苷酸序列,见图2。双荧光素酶报告实验显示,miR-761 mimics和WT- LINC00665共转染组A172细胞的荧光素酶活性较miR-con和WT- LINC00665共转染组显著降低(P<0.05);miR-761 mimics和MUT- LINC00665共转染组A172细胞的荧光素酶活性较miR-con和MUT- LINC00665共转染组无明显变化,见表3。RT-qPCR显示下调LINC00665表达后A172细胞miR-761的表达水平显著升高;上调LINC00665表达后A172细胞miR-761的表达水平显著降低,见表4。

图2 LINC00665与miR-761互补的核苷酸序列
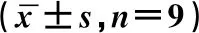
表3 双荧光素酶报告实验
表4 LINC00665调控miR-761的表达
2.4 过表达miR-761抑制胶质瘤细胞增殖和诱导细胞凋亡及细胞周期阻滞
见图3和表5,与miR-con组比较,miR-con组A172细胞miR-761的表达水平显著升高,Ki-67和CyclinD1蛋白的表达水平显著降低,Cleaved caspase-3蛋白的表达显著升高,细胞活力显著降低,细胞凋亡率显著升高,G0-G1期细胞数显著升高,S期细胞数显著降低(P<0.05)。

图3 Western blot检测胶质瘤细胞Ki-67、CyclinD1和Cleaved caspase-3蛋白表达及流式细胞术检测胶质瘤细胞凋亡
表5 过表达miR-761对胶质瘤细胞增殖、细胞凋亡和细胞周期以及Ki-67、CyclinD1和Cleaved caspase-3蛋白表达的影响
2.5 抑制miR-761部分逆转沉默LINC00665对胶质瘤细胞增殖、凋亡以及细胞周期分布的影响
见图4和表6,与si-LINC00665+anti-miR-con组比较,si-LINC00665+anti-miR-761组A172细胞miR-761的表达水平显著降低,Ki-67和CyclinD1蛋白的表达水平显著升高,Cleaved caspase-3蛋白的表达显著降低,细胞活力显著升高,细胞凋亡率显著降低,G0-G1期细胞数显著降低,S期细胞数显著升高(P<0.05)。

图4 Western blot检测胶质瘤细胞Ki-67、CyclinD1和Cleaved caspase-3蛋白表达及流式细胞术检测胶质瘤细胞凋亡
表6 转染anti-miR-761和si-LINC00665对胶质瘤细胞增殖、细胞凋亡和细胞周期以及Ki-67、CyclinD1和Cleaved caspase-3蛋白表达的影响
2.6 LINC00665调控miR-761影响胶质瘤细胞Wnt/β-catenin信号通路
见图4和表7,与si-con组比较,si-LINC00665组A172细胞β-catenin和c-myc的表达水平显著降低;与si-LINC00665+anti-miR-con组比较,si-LINC00665+anti-miR-761组A172细胞β-catenin和c-myc的表达水平显著升高(P<0.05)。
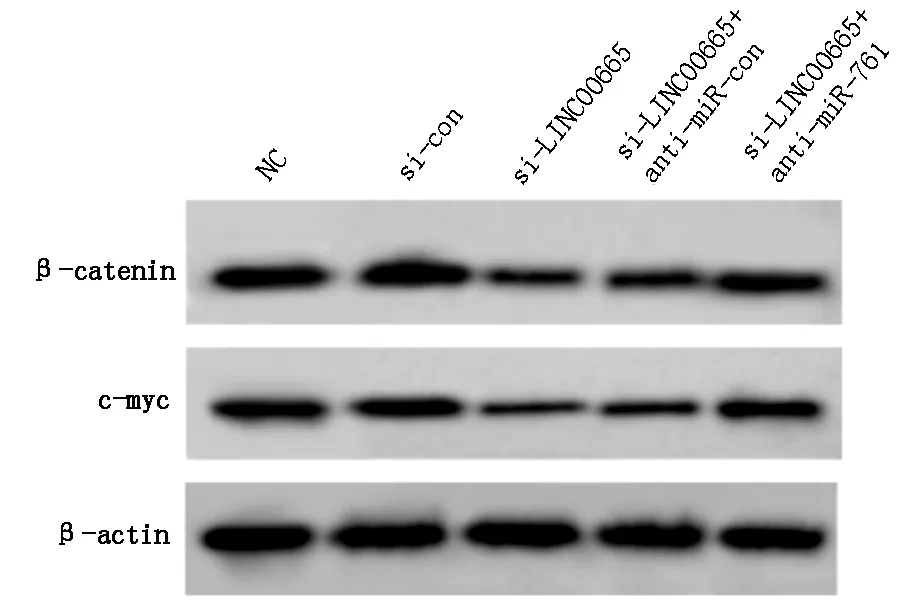
图4 Western blot检测胶质瘤细胞β-catenin和c-myc蛋白表达
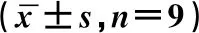
表7 转染anti-miR-761和si-LINC00665对胶质瘤细胞β-catenin和c-myc蛋白表达的影响
3 讨论
lncRNA作为活跃的生物分子,在包括胶质瘤在内的多种肿瘤中发挥重要调控作用。因此,阐明lncRNA在胶质瘤进展中的作用有助于开发有效的胶质瘤诊疗方法。
LINC00665在肺腺癌中显著上调,其高表达在体外和体内均可增强癌细胞的增殖和转移,是肺腺癌不良预后的独立预测因子[8]。LINC00665在肝癌中表达上调,LINC00665高表达与肝癌患者生存期较短显著相关,沉默LINC00665降低肝癌细胞活力并诱导凋亡和自噬[9]。此外,沉默LINC00665还可抑制非小细胞肺癌细胞增殖和诱导细胞凋亡,提高对吉非替尼的敏感性[10]。本研究显示3种胶质瘤细胞中LINC00665的表达水平显著升高,沉默LINC00665显著降低A172细胞活力,引起细胞周期G0-G1期阻滞,促进细胞凋亡,与上述LINC00665的致癌作用一致。细胞增殖失控和凋亡异常是恶性肿瘤的重要特征,检测增殖、凋亡相关蛋白的表达发现促增殖蛋白Ki-67的表达显著降低,促凋亡蛋白Cleaved caspase-3的表达显著降低。CyclinD1是推动细胞周期从G1期向S期转换的关键因子,其过度表达导致胶质瘤细胞增殖失控,促进胶质瘤的发生和发展[11]。本研究显示沉默LINC00665后A172细胞CyclinD1的表达显著降低。提示LINC00665在胶质瘤进展中发挥重要作用,有望成为胶质瘤治疗的潜在靶点。
既往研究表明miR-761在胶质瘤[7]、结直肠癌[12]中发挥抑癌基因作用,本研究显示3种胶质瘤miR-761的表达水平显著降低,与LINC00665的表达呈负相关关系。进一步研究显示LINC00665与miR-761之间存在相互作用,且LINC00665靶向负调控miR-761表达。过表达LINC00665显著降低A172细胞活力,引起细胞周期G0-G1期阻滞,促进细胞凋亡。然而,在肝癌[13]和非小细胞肺癌[14]中miR-761发挥癌基因作用,LINC00665高表达促进肿瘤的生长和转移。此外,本研究发现抑制miR-761部分逆转沉默LINC00665对胶质瘤细胞增殖、凋亡以及细胞周期分布的影响。Wnt/β-catenin途径是一个高度保守的信号通路,对中枢神经系统发育至关重要,其改变与癌症的发生密不可分[15]。在胶质瘤细胞中,抑制Wnt/β-catenin途径可影响细胞周期,抑制肿瘤细胞的增殖和存活[16]。在胃癌细胞中沉默LINC00665通过抑制Wnt/β-catenin信号通路抑制胃癌进展[17]。本研究显示沉默LINC00665后A172细胞中Wnt/β-catenin通路活化受到抑制,而抑制miR-761部分逆转沉默LINC00665对Wnt/β-catenin信号通路的影响。提示LINC00665靶向miR-761调控Wnt/β-catenin信号通路影响胶质瘤的增殖、凋亡和细胞周期分布。
综上所述,LINC00665在胶质瘤中表达上调,miR-761表达下调。沉默LINC00665通过上调miR-761抑制Wnt/β-catenin信号通路活化进而引起胶质瘤细胞G0-G1期阻滞、抑制细胞增殖,促进细胞凋亡。因此,LINC00665/miR-761分子轴可以作为胶质瘤治疗的潜在靶点。

