海相软土场地水泥土劣化机理室内试验研究*
董猛荣, 杨俊杰, 王 曼, 刘 强
(1. 海洋环境与生态教育部重点实验室(中国海洋大学),山东 青岛 266100;2. 中国海洋大学环境科学与工程学院,山东 青岛 266100; 3.山东科技大学地球科学与工程学院,山东 青岛 266590)
由于城市及港口发展的需要及水泥土造价低、施工方便、整体性强、设计灵活等特点,水泥土材料被广泛应用于中国的围海造陆、跨海工程、海底隧道工程等港口和海岸建设。然而,长期处在海相软土等环境中的水泥土,因海水中腐蚀离子的腐蚀作用而不可避免的发生强度降低[1-7]、渗透性增大[8]的劣化现象。劣化是化学变化引起的物理变化过程,揭示水泥土劣化机理可为研制抗劣化固化剂提供理论依据。
杨俊杰等[7, 9]根据工程背景,将加固体的劣化问题分为在非腐蚀场地形成后由于场地受到污染而发生的劣化问题(第一类劣化问题)和在腐蚀场地形成的加固体的劣化问题(第二类劣化问题),并归纳总结了两类劣化问题的室内模拟试验方法。两类劣化问题室内模拟试验方法的不同之处在于水泥土在与腐蚀环境接触之前是否需要进行标准养护。
国内外学者多采用将标准养护成型后,即具有一定强度的水泥土置于腐蚀环境的方式模拟研究水泥土的劣化问题(第一类劣化问题)。而在腐蚀场地形成的水泥土,在形成强度之前即与腐蚀环境接触,水泥土不应预先进行标准养护。而且,水泥土的强度具有随时间增长的性质,且初期强度增长较快,腐蚀场地形成的水泥土在强度增长的同时也受到腐蚀物质的侵蚀发生劣化,所以,在模拟试验中水泥土与腐蚀环境接触前是否经过养护,其劣化机理不尽相同。
关于第一类劣化问题的水泥土劣化机理在此不赘述[10-20]。本文研究海相软土场地水泥土的劣化机理,属于第二类劣化问题。
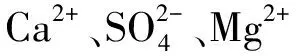
闫楠等[22-23]将水泥与日照岚山港吹填淤泥质土(含水率为液限的1.5倍,称为原土)混合制备水泥土试样,放入海水和原土中养护7、14、28、60、90、180和360 d后进行X射线衍射、扫描电镜、离子分析等试验。劣化层中C-S-H、C-A-S-H含量增多,水化产物含量减少,认为海水中侵蚀离子对水泥水化产物有抑制和消耗作用,Mg2+、、Cl-、pH值是影响水泥强度的主因。将海水中水泥土强度衰减过程分为腐蚀介质抑制水泥土表面强度增长的过程和促使水泥强度由表及里不断降低的过程。
腐蚀场地中的水泥土在形成强度的过程中,在水泥土与土体界面附近,由于水泥土与土体中同种离子浓度的不同,使水泥土和土体之间发生离子扩散及离子交换作用。水泥土的劣化机理与其周围土体密切相关,但目前的研究仅以水泥土为研究对象,忽略了水泥土与土体之间离子扩散作用和离子交换作用的影响。
本文将水泥土和周围土体作为研究对象,在土体中制备水泥土,养护一定龄期后测定水泥土与土体界面附近的水泥土和土体中的各离子浓度,通过分析水泥土和土体之间离子扩散和离子交换作用,揭示水泥土劣化的机理。
1 试验概况
1.1 试验材料
试验用土为海相软土,取自青岛胶州湾胶州经济技术开发区。运回试验室后去除大颗粒杂质,图1为处理后的试验用土,以下称为原土。

图1 处理后的试验用土(原土)
根据《土工试验方法标准》,测定胶州湾海相软土物理、化学性质,测试结果见表1和表2。
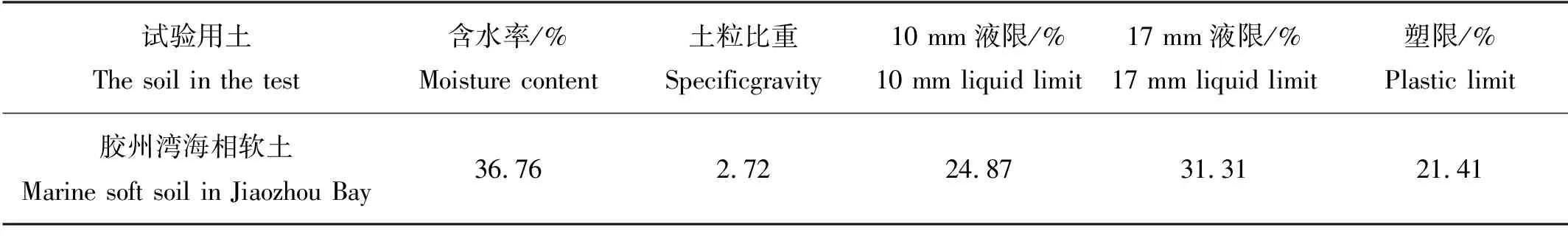
表1 试验用土物理性质

表2 试验用土主要离子浓度
试验用水泥为潍坊鲁元建材有限公司生产的42.5#普通硅酸盐水泥。
1.2 试验方法
原土用海水调整至1.5倍液限,以15%的水泥掺入比制备水泥土。如图2所示,将内径50 mm、高100 mm,壁厚2 mm的圆形套筒置于内径320 mm、深150 mm的容器中心并固定。将海相软土装入容器至1/2套筒高。将水泥土分三次装入套筒,期间用细铝棒不断振捣排除气泡。继续将海相软土装入容器中,与套筒平齐后缓慢拔出套筒;继续装入海相软土至高出水泥土顶端20 mm。
对达到指定龄期(28、60、90 d)的试样取样,用滴定法进行离子浓度测定,取样位置见图3,水泥土内部3个样,分别距界面0~5、5~10和10~15 mm,土体中3个样,分别距界面0~10、10~20和20~30 mm。每个试样3个平行样取平均值。
取样后,风干、研磨并制备浸出液,依据《土工试验方法标准》(GBT 50123—1999)测定相应的离子浓度。
同时为分析劣化力学特性与离子分布的关系,本文对相同条件下劣化90 d的水泥土烧杯试样实施微型贯入试验。
首先将配置好的水泥土填入内径85 mm,上内径90 mm,高105 mm的塑料烧杯中,分三层填入,放入养护桶中央并填入原土直至高出试样顶面2cm。养护桶为下内径135 mm,上内径150 mm,高150 mm的塑料桶,每14天换土一次。达到90 d时实施微型贯入试验,试验所用探针角度60°,探头直径3.4 mm,贯入阻力达到平稳后停止贯入。试验过程及贯入点位置如图4所示。

图2 制样过程

图3 离子浓度测定取样位置

图4 试验过程及贯入点位置
2 试验结果与分析

图5为28 d龄期时离子浓度在水泥土和土体界面附近的分布情况。

图5 28 d龄期时离子浓度在水泥土和土体界面附近的分布
如图5(b)所示,距离水泥土表面越近,Mg2+在水泥土中浓度越高;而在土体中,Mg2+浓度随距界面距离的变化不明显。水泥土表层的Mg2+与水化产物发生反应生成Mg(OH)2,Mg(OH)2溶解度低,易沉淀,但进行离子浓度测定时需要制备浸出液,导致了Mg2+的溶出,使得测得的Mg2+浓度偏高。
如图5(d)所示,Cl-浓度水泥土内外差别明显,土体中Cl-浓度明显高于水泥土中Cl-浓度。在水泥土中,离水泥土表面越近,Cl-浓度越高,在土体中,离界面越远,Cl-浓度有增加的趋势。水泥土中的Cl-与水泥成分中的铝酸三钙(C3A)发生反应生成水化氯铝酸钙(C3A·CaCl2·nH2O),导致水泥土中的Cl-浓度降低;Cl-分子量小,很容易进入水泥土中,导致水泥土表层Cl-浓度升高。
图6为60 d龄期时离子浓度在水泥土和土体界面附近的分布情况。

图6 60 d龄期时离子浓度在水泥土和土体界面附近的分布
图7为90 d龄期时离子浓度在水泥土和土体界面附近的分布情况。
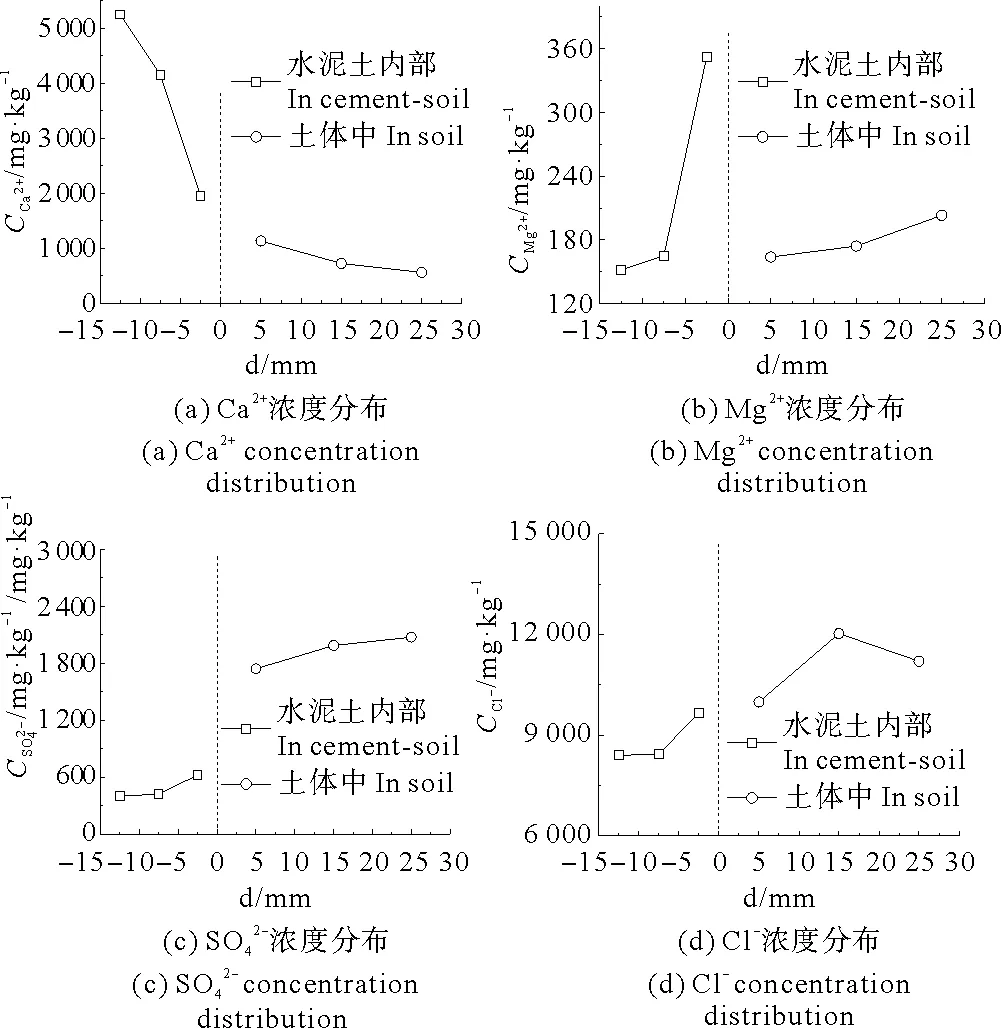
图7 90 d龄期时离子浓度在水泥土和土体界面附近的分布

图8为各位置处离子浓度随养护时间的变化情况。

图8 各位置处离子浓度随养护时间的变化情况
由图8可知,Ca2+浓度随时间在水泥土内部逐渐升高,在水泥土表层呈现逐渐降低的趋势,在土体中变化不明显。随着养护时间的增加, Mg2+扩散进入水泥土,消耗了水化硅酸钙(C-S-H)与水化铝酸钙(C-A-H),生成了胶结性较差的水化硅酸镁(M-S-H)与水化铝酸镁(M-A-H),置换出了部分Ca2+,从而使其浓度升高,同时被置换出的Ca2+在界面处不断向土体中扩散,导致了水泥土靠近界面处Ca2+浓度的降低。
Mg2+浓度随时间在水泥土表层有升高的趋势,但在水泥土内部及土体中,Mg2+浓度逐渐降低。在水泥土内部Mg2+逐渐与水泥水化产物发生反应,导致了Mg2+浓度随养护时间降低,在水泥土表层,Mg(OH)2的不断析出使其浓度升高,土体中的Mg2+不断向水泥土扩散,使其浓度降低。
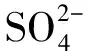
Cl-浓度随时间在水泥土内部逐渐升高,在水泥土表层60 d前升高,60 d后则有降低的趋势;在土体中, Cl-浓度均随时间逐渐降低。Cl-分子量较小,扩散较快,土体中的Cl-扩散至水泥土内部导致土体中Cl-浓度逐渐降低,60 d后水泥土劣化较严重,水泥土表层及土体中与水泥土界面处成分趋于一致,所以水泥土表层Cl-浓度与土体中Cl-浓度变化趋势一致。
图9为90 d龄期水泥土烧杯试样的微型贯入试验结果。
图9 90 d龄期原土养护水泥土微型贯入试验贯入曲线
杨俊杰等[21]根据劣化及未劣化试样贯入阻力曲线特征定义了劣化深度(见图10),如图所示,劣化层包括贯入阻力为零的完全劣化层(深度为D1)和劣化过渡层(深度为D2),劣化层的深度D即为劣化深度。
由图10可知,水泥土的劣化深度为1.2 mm,劣化区水泥土中离子含量明显异于未劣化部分,但在未劣化区离子浓度均随深度的增加逐渐减少或逐渐增多,说明离子扩散先于扩散发生。
图11为基于上述试验结果与分析得到的水泥土和土中不同位置处各离子反应及扩散情况。
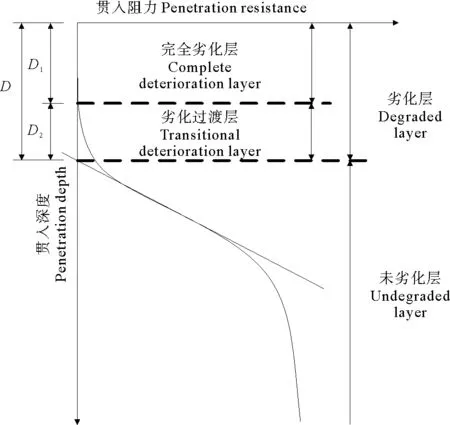
图10 由贯入阻力曲线定义的劣化深度

图11 水泥土和土中不同位置处各离子反应及扩散情况
3 海相软土场地水泥土劣化机理
水泥土强度的增加是缘于水化反应生成的水化产物的胶结作用并填充孔隙,而腐蚀离子对水泥土强度的影响体现在干预水化反应进程和分解水化产物两个方面。以下从上述两个方面分析水泥土劣化机理。
3.1 腐蚀离子干预水泥水化反应进程
3.1.1 水泥水化反应过程 水泥水化反应过程见图12。
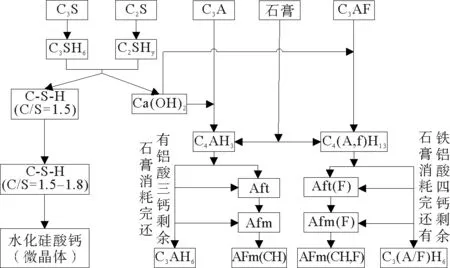
图12 水化反应过程图
① C3S/C2S的水化
在硅酸三钙(C3S)、硅酸二钙(C2S)结构中,钙离子的配位数处于不规则状态,因而使钙离子具有较高的活性,其结构具有热力学不稳定性,遇水会发生水化反应。C3S/C2S的水化反应见下式:
3 CaO·SiO2+ nH2O→
xCaO·SiO2·yH2O+(3-x) Ca(OH)2。
(1)
2 CaO·SiO2+ nH2O→
xCaO·SiO2·yH2O+(2-x)Ca(OH)2。
(2)
C3S及C2S与水发生反应,生成水化硅酸钙(xCaO·SiO2·yH2O,此后简写为C-S-H)与氢氧化钙(Ca(OH)2,此后简写为CH)。C-S-H为水泥水化最重要的产物,表面积大(100~700 m2/g),占水泥水化体积的50%~60%。CH为较为粗大的晶体,生成过多会造成水泥强度的降低,但其是维持水泥石体系较高碱度,稳定C-S-H的重要物质。
C3S/C2S的水化过程分为五个阶段:诱导前期、诱导期、加速期、减速期、稳定期。
诱导前期:Ca2+和OH-迅速释放, pH值迅速上升值至12,溶液具有强碱性。此时期反应迅速,但时间较短,15 min内结束。

加速期:CH和C-S-H开始从溶液中析出,C3S再开始继续迅速地发生反应。大量放热,水泥开始硬化。时间是水化反应开始后的4~8 h。
减速期:C-S-H包裹着土颗粒表面,形成屏障,离子需要扩散到屏障内部才能继续反应。水化反应速率逐渐下降,受扩散速率控制。时间是水化反应开始后的12~24 h。
稳定期:水化产物开始在C3S粒子原始周界内部形成和生长,水化向稳定期转变。
② C-S-H的转化
水化产物C-S-H的组成是不定的,其CaO/SiO2的比值与所处的溶液中CH浓度有关:
CH浓度较低时,C/S值=1.5,C-S-H表现为硅酸凝胶态。
CH浓度较高时,C/S值=1.5~1.8,C-S-H表现为纤维状(称为Ⅰ型C-S-H)。
CH浓度达到饱和时,C/S值=2,C-S-H表现为网格状(称为Ⅱ型C-S-H)。

图13 不同形态C-S-H扫描电镜图
随着水化反应的,CH不断生成,CH浓度不断提高,C-S-H的形态也随着时间缓慢变化。
③ C3A的水化反应
铝酸三钙(C3A)由许多四面体、八面体组成, Ca2+松散的联结,其中含有0.147 nm的大孔穴OH-可以很容易进入晶格内部。C3A水化反应有两种水化方式:
C3A单独水化:
C3A + 27H → C4AH19+C2AH8。
(3)
其中:C4AH19在R.H<85%时容易失水变成C4AH13。C4AH19、C4AH13、C2AH8、均为六方片状晶体,在常温下都处于介稳状态,有转化为等轴C3AH6的趋势。
④ CH浓度达饱和时C3A的水化:
C3A+CH+12H→C4AH13。
(4)
由于C4AH13在碱性环境中稳定存在且增长很快,会发生瞬凝的现象。
⑤ C4AH13转化为AFt的反应。
在石膏存在的情况下,C4AH13会与石膏反应生成三硫型水化硫铝酸钙(化学式C3A·3CS·H32,简写为AFt)。
C4AH13+3CSH2+14H→C3A·3CS·H32+CH 。
(5)
AFt又称钙矾石,是一种溶解度比较低的膨胀性物质,生成AFt后,体积膨胀1.27倍,少量生成可以填充孔隙增强水泥土强度,但是生成过多时会引起水泥土的胀裂。
⑥ AFt转化为AFm的反应
当石膏消耗完而C3A还有剩余时,会发生下式的反应,生成单硫型水化硫铝酸钙(化学式C3A·CS·H12,简写为AFm):
2C4AH13+C3A·3CS·H32→3C3A·CS·H12+CH+20H 。
(6)
与AFt类似,AFm也是一种膨胀性产物。
⑦ AFm转化为AFm(CH)的反应
石膏掺量极少,所有的AFt都转化为AFm还有C3A剩余
C3A·CS·H12+ C3A+CH+12H →2C3A(CS· CH)H12。
(7)
⑧C4AF在无石膏环境中水化
无石膏时,在Ca(OH)2环境水化,化学反应见下式:
C4AF + 4CH + 22 H →2C4(A·F)H13。
(8)
⑨ C4AF在无石膏环境中水化
C4AF+2CH+6CSH2+50H→2C3(A·F)·3CS·H32。
(9)
⑩AFt(F)转化为AFm(F)的反应
石膏不足时
2C4(A·F)·H13+C3(A·F)·3CS·H32→3C3(A·F)·CS·H12。
(10)
C3(A·F)·CS·H12 + C4AF+CH+12H→
2C3(A·F)(CS· CH)H12。
(11)
可以看出,C4AF与C3A水化反应过程及产物非常相似。
根据结晶理论,硬化水泥浆体是由多种形貌的C-S-H以及钙矾石、CH和单硫型水化硫铝酸钙等晶体交织在一起形成的。它们密集连生交叉结合、接触,形成牢固的结晶结构网。水泥石的强度取决于结晶结构网中接触点的强度与数量。
根据水化反应过程可以看出,低含盐量利于水泥土强度提高可能有以下三方面原因:
(1)环境中的Ca2+进入水泥土中加速了水化反应过程①C3S/C2S的水化中的诱导期中CH的溶出,促进诱导期的结束,起到一定的早强作用。同时Ca2+浓度提高可使CH浓度提前达到饱和,促进网格状凝胶产物的生成。
(3)低浓度的Cl-可会与C3A和CH反应生成不溶性的水化氯铝酸钙,反应式如下:
C3A+CaCl2+nH2O=C3A·CaCl2·nH2O 。
(12)
水化氯铝酸钙的析出会填充孔隙,增加固相比例,提高早期强度;同时由于Cl-的存在,会产生盐效应,致使熟料矿物溶解度增大,提高钙矾石的溶解度,阻止其晶体的形成与长大,从而减轻对水泥土的破坏作用。图4(d)中可以看出在28 d时水泥土内部的Cl-浓度低于环境中Cl-浓度,说明Cl-在早期参加了反应。
3.1.3高含盐量不利于水泥土强度形成 过高的含盐量会阻碍水化产物的形成,影响强度的提高。可能有以下三方面原因。
(1)Mg2+在水泥土中会发生两个干扰水化的反应:
Mg(OH)2+SiO2→MgO·SiO2·H2O 。
(13)
Mg(OH)2+Al2O3→MgO·Al2O3·H2O 。
(14)
式(13)、式(14)分别生成了水化硅酸镁(M-S-H)与水化铝酸镁(M-A-H),M-S-H会分散与C-S-H凝胶之中,由于M-S-H是一种松散物质,胶凝性较差,所以其存在会在一定程度上破坏C-S-H凝胶的完整性。图7中水泥土内部Mg2+浓度随养护时间逐渐减低,说明了Mg2+参与了水泥土后期反应。
(2)大量存在的会导致Ca2+以二水石膏的形式析出,Ca2+浓度的降低阻碍了溶液C3S/C2S水化反应的进行。同时也降低了CH浓度,CH浓度较低时,会阻碍水化反应进行。
(3)当Cl-浓度过高时,会与C3A反应生成过量的水化氯铝酸钙,水化氯铝酸钙几乎没有凝胶作用,且此反应消耗很多CH与C3A,不利于水化反应的进行。且水化氯铝酸钙还会包覆在土颗粒和水化产物(C-S-H和C-A-H)表面,阻碍水化反应的进一步反应。
3.2 腐蚀离子分解水化产物
腐蚀离子分解水化产物将使水泥土强度降低,其机理可从以下四个方面阐述。
(1)土体中的Mg2+在水泥土表面或通过孔隙进入水泥土中,与C-S-H和C-A-H发生如下反应:
3CaO·2SiO2·3H2O+3MgCl2+9 H2O→
3CaCl2·6H2O+3Mg(OH)2+2SiO2。
(15)
3CaO·Al2O3·6H2O+3MgCl2+9 H2O→
3CaCl2·6H2O+3Mg(OH)2+Al2O3。
(16)
如式(15)、式(16)所示,Mg2+消耗了C-S-H与C-A-H,导致水泥土水化产物的分解,从而降低了水泥土的强度。由图7(b)可知,水泥土内部28 d后Mg2+浓度逐渐降低,说明在水化反应基本完成后Mg2+依然持续的发生反应,所以Mg2+是强度形成后,导致水化产物分解的重要离子。
(2)当浓度较高时,会与土体中的Ca2+及(C-A-H)发生如下反应。
(17)
4CaO·Al2O3·13H2O(C-A-H)+3(CaSO4·2H2O)+14H2O→3CaO·Al2O3·3CaSO4·32H2O+Ca(OH)2。
(18)
如式(17)、式(18)所示,与Ca2+发生反应产生大量石膏,析出结晶,石膏结晶体积是Ca(OH)2结晶的两倍,造成水泥土的胀裂,同时,石膏还会与C-A-H反应生成钙矾石,钙矾石体积为C-A-H体积的1.27倍,同样会造成水泥土的胀裂。
(3)当Mg2+和同时大量存在时,会发生r如下反应:
3CaO·2SiO2·3H2O+3MgSO4+10H2O→
3(CaSO4·2H2O)+3Mg(OH)2+2SiO2·4H2O。
(19)
如式(19)所示,C-S-H发生分解,生成石膏与Mg(OH)2,水化产物胶结性变差,同时石膏的析出会造成胀裂。
(4)也有学者认为,Mg2+、Cl-同时存在且浓度较高时,生成氯铝酸盐和镁氧氯化物以取代硫铝酸盐,产生具有强烈腐蚀性的钾镁矾(K2Mg2(SO4)3)。因此,当Cl-和Mg2+同时存在且浓度较大时,将进一步加剧水泥土的劣化。
4 结论
本文将水泥土和周围土体作为研究对象,基于室内试验得到的离子浓度时空分布规律,探讨了海相软土场地水泥土劣化机理。


(3)随着水化反应的进行,Ca2+不断生成,水泥土中足够多的Ca2+是保证水化反应进行及维持水化产物稳定的必要条件,Ca2+不断向土体扩散是水泥土劣化的原因之一。

