菲与纳米银对胶州湾表层沉积物反硝化作用的复合毒性效应评价*
孙鹏飞 , 白 洁,2, 李岿然, 白晓岩, 田延昭, 赵阳国,2
(1.中国海洋大学环境科学与工程学院,山东 青岛 266100; 2.中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100;3.中国海洋大学海洋生命学院,山东 青岛 266003)
多环芳烃(PAHs) 是分布于环境中具有潜在“三致”作用的有毒持久性有机污染物(Persistent Organic Pollutants, POPs)[7]。自然条件下PAHs很难降解,且水溶性较小,大部分进入水体的PAHs最终都被沉积物吸附,沉积物因此也成为PAHs的贮藏库[8-9]。不同类型水体中沉积物PAHs含量存在差异,一般以港口、海湾、河口沉积物中PAHs含量较高[10]。PAHs对微生物的致毒机理主要由于细胞加氧酶分解PAHs的过程中会形成环氧化物、二酮等一些活性很高的亲电中间体,激发态PAHs分子和环境中的分子反应并产生单线态氧,超氧化物、自由基等活性中间体可引起脂质过氧化,破坏细胞膜结构和组成,造成RNA和DNA的氧化损伤,降低酶活性[11-12]。此外,PAHs的降解产物和未降解的PAHs也能对细胞造成毒害[13]。近年来,有不少关于PAHs对土壤和沉积物中反硝化菌及反硝化功能影响研究,表明PAHs的添加既可以降低环境中narG、nirK、nirS、nrfA和nosZ等反硝化功能菌的基因丰度及多样性,又可以降低反硝化潜势(PDA),进而改变其群落结构和功能[7,14-15]。
纳米材料是指在三维尺度上至少有一维尺度小于100 nm的物质,越来越多的纳米材料应用于国民经济各个行业中,产量越来越大[16]。由于纳米材料具有高比表面积、非线性光学特性和催化特性等特殊物理化学性质,使其成为环境污染物的高效吸附剂。纳米银(silver nanoparticles, AgNPs)是目前应用最广泛、发展最快的一类纳米材料,由于独特的抗菌特性广泛用于传统行业和一些新兴领域。McGillicuddy等估计全球的每年纳米银的消耗量将超过360 t[17]。Gottschalk等通过模型预测欧洲、美国和瑞士各种类型沉积物中纳米银的浓度增长速度范围分别为978~8 593、153~1 638和965~10 184 ng·kg-1·a-1[18]。目前,污水、污泥处理及排放区域的水生生态系统所受纳米银污染的生态风险更为严峻,但随着纳米银产品生产及排放量的增加,以及污水、污泥等向河口及海洋的大量排放,而Ag+在环境中具有持久性和生物积累效应,对水生生物有很强的毒性,因此,河口及海洋生态系统也将面临越来越大的生态风险[18-19]。有研究表明纳米银可以显著影响土壤及沉积物中细菌的生长、活性和群落多样性[20-21]。纳米银颗粒及其释放的离子因静电吸引与细胞膜发生作用,破坏细胞膜完整性和流动性;纳米银也可以进入细胞内部,破坏细胞结构和DNA;纳米银颗粒和银离子能替换酶中金属离子而改变酶的三维构象,造成其活性钝化甚至失活[22]。研究发现纳米材料的毒性不仅来自于其本身,还在于其与环境中其他污染物发生相互作用,进而影响这些污染物在环境中的归趋和生物效应[18]。戴朝霞等研究表明,多壁碳纳米管和纳米氧化锌与菲(phenanthrene, Phe)复合可诱导鲫鱼脑部和肝脏组织中自由基的生成,并使菲在鱼脑、眼部和胚胎等部位富集量增加[23]。Schwab等研究发现碳纳米材料吸附有机污染物敌草隆(herbicide diuron),并与小球藻接触后,使污染物局部暴露浓度增大、毒性作用增强[24]。
近岸(包括河口和海湾)区域污染物浓度大、种类复杂,纳米材料与共存污染物间通过物理或者化学作用形成新的复合体,而形态和性质等的差异会改变纳米材料和共存污染物的毒性效应[25]。此外,河口、海湾环境条件复杂多变,河口区域具有复杂的动力环境、物质界面相互作用复杂、理化要素梯度变化大等特点,对于污染物的运输和扩散具有重要影响。两个区域不同的沉积物的组成、结构、盐度、氧化还原电位、有机质、营养盐等理化环境因子会影响PAHs和纳米材料的毒性效应。因此,准确评估PAHs与纳米材料复合污染物的环境影响就显得十分重要。菲作为三环PAHs 的典型代表,近年来在胶州湾、东海等海域检出率呈增高趋势[26-27]。随着纳米银的大量使用,部分纳米银通过不同方式进入河流,经过河口区最终汇聚到海洋。大部分纳米银会沉降到沉积物中,停留在水柱中的仅占不到5%[18]。本文分别以菲和纳米银代表PAHs和纳米材料,通过测定河口区和海湾区沉积物反硝化潜势的变化,在确定菲和纳米银单一及复合作用时的半数效应浓度(EC50)的基础上,进一步采用浓度相加模型(concentration addition model, CA)、独立作用模型(independence model, IA)和中效/联合指数等效图法(median effect/combination index-isobologram equation, CI)对二者复合作用及类型进行评价,并对评价方法进行了优选,以期为准确评估PAHs和米材料的环境危害提供科学依据。
1 材料与方法
1.1 现场样品采样及预处理
于2017年7月在大沽河河口区的E站(36°10′07″N, 120°08′11″ E)和胶州湾内的S站(36°07′37″N, 120°11′02″E)采集沉积物及水样(见图1)。用彼得森采泥器采集0~5 cm表层沉积物样品于无菌朔料袋中密封,采集底层海水于无菌水样瓶中。所有样品低温(4 ℃)保存立即带回实验室。将沉积物样品充分混匀后过1 mm标准筛,水样用0.22 μm无菌醋酸纤维膜过滤,用于实验室模拟培养。分别使用气相色谱质谱联用仪和电感耦合等离子体质谱仪测定沉积物中菲和银含量,E和S站菲含量分别为(0.035±0.003)和(0.041±0.004)mg/kg,银含量分别为(0.028±0.004)ng和(0.019±0.002) mg/kg。本研究中沉积物菲和银的背景值与实验添加值相比可忽略不计。
1.2 复合毒性模拟培养试验
模拟培养体系的建立:每个站位设置3个模拟培养实验组,分别为纳米银添加组、菲添加组及菲和纳米银复合添加组,各实验组设3个平行。污染物浓度的确定基于污染物单一作用预实验,通过24 h实验室模拟培养实验获得菲和纳米银单一作用于大沽河河口区和胶州湾内沉积物反硝化潜势的EC50,其中菲对河口区和湾内的EC50分别为44.66和61.19 mg·kg-1,纳米银分别为112.97和147.47 mg·kg-1。各组污染物添加浓度分别为各自EC50的0、0.125、 0.25、 0.5、 0.75、1、2和5倍(见表1)。将菲溶解在丙酮中,加入到风干沉积物中,得到菲浓度为 0(加入无菲的丙酮)、3.725、7.5、15、22.5、30、60和150倍EC50的母土,彻底混匀后,置于黑暗中过夜使丙酮挥发。添加C6H12O6和KNO3至经0.22 μm滤膜过滤的原位海水,使其终浓度分别为22和20 mmol·L-1;将纳米银溶解在上述原位海水中,搅拌均匀并4℃超声30 min,配制成纳米银浓度为0、0.125、0.25、0.5、0.75、1、2和5倍EC50的培养液。各浓度组实验培养体系将上述沉积物和培养液按比例混合。

图1 大沽河河口及胶州湾采样站位Fig.1 Sampling stations in DRE and JZB
反硝化潜势测定实验:根据Sørensen和Magalhaes等的研究方法[29-30],本文采取改进的乙炔(C2H2)抑制法测定沉积物反硝化潜势(沉积物与添加海水比例为1∶1)。(1)纳米银添加组:15 g待测沉积物湿样与15 mL添加有纳米银的营养盐混合置于60 mL血清瓶中;(2)菲添加组:0.5 g母土、15 g待测沉积物湿样与15 mL经0.22 μm 滤膜过滤且添加C6H12O6和KNO3的原位海水混合置于60 mL血清瓶中;(3)菲和纳米银复合组:0.5 g母土、15 g待测沉积物湿样及15 mL添加有纳米银的营养盐混合置于60 mL血清瓶中。每个污染添加组分为C2H2添加组和未添加C2H2组,每组3个平行,利用丁基橡胶塞和铝箔密封所有血清瓶,并用N2(1.5 atm)进行冲洗15 min,不停地摇以保证排出沉积物和水中的氧气,使整个培养环境处于厌氧状态。然后将C2H2添加组瓶内充入12 mL100%的C2H2气体(20%,v/v)以阻止N2O被进一步还原为N2。C2H2冲入的时刻定为厌氧培养开始的时刻(t=0),同时从C2H2添加组的培养瓶中取12 mL样气充入18 mL真空血清瓶中,然后将未添加C2H2组的培养瓶置于80 r·min- 1的恒温振荡器中,25 ℃避光培养24 h[31]。培养结束后从各培养瓶的顶空中抽取12 mL样气,充入18 mL真空血清瓶中用于N2O测定。液相中的N2O浓度根据Weiss等提出的溶解度公式计算得出[32]。添加C6H12O6和KNO3以防止C和N成为反硝化作用的限制因素,故本实验N2O测量值表示在特定条件下的反硝化潜势,反硝化潜势由T0和T24时刻N2O浓度的变化率计算[14]。

表1 各实验组污染物添加浓度Table 1 The concentrations of pollutants added to each experimental group /mg·kg-1
1.3 评价方法
本文选取固定浓度比例进行菲和纳米银二元复合毒性实验,应用CA、IA和CI法评价其对沉积物反硝化潜势的毒性效应。
1.3.1 浓度相加模型 通过以下方程将单个污染物对反硝化潜势的抑制效应转化为毒性单位(toxic unit,TU),
毒性单位法是浓度相加模型(concentration addition model, CA)的一种[33]。
TUi=Ci/EC50i。
(1)
式(1)中:Ci表示添加污染物的浓度,EC50表示引起沉积物反硝化潜势抑制50%时污染物的浓度,i表示单个的污染物(菲或纳米银)。
本文选择了改进的有毒单元模型评价复合毒性[30-31]。为了便于理解与使用,在毒性单元(TU)模型中,1TU表示单一污染物可以引起50%抑制效应(EC50)的浓度值。因此,根据1.2中所选取污染物浓度表示预计混合物抑制沉积物反硝化潜势相当于0、0.25、0.5、1、15、2、4 和10TU(见表1)。混合物的预测毒性是各污染物毒性单位的和,毒性方程如下:
EC50Prediction=1/(a/EC50Phe+b/EC50AgNPs),
(2)
(3)
式中:a和b分别是污染物菲和纳米银在混合污染物所占的重量比例,EC50prediction表示二元混合污染物预期引起50%效应的浓度。CPhe和CAgNPs分别表示二元混合污染物引起50%效应时菲和纳米银的浓度。EC50Phe和EC50AgNPs分别表示污染物菲和纳米银单一存在时引起50%效应的浓度。TUcompare表示实际混合物EC50值与预测混合物EC50经毒性单元转化后的比。若TUcompare=1,表示混合物对反硝化潜势的复合毒性效应为浓度相加;TUcompare<1,表示为协同作用;TUcompare>1,表示为拮抗作用[34-35]。
1.3.2 独立作用模型与应用 本研究采用独立作用模型(independence model, IA)来评价菲和纳米银对沉积物反硝化潜势的复合毒性作用类型[36-37]。其数学表达式为:

(4)
E(Phe,AgNPs)=E(Phe)+E(AgNPs)-E(Phe)E(AgNPs)。
(5)
式中:E(Phe或AgNPs)为污染物纳米银或菲对反硝化潜势的影响;E(Phe, AgNPs)为污染物复合作用对反硝化潜势影响的预测值。复合污染对沉积物反硝化潜势影响的观测值与通过式(3)得到的理论预测值相比,比值为1时,即差异不显著,为加合作用。如果比值小于1,则为协同作用;比值大于1,则为拮抗作用。
1.3.3 中效/联合指数等效图法 本研究采用中效公式(6)(median-effect equation)分析了菲和纳米银对沉积物反硝化潜势的毒性效应,该方法的一个重要特点是不需要了解每个污染物的毒性作用机制,并且还考虑到每个污染物的生物活性和剂量-效应曲线的形状[38]。
fa/(1-fa)=(C/EC50)m。
(6)
式中:fa表示某一污染物浓度为C时,反硝化潜势的抑制率。EC50为反硝化潜势抑制率为50%时污染物的浓度,m与剂量-效应曲线的斜率相关,m=1、m>1 和m<1分别表示双曲线型S型和反S型曲线。
对n种污染物的混合物产生x%效应的联合指数(CI)x(combination index, CI)可由公式(7)计算。
(7)
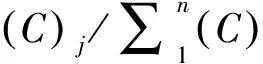
CI<1,CI=1,和CI>1分别表示协同作用、浓度相加和拮抗作用。相互作用程度根据Chou和Martin的推荐:CI值为0.85~0.9、0.7~0.85、0.3~0.7、0.1~0.3和小于0.1时,分别表示为轻微协同、中等协同、协同、强协同和极强协同作用[39]。
1.4 样品测定
在现场利用便携式氧化还原电位仪测定沉积物氧化还原电位(Eh),使用YSI6600多参数水质仪现场测定海水 pH、盐度等环境参数。使用元素分析仪测定沉积物N(CE-440, USA),利用烧灼失重率计算有机质含量(OM)[40],利用粒度分析仪测定沉积物粒度,沉积物含水率采用105 ℃烘干称重法测定,使用QuAAtro营养盐自动分析测定水体无机氮(DIN: NO3-, NO2-, NH4+)含量。2个站位水体和沉积物的主要环境参数见表2。N2O由配备了电子捕捉探测器的气相色谱仪(日本Shimadzu GC-14B)进行测定,采用标准气体做出的标准曲线进行N2O定量,该方法的检测极限约为20 nmol·L-1N2O。
1.5 数据分析
污染物对沉积物反硝化潜势的EC50值通过Sigma Plot 14.0(Jandel Corporation, CA, USA)软件的Logistic回归模型进行计算。利用计算机软件CompuSyn (http://www.combosyn.com/)计算混合物及其各个组分的剂量反应关系曲线参数、指数。采用SPSS 13. 0对试验数据进行平均值计算、方差分析。
2 结果与讨论
2.1 单一及其复合污染对反硝化潜势的影响

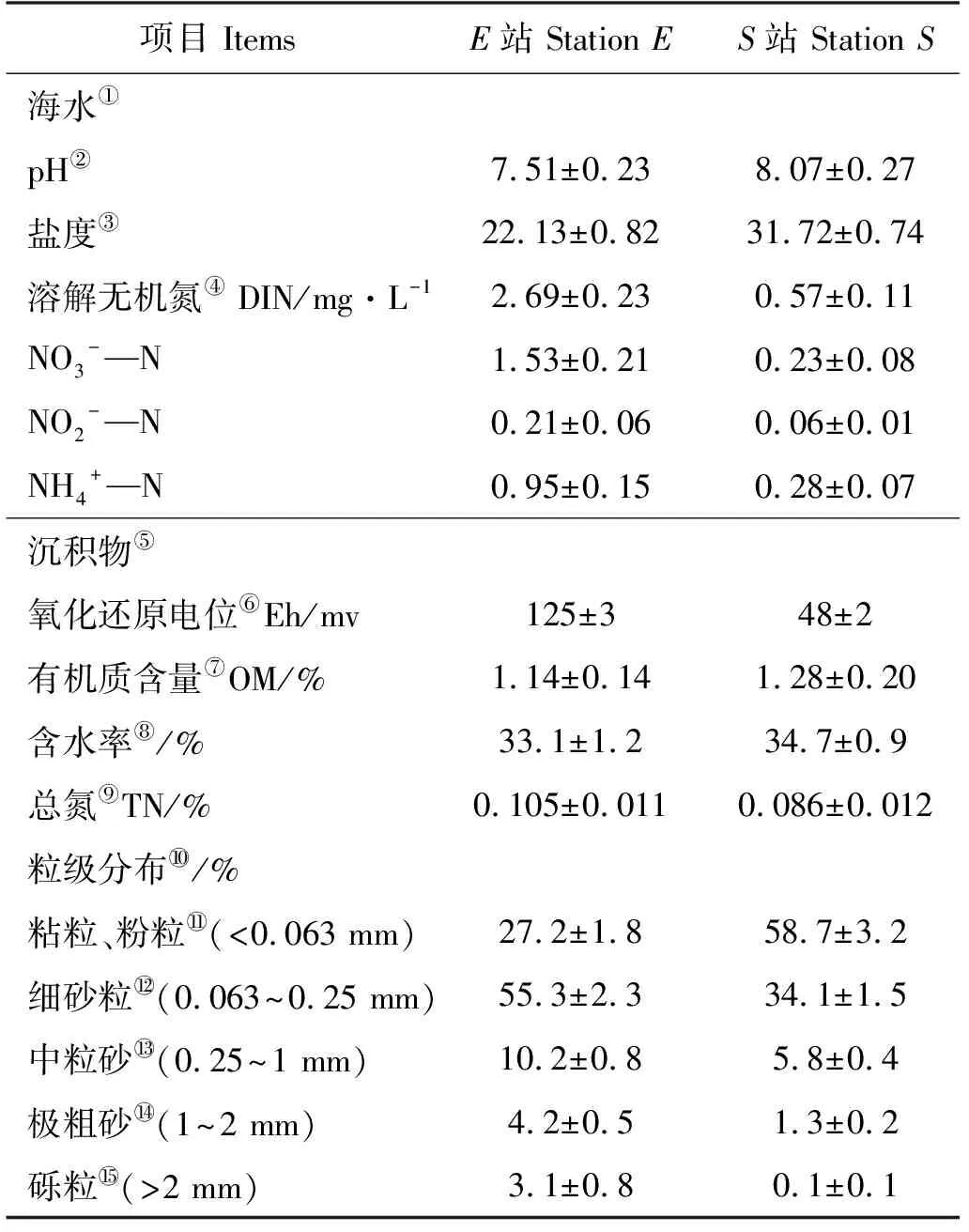
表2 两个站位海水和沉积物的理化参数Table 2 Physical and chemical characteristics of water and sediment from the two stations
Note:①Seawater;②Potential of hydrogen;③Salinity;④Dissolved inorganic nitrogen;⑤Sediment;⑥Redox potential;⑦Organic matter;⑧Water content;⑨Total nitrogen;⑩Grain size distribution;Silt and clay;Fine sand;Medium sand;Very coarse sand;Gravel.

(污染物对PDA的EC50值通过“四参数Logistic曲线”(y=min+(max-min) / (1 +(x/EC50)Hillslope)(r2>0.97,P< 0.0001)进行拟合所得。Note:The fitting curve and the meanEC50value were obtained by applying “Four Parameter Logistic Curve”(y=min+(max-min)/(1+x/EC50Hillslope)to the relation of the pollutant concentration and PDA.)
图2 菲、纳米银及其复合污染物对
2个站位沉积物反硝化潜势的影响
Fig.2 Effects of Phe, AgNPs and their combined
pollutants on PDA of sediments at two stations
2.2 对沉积物反硝化潜势的复合毒性效应评价
在评价实际环境的时,不能以简单叠加来判复合污染物的综合毒性[55]。虽然CA和IA法是评价复合毒性的两种经典方法,但CA法适用于有相似作用的毒性物质,用其评价不同作用模式的混合物时,可能导致混合物的毒性被高估[56];而IA法适用于评价不同作用模式的混合物,但用于相似作用模式的混合物时,会导致低估混合物的毒性[57]。而CI法评价污染物间的相互作用可以忽略单个污染物的毒性作用机制[58]。由于菲和纳米银对反硝化菌的作用模式尚未可知,本研究采用了CA、IA和CI三种方法评价了菲与纳米银对反硝化作用的复合毒性效应。
2.2.1 浓度相加模型 应用浓度相加模型评价二元混合物的复合毒性效应。复合污染条件下,E站位沉积物反硝化潜势的EC50值为0.83 (0.80~0.84) TU,S站位沉积物反硝化潜势EC50值为0.92 (0.91~0.93) TU (见表3),表明菲和纳米银二元复合污染对2个站位沉积物反硝化潜势均表现为协同作用。 TU法评价污染物复合毒性时,TU值接近1,表明污染物复合毒性有一定的浓度相加作用[34]。本研究中,2个站位引起50%毒性效应的TU值均接近1,说明菲和纳米银二元复合污染对沉积物反硝化潜势有一定的浓度相加作用,尤其是位于湾内的S站。
2.2.2 独立作用模型 运用独立作用模型对菲和纳米银二元混合体系的复合毒性评价结果见表4。2个站位各实验组的实际值E(Phe, AgNPs)均比预测值E(Phe, AgNPs)小,复合作用类型仍为协同作用。实际值E(Phe, AgNPs)与预测值E(Phe, AgNPs)的比值随着污染物浓度的增加呈明显降低趋势,而比值越接近0,协同作用程度越大,本研究大沽河河口区各个实验组的比值大于胶州湾内,由此推断,菲和纳米银对河口区的反硝化潜势的协同作用程度强于胶州湾内。

表3 浓度相加模型评价菲和纳米银对大沽河河口区和胶州湾内沉积物反硝化潜势的复合毒性Table 3 Combined toxicity of Phe and AgNPs on PDA in DRE and JZB estimated fromconcentration addition (CA)
2.2.3 中效/联合指数等效图法 图3显示了用CI法评价菲和纳米银对河口区和胶州湾内沉积物反硝化潜势抑制率CI值的变化趋势。2个站位的CI值随抑制率的增加均呈降低趋势,E和S站CI值的范围分别为0.44~0.71和0.61~0.82。菲和纳米银的二元混合物在2个站位的所有效应下均表现出了协同作用,且在低效应下表现为中等程度的协同作用,而随着效应的增强,协同作用程度增大,同时河口区的协同作用程度大于胶州湾内。
本研究三种评价方法获得菲和纳米银对反硝化作用的复合作用类型均为协同作用。邹秋燕通过相加指数法评价了纳米银和苯酚对反硝化单菌NO3-—N还原速率的复合作用类型,发现苯酚与纳米银以不同比例复合污染下,两者均表现为协同作用[59]。与本研究结果一致,菲和苯酚均为含苯环结构的有机污染物,致毒机理相似,均能透过细胞壁并使细胞关键酶失活,导致细胞死亡。造成协同作用现象可能的一种解释是Sikkema等提出的毒性作用麻醉假设,即PAHs与细菌细胞膜上的脂溶性化合物发生作用,进而影响到细胞膜的完整性和穿透性[60]。有研究表明在受PAHs污染的土壤中,重金属容易穿透进入微生物细胞,从而影响到细胞的功能[61]。因此,PAHs的污染可能导致纳米银更穿透反硝化菌,从而影响反硝化酶的形成及其活性,抑制反硝化作用。

表4 独立作用模型评价菲和纳米银对大沽河河口区和胶州湾内沉积物反硝化潜势的复合毒性Table 4 Combined toxicity of Phe and AgNPs on PDA in DRE and JZB estimated fromindependence action (IA)

图3 大沽河河口区和胶州湾内CI指数随反硝化潜势抑制率的变化趋势Fig.3 Combination index plot of mixtures of compounds toward PDA in DRE and JZB
2.3 浓度相加模型、独立作用模型和中效/联合指数等效图法的比较
不同评价方法对复合污染的评价结果可能会有差异,不同受试生物对同种污染物的敏感性也会因实验条件、测定方法及受试生物机能状况等因素而有所差异[62]。Chen等运用CA、IA和CI法评价氯菊酯和镉摇蚊幼虫的复合毒性效应时,发现结果一致,均表现出拮抗作用[63]。而Chen等运用CA、IA和CI法研究农药残留混合污染对蚯蚓联毒性时,将预测结果与实际试验观察值比较,发现利用CI法预测的二元、三元混合物的复合效应结果更为接近观察值[64]。为了更好的验证CA、IA和CI法在评价混合物对沉积物反硝化作用复合毒性的能力,本文利用三种方法对得到的混合物剂量效应关系曲线进行了对比。图4显示了利用CA、IA和CI法预测的菲和纳米银组成的二元混合物对2个站位沉积物反硝化潜势的剂量-效应关系曲线及复合污染实验的实际观测值,结果显示CA和CI法对两个站位复合效应的预测结果与实际观测值均更为接近,且CI法比CA法的预测值更略为接近实际观测值。由于CA和IA模型需要考虑污染物作用模式的限制,因此,整体而言,CI法较CA和IA法评价混合污染复合效应的能力更强,在混合物复合毒性评价及风险评估中不失为一种更有效的工具和方法。

图4 三种方法评价菲和纳米银对河口区(a)和湾内(b)反硝化潜势影响的预测值与实际观测值Fig.4 The actual value for expremental obervations and predicted value evaluted by three methods on effects of phenanthrene and AgNPs on PDA in DRE (a) and JZB (b)
3 结论
(1) 不同浓度水平的菲和纳米银单一及复合污染,均对大沽河河口区和胶州湾内2个站位沉积物的反硝化潜势具有抑制效应,随着污染物浓度的升高,抑制效应增强。对反硝化潜势的毒性效应顺序为:复合污染>菲>纳米银。
(2) 菲和纳米银及其复合污染对该河口区沉积物反硝化潜势抑制效应均比胶州湾内强。这可能与大沽河河口区较胶州湾内有较高的Eh和沉积物颗粒度,及较低的pH、盐度和有机质含量有关。
(3) 采用CA、IA和CI三种复合毒性评价方法评价菲和纳米银对大沽河河口区和胶州湾内2个站位沉积物反硝化潜势的复合毒性,均得出这两种污染物具有协同作用的结果。但对比三种评价方法,认为CI法较CA和IA法评价混合物复合效应的能力更强、更有效。
——记山东省东营市河口区河安小学校长刘波

